一種基于殼聚糖衍生物納米級超聲造影劑的制備方法與流程
本發明屬于超聲影像診斷技術領域,具體是涉及一種基于殼聚糖衍生物納米級超聲造影劑的制備方法。
背景技術:
超聲造影劑目前已廣泛應用于臨床疾病的診斷,大大提高了超聲診斷的準確率,是超聲醫學發展史上的一個“里程碑”。相對于常規CT、MRI等成像方式,超聲造影擁有無創無輻射、操作方便、價格低廉等優勢,成為了當前臨床上腫瘤診斷的重要手段。
而安全高效的超聲造影劑是超聲造影的基礎和關鍵。目前臨床上常用的是Sonovue為代表的超聲微泡造影劑,為脂質含氣超聲造影劑,其穩定性較差,容易發生自發破裂。且其粒徑大多集中在2~10μm范圍內,而毛細血管內皮間隙約為380~780nm,因此常用微泡超聲造影劑是無法穿透血管內皮間隙而到達腫瘤組織,缺乏對血管外腫瘤組織細胞的特異性,且對于乏血供的腫瘤容易漏檢,這大大限制了超聲造影對腫瘤等疾病的診斷能力。
高分子聚合物材料具有生物相容性好,可生物降解等優點,應用其制備的超聲造影劑,粒徑分布較均勻,穩定性高,抗壓性能較好,已成為目前超聲造影劑研究的熱點。而長氟碳鏈的全氟碳化合物在低溫時呈液態,即液態氟碳,當外界壓力降低或溫度升高至其沸點時,其會發生液氣相變,由液體變成氣體。其中,全氟戊烷在常壓下的沸點為29℃,而人體溫度為37℃,故其是一種較適于制備液氣相變型超聲造影劑的氟碳材料。
技術實現要素:
本發明的目的在于針對上述存在問題和不足,提供一種包裹液態氟碳,制備工藝簡便、安全無毒、價格低廉、生物相容性好的基于殼聚糖衍生物納米級超聲造影劑的制備方法。
本發明的技術方案是這樣實現的:
本發明所述基于殼聚糖衍生物納米級超聲造影劑的制備方法,該造影劑由液態氟碳內核和殼聚糖衍生物外殼構成,所述殼聚糖衍生物外殼的材料為正己酰羧甲基殼聚糖,其特點是包括以下步驟:
(1)合成正己酰羧甲基殼聚糖;
(2)配置正己酰羧甲基殼聚糖水溶液;
(3)將液態氟碳滴加到正己酰羧甲基殼聚糖水溶液中,進行超聲乳化處理,使液態氟碳包裹在正己酰羧甲基殼聚糖內,即得到由液態氟碳內核和殼聚糖衍生物外殼構成的納米級超聲造影劑。
其中,所述步驟(1)的具體操作方法如下:
(11)稱取250mg羧甲基殼聚糖,將其溶解于20ml純水并攪拌24h后,加入20ml甲醇攪拌均勻;
(12)在快速磁力攪拌下逐滴加入0.33ml的正己酸酐, 并維持轉速在1000rpm的攪拌條件下反應12 h;
(13)用乙醇水溶液(25% ,v/v)透析24h,再用純水透析24h,冷凍干燥即得到改性后的殼聚糖衍生物——正己酰羧甲基殼聚糖,并通過傅里葉紅外光譜和氫核磁波譜圖分析鑒定該產物。
所述步驟(2)的具體操作方法如下:
取正己酰羧甲基殼聚糖20mg~50mg分散于10ml純水中溶解。
所述步驟(3)的具體操作方法如下:
(31)取正己酰羧甲基殼聚糖水溶液,冰浴處理10min后,加入100ul~200ul液態氟碳;
(32)在冰浴條件下,對加入了液態氟碳的正己酰羧甲基殼聚糖水溶液進行超聲乳化處理,即得到殼聚糖衍生物納米級超聲造影劑,并將造影劑置于4℃冰箱中備用;所述超聲滿足如下條件:超聲振幅為20%,超聲總時間為2min,每超聲啟動3s ,間歇時間1s。
所述液態氟碳內核的材料為全氟戊烷或全氟己烷。
本發明與現有技術相比,具有以下優點:
本發明所用的材料是由天然高分子聚合物殼聚糖改性后制得的,材料安全無毒、生物相容性良好、價格低于合成磷脂;而且,本發明的制備工藝簡便,應用范圍廣,可通過對聚合物進行修飾,使其具有靶向特性,制備成靶向超聲造影劑;同時,該聚合物可用作為藥物和基因載體。
下面結合附圖對本發明作進一步的說明。
附圖說明
圖1為本發明所述正己酰羧甲基殼聚糖的傅里葉紅外光譜圖。
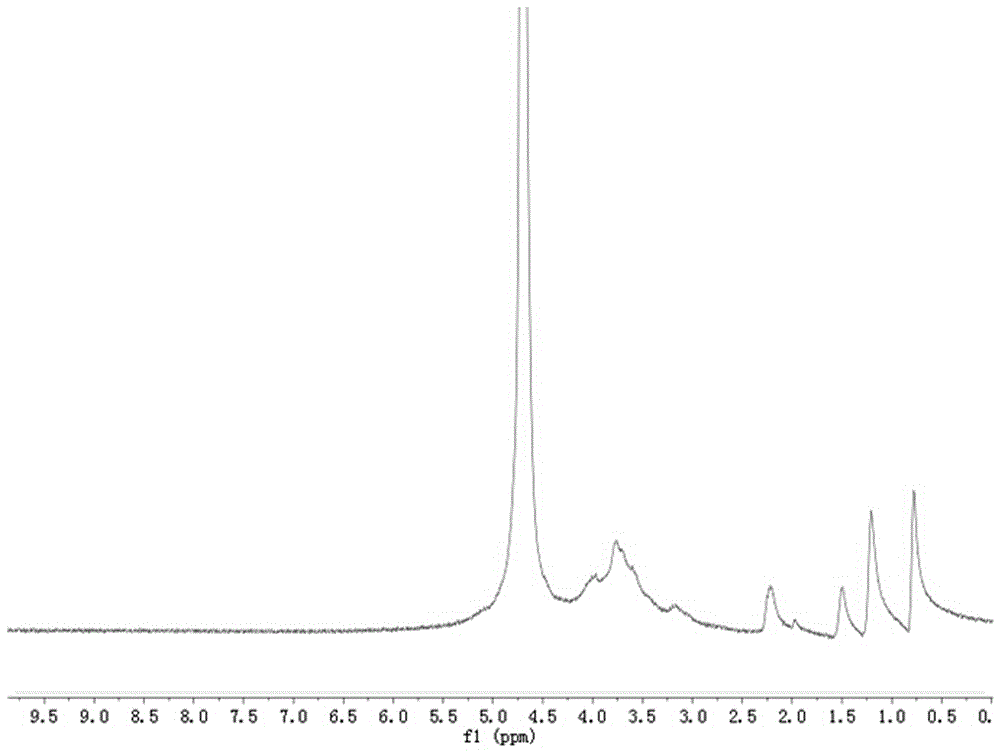
圖2為本發明所述正己酰羧甲基殼聚糖的核磁共振氫譜圖。
圖3為本發明所述正己酰羧甲基殼聚糖的細胞毒性分析圖。
圖4為本發明所述納米級超聲造影劑的透射電鏡圖。
圖5為本發明所述納米級超聲造影劑的粒徑分布圖。
圖6為本發明所述納米級超聲造影劑的電位圖。
圖7為本發明所述納米級超聲造影劑的體外超聲成像圖。
具體實施方式
下面結合具體實施例對本發明作進一步的說明。
實施例1:合成殼聚糖衍生物——正己酰羧甲基殼聚糖
稱取250 mg羧甲基殼聚糖,該羧甲基殼聚糖的分子量為20 KD,將其溶解于20ml純水并攪拌24 h后,加入20ml甲醇攪拌均勻;然后在快速磁力攪拌條件下逐滴加入0.33 ml正己酸酐, 并在1000 rpm轉速下攪拌反應12h;然后用乙醇水溶液(25% ,v/v)透析24 h,再用純水透析24 h,冷凍干燥即得到改性后的殼聚糖衍生物——正己酰羧甲基殼聚糖,并通過傅里葉紅外光譜和氫核磁波譜圖分析鑒定該產物。
羧甲基殼聚糖和正己酰羧甲基殼聚糖的紅外譜圖如圖1所示,由于羧甲基殼聚糖脫乙酰度高,所以對應于伯氨基上N-H的彎曲振動,掩蓋酰胺I帶和II帶的吸收峰。產物在1500-1550cm-1出現吸收峰,且譜帶明顯增強,2960cm-1和2870cm-1屬于甲基的伸縮振動,其吸收峰增強,說明碳鏈已連接到氨基上。
正己酰羧甲基殼聚糖的氫核磁波譜圖如圖2所示,其化學位移為1.9-2.9ppm為乙酰化基團,化學位移為3.6-4.0ppm為糖環上的氫位,2.0 ppm 為羧甲基殼聚糖-COCH3上的氫。化學位移0.8ppm 、1.2 ppm 、1.5 ppm 、2.2ppm 為連接在氨基上己烷上甲基和亞甲基。
實施例2:正己酰羧甲基殼聚糖的細胞毒性實驗
分別設置不同濃度(1mg、5mg、10mg)的正己酰羧甲基殼聚糖材料對A2780細胞的毒性作用。用含10%血清的培養基對正己酰羧甲基殼聚糖材料進行分散,配制成濃度分別1 mg/ml,5 mg/ml,10 mg/ml;對A2780細胞進行復蘇并傳代待其到指數生長期時,進行細胞計數,根據需要調整細胞密度;用96孔板鋪種細胞,每孔細胞懸液100ul,每孔分別接種 1*104 個細胞,在37℃培養箱中培養24h;用PBS對板內細胞進行清洗,加入3種不同濃度的正己酰羧甲基殼聚糖材料,每種濃度設置6個復孔,對照組加入不含納米粒的空白培養基,細胞與納米粒孵育 24 h ;配置10% CCK-8培養基吸取原培養板上的培養基,加入含有10%的 CCK-8 到含10%血清的培養基,放回培養箱繼續培養 1h。在全自動酶標儀上測定450 nm處吸光度 A。按照公式計算,細胞存活率=[(實驗組 OD 值—調零組 OD 值)/(對照組 OD 值-調零組OD 值)]×100%。
圖3結果顯示:隨著材料濃度增大,正己酰羧甲基殼聚糖的細胞毒性隨之增大,存活率減小,但增大到10mg/ml時,其細胞存活率仍在90%以上,說明該材料的生物安全性較好,無明顯體外細胞毒性作用。
實施例3:制備正己酰羧甲基殼聚糖包裹液態氟碳的納米級超聲造影劑,其步驟如下:
(1)合成殼聚糖衍生物——正己酰羧甲基殼聚糖;
(2)配置正己酰羧甲基殼聚糖水溶液,其方法是:取正己酰羧甲基殼聚糖20 mg~50 mg分散于10 ml純水中溶解形成為殼聚糖衍生物膠束水溶液,且殼聚糖衍生物膠束水溶液的濃度為2 mg/ml;
(3)取正己酰羧甲基殼聚糖水溶液冰浴處理10 min后,加入100 ul~200ul液態氟碳,所述液態氟碳為全氟戊烷或全氟己烷,而在本實施例中,液態氟碳為全氟戊烷,且正己酰羧甲基殼聚糖與全氟戊烷的比例為1mg:10μl;然后在冰浴條件下,對加入液態氟碳的殼聚糖衍生物膠束水溶液進行超聲乳化處理,使液態氟碳包裹在正己酰羧甲基殼聚糖內,即得到殼聚糖衍生物納米級超聲造影劑,并置于4℃冰箱中備用;
所述超聲滿足如下條件:超聲振幅為 20%,總超聲時間為2min,超聲啟動3s ,間歇時間1s。
實施例4:納米級超聲造影劑的表征
(1)采用光學顯微鏡及透射電鏡進行表面形貌和構成觀察
用生理鹽水將納米級超聲造影劑進行稀釋后,在倒置顯微鏡下觀察,對其加熱至37℃,可觀察到到造影劑液滴分散良好,表面光滑透明,大小較均勻。透射電鏡下觀察制備得到的超聲造影劑呈圓形,表面光滑透亮,如圖4所示。
(2)粒徑與電位:
將制得的包裹液態氟碳的納米超聲造影劑,取超純水稀釋后,用動態光散射法測定其粒徑并使用激光粒度儀檢測其Zeta電位,結果顯示其平均粒徑為(205.9±45.31)nm,如圖5所示,Zeta電位值為(-31.9±6.08)mV,如圖6所示。
實施例5:包裹全氟戊烷的納米級超聲造影劑的體外超聲造影實驗
在水槽中倒滿37℃脫氣水,用注射器抽取4 ml的超聲造影劑懸液到斯巴達吸管,放置于脫氣水下預熱5 min,超聲探頭浸沒于水面下并正對斯巴達吸管,用Philips IU-22 型超聲診斷儀(探頭型號L12-5)進行超聲成像,分別比較在不同載體濃度(2mg-5mg)、不同PFP體積比(1-2%)、不同時間段(0-12min)及同一濃度下,在不同機械指數(MI=0.4-0.6)觀察其成像效果。可見斯巴達吸管內回聲增強,成密集細點狀回聲圖,如圖7所示。
此外,本發明制備的殼聚糖衍生物納米級超聲造影劑中發現:改變殼聚糖和液態氟碳的比例、超聲功率與時間等都會影響造影劑的產量、粒徑分布及造影效果。
而且,本發明是采用納米粒自組裝方式制備了具有兩親性的殼聚糖衍生物膠束水溶液(正己酰羧甲基殼聚糖水溶液),在低溫條件下將液態氟碳與該具有兩親性的殼聚糖衍生物膠束水溶液混合,采用超聲細胞破碎儀或超聲波清洗機進行乳化,成功制備了以兩親性殼聚糖衍生物——正己酰羧甲基殼聚糖為外殼,包裹液態氟碳的納米級超聲造影劑。
本發明是通過實施案例來描述的,但并不對本發明構成限制,參照本發明的描述,所公開的實施例的其他變化,如對于本領域的專業人士是容易想到的,這樣的變化應該屬于本發明權利要求限定的范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!