一種BCR-ABL融合基因擴增試劑盒和檢測試劑盒的制作方法
本發明涉及基因擴增領域,具體地涉及一種融合基因的擴增試劑盒和檢測試劑盒。
背景技術:
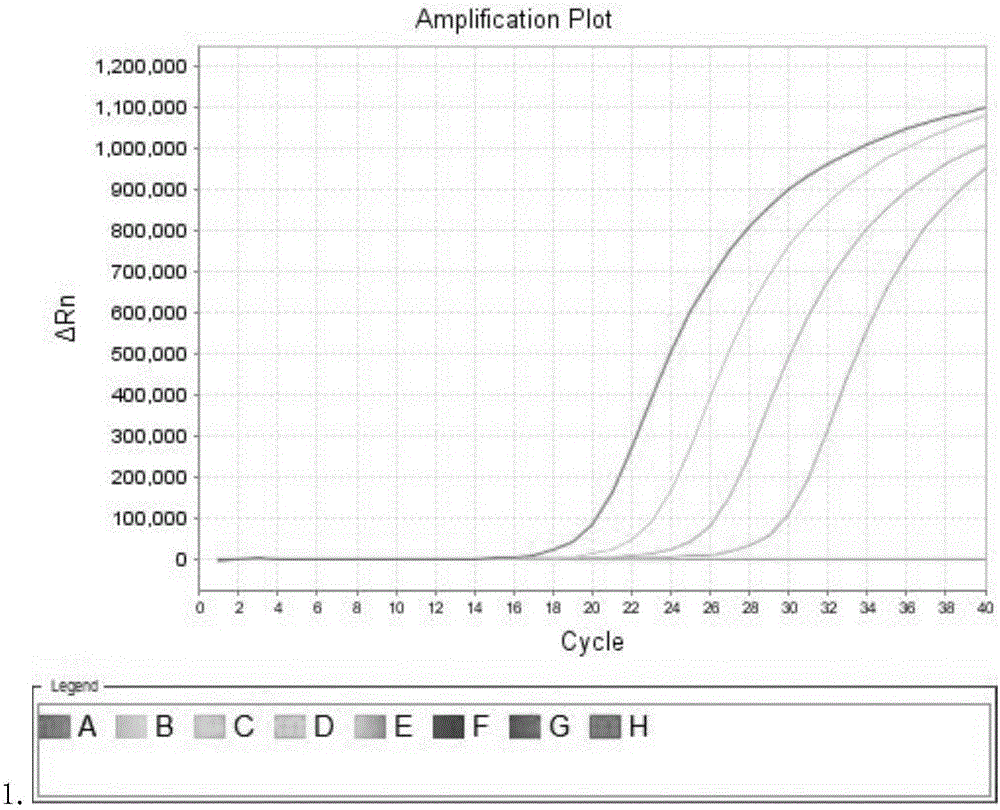
:慢性粒細胞白血病(CML)是一種起源于造血干細胞的惡性克隆性疾病,臨床上分為慢性期、加速期和急變期,急性變是臨床引起死亡的主要原因,細胞遺傳學特征是具有Ph染色體,即t(9;22)(q34;q11),其分子水平上形成bcr-ablmRNA。t(9;22)(q34;q11)為CML特征性染色體易位,形成斷裂點叢集區-Abelson癌基因(bcr—abl)融合基因,其中bcr—ablp210是CML的分子標志,近年國外在分子水平對BCR-ABL融合蛋白進行研究發現,根據BCR斷裂點位置的不同分為3個主要類型:M-bcr,m-bcr,μ-bcr,相應編碼p210蛋白、p190蛋白及p230蛋白(deKleinA,vanKesselAG,GrosveldG,etal.AcellularoncogeneistranslocatedtothePhiladelphiachromosomeinchronicmyelocyticleukaemia[J].Nature,1982,300(5894):765-767;BartramCR,deKleinA,HagemeigerA,etal.Translocationofcab1oncogenecorrelateswiththepresenceofaPhiladelphiachromosomeinchronicmyelocyticleukaemia[J].Nature,1983,306(5940):277-280;)。95%以上的CML患者可表達p210蛋白;5%以下的CML患者表達p190蛋白;在急性前B細胞白血病具有BCR-ABL融合蛋白陽性的患者中2/3表達為p190蛋白,1/3表達為p210蛋白(MeloJV.ThediversityofBCR-ABLfusionproteinsandtheirrelationshiptoleukemiaphenotype[J].Blood,1996,88(7):2375-2384;高錦聲,匡志超.人類染色體技術的研究進展[J].自然雜志,2003,25(5),267-271)。p190蛋白及p210蛋白不僅在CML患者中表達,而且也在急性髓系白血病患者中表達(MeloJV.ThediversityofBCR-ABLfusionproteinsandtheirrelationshiptoleukemiaphenotype[J].Blood,1996,88(7):2375-2384)。對白血病相關融合基因進行常規檢查,不僅可以為白血病診斷、分型、臨床治療選擇和預后判斷提供重要依據,同時也是白血病微小殘留病變(MRD)檢測的基礎。通過酪氨酸激酶抑制劑(TKI)治療后患者會很快好轉,各生理生化指標也會很快恢復,傳統的細胞遺傳學和FISH已經很難對殘留的微小病灶進行檢測。因此具有靈敏度高、精確度高且可以對微小病灶進行分子水平檢測的聚合酶鏈式反應(PCR)檢測方法,成為對患者初期檢測和預后監測檢查的重要手段(HughesT,DeiningerM,HochhausAetal.MonitoringCMLpatientsresponding totreatmentwithtyrosinekinaseinhibitors:reviewandrecommendationsforharmonizingcurrentmethodologyfordetectingBCR–ABLtranscriptsandkinasedomainmutationsandforexpressingresults.Blood[J].2006,108(1),28–37;KantarjianH,SchifferC,JonesDetal.MonitoringtheresponseandcourseofchronicmyeloidleukemiainthemoderneraofBCR–ABLtyrosinekinaseinhibitors:practicaladviceontheuseandinterpretationofmonitoringmethods[J].Blood,2008,111(4):1774–1780.),因此對BCR-ABL融合基因的分型和定量檢測對慢性粒細胞白血病(CML)的臨床診斷和愈后檢測意義重大。應用實時定量PCR(RQ—PCR)技術檢測該基因,能為臨床醫生提供定量的檢測結果,較定性檢測有更大的臨床應用價值。市場上已有產品和比較成熟的檢測技術:(1)經典的細胞遺傳學技術在白血病患者中的診斷價值早已得到公認,因其檢測直觀明確,不容易出現污染,可以標明每個患者Ph(+)細胞的百分率,因而可作為臨床療效判斷指標之一。但細胞遺傳學技術對一些染色體易位的亞顯微結構則較難發現,國外一組急性白血病的細胞遺傳學研究顯示,傳統細胞遺傳學分析異常檢出率僅為33.3%。染色體培養時間較長,一般需要1-2周,使其對白血病診斷及危險度分級帶來極大的不便;染色體培養技術要求高,培養有時較易失敗,即使培養成功也會出現部分細胞不分裂或細胞分裂象不足,這些均會導致常規的細胞遺傳學無法檢出陽性結果。Virgili等的研究也認為,常規的細胞遺傳學方法難以快速對Ph染色體陽性及BCR-ABL融合基因陽性的CML患者作出診斷和預后判斷(VirgiliA,BrazmaD,ReidAG,etal.FISHmappingofPhiladelphianegativeBCR/ABL1positiveCML[J].MolecularCytogenetics,2008,18(1):14.)。此外,細胞遺傳學對監測白血病患者的微小殘留病變(minimalresidualdisease,MRD)方面效果也較差,這些都限制了細胞遺傳學在白血病患者中的應用。(2)市場已有產品主要以熒光原位雜交(FISH)方法為主,是利用標記的脫氧核糖核酸(DNA)或核糖核酸(RNA)探針直接在染色體、細胞或組織水平定位特定靶核酸序列的分子細胞遺傳學技術,可同時分析分裂期和間期的多個細胞,并進行定量;可以檢測隱匿或微小的染色體畸變以及復雜核型;還可以使用多種熒光標記,顯示片段及基因之間的相對位置與方向,空間定位精確。其具有快速、安全、經濟、靈敏度高、特異性強等優點。應用基因特異性探針,可檢測大多數染色體重排、易位、倒位等結構改變,對MRD的檢測、臨床療效判斷的檢測、臨床療效的判定及預測預后也具有重要意義。其不受細胞中期分裂相的影響,可對間期細胞進行分析。但由于FISH檢測的實驗操作較復雜,標本處理不當時較難以檢出,易 出現假陽性的結果,費用較高,需要一定的設備,使FISH在臨床的應用不易推廣(LandegentJE,JansenindeWalN,DirksRW,etal.Useofwholecosmidclonedgenomicsequenceforchromosomallocalizationbynon-radioactiveinsituhybridization[J].HumGenet,1987,77(4):366-370;WeissingerEM,ThalmeierK,DullT,etal.Mosaicicminbcr-ablproteinexpressioninBcellsinchronicmyelogenousleukemia[J].IntJCancer,1996,68(5):577-582;吳彬,周淑云,劉曉力,等.聯合應用FISH和巢式RT2PCR技術檢測慢性髓系白血病bcr/abl融合基因[J].中華血液學雜志,2003,24(5):235-237.)。(3)蛋白質印跡法(WesternBlot)可對外周血標本進行檢測,陽性檢出率高達99%。樊英芳等人的研究認為該方法與骨髓Ph染色體檢測方法高度一致,為慢性粒細胞白血病的臨床檢測提供了新的簡便方法,有較高的臨床應用價值。但該法操作步驟復雜,處理樣品需要合適的溫度、pH值和足夠的細胞數才可以取得較好的結果(樊英芳.BCR/ABL融合基因產物p210在白血病診斷中的臨床意義[J].陜西醫學雜志,2005,34(11):1404-1406;王國蓉,于珍,趙耀中,等.慢性髓系白血病實時定量PCR檢測的BCR-ABL水平與臨床狀態關系的分析[J].中國臨床血液學雜志,2009,17(4):861-865.)。目前市場上主要銷售的產品如下:表1國內外上市產品情況(僅獲取國家批準文號的產品):表2美國食品藥物管理局(FDA)注冊產品表3歐洲共同體(CE)注冊產品3、隨著檢測技術不斷的發展,對BCR-ABL融合基因的檢測方法也在不斷的進展,由傳統的細胞遺傳學方法到熒光原位雜交法,發展到分子水平的聚合酶鏈式反應,這些方法均可檢出BCR-ABL轉錄本,但各種檢測方法在樣本處理和檢測操作均有其優缺點,為了取得較好的檢測結果,常常需要聯合使用幾種檢測方法。但由于針對CML的分子靶向治療的出現和發展,對CML的治療效果也有了很大的提高,對微小殘留病灶(MRD)的檢測也顯得愈發重要。傳統方法存在的一些問題:1.檢測靈敏性低,細胞遺傳學為5%,FISH為0.5%,而PCR方法可以達到0.001-0.0001%,等同于可以在10000-100000個正常細胞中一個細胞既10-5-10-6個細胞水平所表達出的BCR-ABL融合基因RNA。2.準確性差的缺點,傳統細胞遺傳學分析異常檢出率僅為33.3%,當Ph+<10%時易出現誤差,其敏感度已經無法對白血病患者的微小殘留病變(minimalresidualdisease,MRD)進行檢測,這些都限制了細胞遺傳學在白血病患者中的應用。3.傳統的細胞遺傳學方法和FISH方法均不能對BCR-ABL融合基因進行基因分型,而本發明采用針對各種BCR-ABL融合基因類型的特異性引物和探針,可以在檢測BCR-ABL是否存在的同時分辨出BCR-ABL融合基因的種類即基因型。4.檢測周期長,操作復雜及特殊儀器的使用,傳統的細胞遺傳學方法僅染色體培養一般就需要1-2周時間,且必須將細胞培養至細胞分裂期中期,大大增加了檢測時間,染色體培養技術要求高,培養有時較易失敗,即使培養成功也會出現部分細胞不分裂或細胞分裂象不足,這些均會導致常規的細胞遺傳學無法檢出陽性結果。FISH檢測的實驗操作較復雜,標本處理不當時較難以檢出,易出現假陽性的結果,費用較高,需要一定的設備,使FISH在臨床的應用不易推廣。因此,本領域迫切需要開發出能高效擴增BCR-ABL融合基因,且操作簡單快速的擴增試劑盒和檢測試劑盒,尤其對于MRD檢測領域,優勢更為明顯。技術實現要素:因此,本發明提供一種操作簡單快速的人BCR-ABL融合基因擴增試劑盒,另一方面,還提供一種人BCR-ABL融合基因檢測試劑盒。該試劑盒尤其是在MRD檢測領域,優勢更為明顯。本發明的第一方面,提供一種人BCR-ABL融合基因擴增試劑盒,所述試劑盒包含人BCR-ABL融合基因的引物序列和探針序列;所述引物序列為:b2a2上游引物:SEQIDNO:3;b2a2下游引物:SEQIDNO:4;b3a2上游引物:SEQIDNO:5;b3a2下游引物:SEQIDNO:6;e1a2上游引物:SEQIDNO:7;e1a2下游引物:SEQIDNO:8;e19a2上游引物:SEQIDNO:9,e19a2;下游引物:SEQIDNO:10;所述探針序列為:b2a2探針序列:SEQIDNO:11;b3a2探針序列:SEQIDNO:12;e1a2探針序列:SEQIDNO:13;e19a2探針序列:SEQIDNO:14。上述試劑盒還包含人BCR-ABL融合基因定量標準品的引物序列和探針序列;定量標準品上游引物:SEQIDNO:1;定量標準品下游引物:SEQIDNO:2;定量標準品探針序列:SEQIDNO:15。上述試劑盒組分為PCR反應液A、B、C:PCR反應液A配方:PCR反應液B配方:PCR反應液C配方:物品名稱最終濃度核酸酶抑制劑2.7u/ul脫氧核糖核酸聚合酶1.7u/ul尿嘧啶-N-糖基化酶1.7u/ul反轉錄酶21.3u/ul純化水余量本發明第二方面,提供一種人BCR-ABL融合基因檢測試劑盒,所述試劑盒包括定量標準品引物序列和探針序列,PCR反應液和陽性對照;所述陽性對照為分別含有SEQIDNO:16-19的質粒;所述PCR反應液包括權利要求1所述人BCR-ABL融合基因引物序列和探針序列;所述定量標準品引物序列為:定量標準品上游引物:SEQIDNO:1;定量標準品下游引物:SEQIDNO:2;所述定量標準品探針序列為SEQIDNO:15。上述陽性對照為分別含有SEQIDNO:16-19的pMD18T質粒載體;上述PCR反應液包含PCR反應液A、B、C:PCR反應液A配方:PCR反應液B配方:PCR反應液C配方:物品名稱最終濃度核酸酶抑制劑2.7u/ul脫氧核糖核酸聚合酶1.7u/ul尿嘧啶-N-糖基化酶1.7u/ul反轉錄酶21.3u/ul純化水余量上述試劑盒還包括陰性對照,所述陰性對照為純化水。上述試劑盒組分為:PCR反應液A配方:PCR反應液B配方:PCR反應液C配方:物品名稱最終濃度核酸酶抑制劑2.7u/ul脫氧核糖核酸聚合酶1.7u/ul尿嘧啶-N-糖基化酶1.7u/ul反轉錄酶21.3u/ul純化水余量陽性對照:分別含有SEQIDNO:16-19的pMD18T質粒載體;陰性對照:純化水;定量標準品:含正常人ABL基因序列(SEQIDNO:20)的質粒。上述試劑盒還包括核酸抽提試劑。上述核酸抽提試劑包括蛋白酶K、裂解液、洗滌液A、洗滌液B和洗脫液。本發明的有益效果:本發明檢測試劑盒由一步法反轉錄熒光探針定量PCR擴增試劑盒以及定量標準品和陰性、陽性對照組成。RNA抽提試劑可以采取市場上已有的產品,也可以按照本發明的配方提取,本發明RNA抽提試劑由裂解液、洗滌液A、洗滌液B、洗脫液組成,儲存于4-8℃,擴增試劑由PCR反應液A、PCR反應液B、PCR反應液C組成。陽性對照包括BCR-ABL融合基因四種基因型序列的質粒的陽性對照,包括b2a2、b3a2、e1a2、e19a2四種,陰性對照為純化水,定量標準品為含正常人ABL基因序列的質粒。1.操作簡單、快速,本發明RNA抽提部分采用柱抽法進行RNA抽提,操作簡單,僅需要一般實驗室所使用的離心機即可,在30分鐘內便可完成樣本RNA的抽提處理全過程,且擴增部分可一次進行最多96個樣本的測試(含1個陰性對照樣本)。2.降低耗材的使用以便降低檢測成本,采用本專利的方法在操作的全過程中需要的耗材只有RNA抽提所使用的2ml離心管、RNA純化柱、擴增使用的八連管或96孔板以及移液器吸頭。3.檢測結果準確,降低假陽性結果的出現,在擴增步驟加入陰性對照和陽性對照,內參,以此可以有效提高對假陽性和假陰性出現的判斷。4.對實驗污染的有效減少:a.本專利采用一步法反轉錄熒光定量方法,既將信使核糖核酸(mRNA)的反轉錄以及互補脫氧核糖核酸(cDNA)的PCR擴增所用試劑組分一次性加入反應管中并采用熒光定量PCR儀進行擴增反應,避免中途打開反應管加入新的反應試劑組分而導致實驗受到污染,進而造成實驗數據不準確;b.加入尿嘧啶DNA糖基化酶(UNG)并以dUTP替代dNTP等PCR污染控制措施可有效防止PCR的污染;c.采用TaqManMGB探針(美國AppliedBiosystems公司生產)以避免傳統TaqMan(美國AppliedBiosystems公司生產)探針產生的本底熒光對檢測結果的影響;5.更高的檢測限和更高的檢測精密度,采用柱抽法可盡量減少在RNA抽提過程中RNA的損失和各樣本抽提之間效率的差異,且PCR方法可對目的基因片段進行指數增長式的擴增,因此本專利具有更高的檢測精密度和檢測限。本發明的其他方面由于本文的公開內容,對本領域技術人員而言是顯而易見的。以下結合實施例對本發明進行詳細說明。附圖說明圖1濃度呈十倍梯度定量標準品擴增結果Amplificationplot:擴增圖譜△Rn:在給定的一組PCR條件下所生成信號的量值Cycle:循環圖2十倍梯度定量標準品擴增結果標準曲線Standcurve:標準曲線Target:檢測目標Slope:斜率R2:相關系數Eff%:擴增效率圖3精密度擴增結果圖4檢測限擴增結果圖5b2a2基因型樣本檢測結果圓圈圈定部分為FAM通道檢測曲線;方框圈定部分為CY5通道檢測曲線。圖6b3a2基因型樣本檢測結果圓圈圈定部分為JOE通道檢測曲線;方框圈定部分為CY5通道檢測曲線。圖7e1a2基因型樣本檢測結果圓圈圈定部分為ROX通道檢測曲線;方框圈定部分為CY5通道檢測曲線。圖8e19a2基因型樣本檢測結果圓圈圈定部分為CY3通道檢測曲線;方框圈定部分為CY5通道檢測曲線。圖9定量標準品序列(位于ABL基因上,SEQIDNO:20)圖10陽性對照1序列(b2a2:SEQIDNO:16)圖11陽性對照2序列(b3a2:SEQIDNO:17)圖12陽性對照3序列(e1a2:SEQIDNO:18)圖13陽性對照4序列(e19a2:SEQIDNO:19)圖9-圖13中單下劃線為引物序列位置,雙下劃線為探針序列位置具體實施方式本專利檢測方法主要包括樣本處理即樣本核酸的提取和核酸擴增、檢測三部分,在核酸擴增檢測部分,考慮到引物探針為核酸序列以及反轉錄酶、Taq脫氧核糖核酸聚合酶、尿嘧啶-N-糖基化酶的穩定性,因此將PCR反應液分為A、B、C三組,便于保證擴增試劑盒和檢測試劑盒中各反應液的穩定性,在使用時再按照比例混合使用。本發明經過發明人大量實驗,確定出以下序列和試劑盒配方,以快速高效地進行樣品PCR擴增和檢測,操作方便,節約了 大量時間。對設備要求也低。具體試劑盒包含試劑和檢測步驟如下所示:實施例1試劑盒組分及使用方法表4核酸擴增試劑盒1表5核酸檢測試劑盒1表6核酸檢測試劑盒2具體檢測步驟如下所示:1.RNA抽提步驟(RNA抽提試劑也可選用市場上已有的產品,如:a、寶生物工程有限公司產品RNAisoBlood,b、天根生化科技(北京)有限公司產品血液/細胞/組織基因組DNA提取試劑盒等):將裂解液置70℃加熱5分鐘,使試劑瓶內的結晶全部溶解。實驗前在洗滌液A中加入9ml無水乙醇(自備)、洗滌液B中加入16ml無水乙醇并顛倒混勻備用,將定量標準品10倍梯度稀釋成4個梯度。計算測試總數(N)(N=待測標本數N+陰性對照數1支+陽性對照數4支+定量標準品4支)。1.1取N個1.5mL離心管(N=待測標本數量N+陰性對照1支+陽性對照4支+定量標準品4支),作好標記后分別加入40μL蛋白酶K;1.2分別加入200μL待測樣本(血液:血液樣本來源于上海市第七人民醫院)、陰性對照、陽性對照,并反復吹打5次混勻或振蕩5~10秒,充分混勻;1.3分別加入200μL裂解液,蓋上管蓋,振蕩5~10秒,充分混勻,瞬時離心后置70℃孵育10分鐘;1.4瞬時離心后加入220μL無水乙醇,振蕩5~10秒,充分混勻。瞬時離心,將管蓋和管壁上的液體離心下來;1.5將作好標記的核酸提取柱插入2mL離心管中,蓋上管蓋,10000×g離心1分鐘;1.6將作好標記的核酸提取柱插入新的2mL離心管中并加入700μL洗滌液A,蓋上管蓋,10000×g離心1分鐘;1.7將作好標記的核酸提取柱插入新的2mL離心管中并加入700μL洗滌液B,蓋上管蓋,10000×g離心1分鐘;1.8將作好標記的核酸提取柱插入新的2mL離心管中,蓋上管蓋,20000×g離心3分鐘,將殘液去除干凈;1.9將核酸提取柱取出,放入新的2mL離心管中,小心加入50μL洗脫液至膜面的中央位置,蓋上管蓋,靜置1分鐘,同時做好標記;1.1013000×g離心1分鐘,離心管中收集的液體即為PCR反應模板。2.PCR試劑準備2.1取出PCR反應液A、PCR反應液B和PCR反應液C,置室溫下融化后,振蕩5~10秒,瞬時離心后備用;2.2計算測試總數(N)(N=待測標本數N+陰性對照數1支+陽性對照數4支+定量標準品4支),按10:8:2(PCR反應液A:PCR反應液B:PCR反應液C)的比例配制PCR反應液,依次加入各組份后,振蕩5~10秒,瞬時離心,以每個測試20μL的量將PCR反應液分裝至PCR反應管中。3.加樣在裝有PCR反應液的反應管中分別加入20μL待測模板(樣本處理步驟1.10離心管中收集的液體),蓋上管蓋,離心數秒后進行PCR擴增檢測。4.擴增程序:擴增可使用的儀器:ABI7500,LightCycler480。表7PCR擴增參數表8PCR擴增所使用的引物序列:表9PCR擴增所使用的探針序列以上序列依次為SEQIDNO:11-15。表10PCR反應液A配方:表11PCR反應液B配方:表12PCR反應液C配方:物品名稱最終濃度核酸酶抑制劑2.7u/ul脫氧核糖核酸聚合酶1.7u/ul尿嘧啶-N-糖基化酶1.7u/ul反轉錄酶21.3u/ul純化水至0.1ml表13蛋白酶K配方:物品名稱300ml加入量蛋白酶K2g超純水300mL表14裂解液配方:物品名稱1L加入量硫氰酸胍467.5g2M氯化鉀240ml2M三羥甲基氨基甲烷5ml0.5M乙二胺四乙酸2ml1M鹽酸調節pH值至6.2聚乙二醇辛基苯基醚10ml純化水定容至1000ml表15洗滌液A配方:表16洗滌液B配制表17洗脫液配方:物品名稱1L加入量氯化鈉1.7g純化水定容至1000ml待檢測樣本的定量檢測:濃度本專利中定量參考品為含有定量標準品序列的質粒,其濃度可用分光光度計測試獲得,再將其十倍濃度梯度進行稀釋成4個濃度便可獲得本專利測試時使用的定量標準品,在與待測樣本同時進行擴增檢測后,對定量參考品進行濃度賦值便可由擴增儀器自動計算出定量標準品的熒光信號強度與的線性關系,根據其線性關系的可靠性判斷實驗結果的可信度。定量標準品擴增結果如圖1,其濃度與檢測獲得的CT值的線性關系如圖2,其斜率為3.394,R2為1,顯示出非常良好的線性關系,因此對樣本的相對定量結果具有很好的可信度。精密度:在測試精密度時,將同一樣本進行十次重復抽提并同時進行擴增,擴增結果如圖3,擴增結果CT值如表1所示,經計算其CT值變異系數(CV)值為2.48%,表現出良好的精密度。表18精密度擴增結果CT值檢測限:將定量標準品十倍梯度稀釋至4×107、4×106、4×105、4×104拷貝進行擴增,結果如圖4所示,檢測結果良好,再將定量標準品十倍梯度稀釋至400拷貝和100拷貝兩個濃度梯度進行擴增,各擴增46個復孔,擴增結果如圖5所示,在400拷貝時有46個復孔均為陽性,檢出率為100%,在100拷貝時有44個復孔均為陽性,2個復孔為陰性,檢出率為(44/46)×100%=95.65%,顯示出極高的檢出率以及良好的檢測限。樣本檢測結果:根據擴增結果選擇各檢測目的基因型的探針檢測通道,并對各通道設置不同的顯示顏色便可直觀的通過擴增結果圖看出樣本的基因型,結果如圖5(b2a2)、6(b3a2)、7(e1a2)、8(e19a2)所示。樣本檢測結果的相對定量分析:樣本的相對定量分析采用2-△△Ct法進行分析。x(相對表達倍數)=2-△△CT△△Ct=△E–△C△E=Ct實驗組目的基因–Ct(ABL基因)△C=Ct對照組目的基因–Ct(ABL基因)在本發明提及的所有文獻都在本申請中引用作為參考,就如同每一篇文獻被單獨引用作為參考那樣。此外應理解,在閱讀了本發明的上述講授內容之后,本領域技術人員可以對本發明作各種改動或修改,這些等價形式同樣落于本申請所附權利要求書所限定的范圍。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1
- 瓊脂糖在pcr擴增中的應用、pcr擴增試劑盒及pcr擴增方法
- 一種基于重組酶聚合酶擴增技術原理的組織胞漿菌感染分子診斷試劑盒及其應用
- 試劑盒及其在生殖道病原體擴增檢測中的用圖
- 一種基于核糖體dna its1基因檢測華支睪吸蟲囊蚴的pcr擴增試劑盒及擴增引物的制作方法
- 一種檢測簡單異尖線蟲和華支睪吸蟲囊蚴的雙重pcr擴增試劑盒及其擴增引物的制作方法
- 一種基于線粒體coi基因檢測華支睪吸蟲囊蚴的pcr擴增試劑盒及擴增引物的制作方法
- 一種用于血液直接熒光pcr擴增的反應液及其試劑盒的制作方法
- 同時擴增人常染色體和y染色體str基因座的熒光標記復合擴增試劑盒及其應用
- 一種人基因組dna34個基因座的復合擴增的試劑盒的制作方法
- 一種具有增強鑒別能力的常染色體str基因座熒光標記復合擴增試劑盒及其應用