一種多交叉恒溫擴增結合金納米生物傳感的核酸檢測技術的制作方法
本發明公開了一種核酸擴增技術及應用,屬于微生物學和分子生物學領域。
背景技術:
在現代醫學和生物學領域,核酸擴增是一種不可缺少的技術,廣泛應用于基礎研究、生物研究、臨床診斷、流行病研究、考古研究、轉基因研究等領域。在已經建立的核酸擴增技術中,聚合酶鏈式反應(PCR)是第一個被建立的體外核酸擴增技術,具有劃時代意義,現已被廣泛應用于生物、醫學等相關領域。然而,PCR進行核酸擴增時,受實驗室的條件限制,依賴于復雜昂貴的熱循環儀器。此外,PCR產物的檢測比較復雜,需要一套專門的流程及設備。這些劣勢限制了該技術的廣泛應用,尤其在經濟落后的地區及快速診斷領域。因此,對于生物相關研究領域而言,非常有必要發展一個簡單、快速、敏感的核酸擴增方法。
為了克服PCR擴增技術的劣勢,近年來發展了許多恒溫擴增技術。恒溫擴增技術較PCR技術而言,不依賴于熱循環擴增設備、反應速度快、敏感性好。因此,恒溫擴增技術有利于實現快速擴增、便捷檢測及現場診斷。到目前為止,已發展的恒溫擴增技術有10余種,應用較為廣泛的有滾環擴增(RCA)、鏈置換擴增(SDA)、解旋酶依賴的恒溫擴增(HDA)、環介導恒溫擴增(LAMP)、交叉擴增(CPA)等。然而,這些恒溫技術實現核酸擴增需要多種酶同時工作,依賴于昂貴的試劑,復雜的操作步驟。因此這些方法的實用性、便捷性、可操作性有待于提高,尤其是在快速診斷領域及欠發達地區。為了克服PCR技術及現有恒溫擴增技術的劣勢,實現便捷、快速、敏感及特異的擴增核酸序列,在生物、農業、醫學等領域,有必要發展一種操作簡單、經濟實用、反應速度快、特異性強的核酸擴增技術。
為了實現這一目標,發明人近期已經建立了一種新的核酸擴增技術,命名為多交叉置換擴增(Multiple Cross Displacement Amplification,MCDA),相關內容公開于CN104946744A,本申請引用該專利文件作為現有技術構成本申請說明書的一個部分。MCDA在恒溫條件下實現核酸擴增,僅使用一種恒溫置換酶、擴增速度快、反應靈敏、特異性高。MCDA擴增之后,其產物的檢測可以通過瓊脂糖電泳后染色觀察。較為簡便的方法是直接在產物中加入SYBR GreenⅠ染色,呈現綠色為陽性反應,橙紅色為陰性反應。也可以通過擴增副產物焦磷酸鎂沉淀的濁度進行判斷,液體渾濁,離心或有白色沉淀的為陽性反應,無此現象的則為陰性反應。現在更為簡單的方法是在反應混合物中加入可視染料,陽性反應管的顏色從淺灰色變為綠色,陰性反應管則保持原來的淺灰色。然而,這些方法都只能檢測MCDA反應是否進行,不能識別針對特定靶序列的特異性擴增,導致MCDA在檢測目的序列時,其結果的判定缺乏特異性。因此,傳統MCDA檢測很難實現對多重目的片段的同時檢測,這極大限制了MCDA的廣泛應用。
志賀菌(Shigella spp.)和沙門菌(Salmonella spp.)是兩種重要的食源性疾病病原體,廣泛存在于環境中的革蘭氏陰性菌。志賀菌和沙門菌常分離自食品樣本及臨床標本,引起食源性的腸熱癥,臨床癥狀表現為發熱、腹瀉。據WHO數據統計,全球每年有180萬病人死于腹瀉,其中絕大多數病例是由志賀菌和沙門菌導致,從而受到全球衛生部門的高度關注,成為各國的重大公共衛生問題。在發展中國家,志賀菌是引起菌痢的最主要的病原體,然而,無論是在發展中國家還是發達國家,沙門菌是導致食源性疾病最重要的病原體。因此,為了給予臨床病人準確快速的治療,食源性病原體監測以及志賀菌和沙門菌的流行病學調查,研發一個省時、省力和特異性較高的診斷方法,能夠同時檢測和鑒定志賀菌和沙門菌成為必要。
目前對于志賀菌和沙門菌的檢測主要依賴于傳統的增菌培養和生化鑒定,該方法耗時大約5到7天,包括增菌、選擇培養及后續的生化鑒定,其劣勢在于耗時耗力,生化結果的判讀依賴于人的主觀判斷,導致結果重復性差,易錯判。隨著核酸診斷技術的快速發展,一些以PCR為基礎的診斷技術(如普通PCR技術,熒光PCR技術)被用于志賀菌和沙門菌的快速檢測,然而這些方法依賴于昂貴的儀器設備,需要后續的電泳操作,昂貴的探針合成,以及熟練的操作人員。對于一些條件落后的實驗室無法進行,從而限制了這些技術的運用。目前運用這些檢測技術診斷沙門菌和志賀菌的PCR方法和Real-time PCR方法,診斷靈敏度差,檢測過程耗時較長,不利于快速檢測和應急檢測。
本發明意欲針對志賀菌的特異基因ipaH和沙門菌的特異基因invA分別設計兩套MCDA擴增引物,開發出能夠快速、敏感、方便和特異地鑒定出志賀菌和沙門菌病原體的一種新型的MCDA檢測技術。
技術實現要素:
基于上述目的,本發明首先提供了一種擴增目的基因片段并對擴增結果進行檢測的方法,該方法以CN104946744A所公開的MCDA為基礎,將MCDA技術與納米生物檢測技術相結合,開發了依賴MCDA技術、實現多重檢測的納米生物傳感技術,該技術被命名為多交叉恒溫擴增結合金納米生物傳感的核酸檢測技術(Visual and multiplex detection of nucleic acid sequence by multiple cross displacement amplification coupled with gold nanoparticle-based lateral flow biosensor,MCDA-LFB)。所述方法包括以下步驟:
(1)自所述目的基因片段的3’端起,設定第一任意序列F1s,第二任意序列P1s,自所述目的基因片段的5’端起,設定第三任意序列F2,第四任意序列P2,在所述第二任意序列P1s的5’端設定第五任意序列C1,和/或在所述第四任意序列P2的3’端設定第六任意序列C2s,在序列C1的3’端和5’端分別設定第七任意序列D1和第八任意序列R1,在序列C2s的5’端和3’端分別設定第九任意序列D2s和第十任意序列R2s;
(2)提供置換引物F1,所述引物F1含有與序列F1s互補的序列,提供交叉引物CP1,所述引物CP1自5’端依次含有序列C1和與序列P1s互補的序列P1,提供置換引物F2,所述引物含有序列F2,提供交叉引物CP2,所述引物CP2自5’端依次含有序列C2s互補的序列C2和序列P2;
(3)提供擴增引物,所述擴增引物包括含有序列C1的擴增引物C1,和/或含有與序列C2s互補的擴增引物C2,含有序列D1的擴增引物D1、含有序列R1的擴增引物R1、含有與序列D2s互補的擴增引物D2和含有與序列R2s互補的擴增引物R2,其中,在所述擴增引物C1或C2的5’端標記生物素,在所述擴增引物D1或D2在5’端標記半抗原;
(4)在鏈移位型聚合酶、解鏈溫度調節劑、引物存在下,使用目的基因片段作為模板恒溫擴增DNA;
(5)使用金納米生物傳感器檢測步驟(4)的擴增產物。
在一個優選的技術方案中,在所述擴增引物D1或D2的5’端所標記的半抗原為熒光素或地高辛。
在一個更為優選的技術方案中,所述金納米生物傳感器包括一背板,在所述背板上依次設置裝有樣品墊、金標墊、硝酸纖維素膜及吸水墊,在所述纖維素膜上依次設置檢測線1、檢測線2及控制線,在金標墊、檢測線1、檢測線2及控制線區域依次包被有金納米粒子偶聯的鏈霉素親和素(SA-G)、抗熒光素抗體、抗地高辛抗體及生物素偶聯的牛血清蛋白(B-BSA)。
其次,本發明還提供了上述方法在檢測沙門菌中的應用,所述置換引物F1的序列如SEQ ID NO:1所示,所述置換引物F2的序列如SEQ ID NO:2所示;所述交叉引物CP1的序列如SEQ ID NO:3所示,所述交叉引物CP2的序列如SEQ ID NO:5所示,引物C1的序列如SEQ ID NO:6所示,引物C2的序列如SEQ ID NO:8所示,引物D1的序列如SEQ ID NO:9所示,引物D2的序列如SEQ ID NO:11所示,引物R1的序列如SEQ ID NO:12所示,引物R2的序列如SEQ ID NO:13所示。
同時,本發明還提供了上述方法在檢測志賀菌中的應用,所述置換引物F1的序列如SEQ ID NO:14所示,所述置換引物F2的序列如SEQ ID NO:15所示;所述交叉引物CP1的序列如SEQ ID NO:16所示,所述交叉引物CP2的序列如SEQ ID NO:18所示,引物C1的序列如SEQ ID NO:19所示,引物C2的序列如SEQ ID NO:20所示,引物D1的序列如SEQ ID NO:22所示,引物D2的序列如SEQ ID NO:23所示,引物R1的序列如SEQ ID NO:25所示,引物R2的序列如SEQ ID NO:26所示。
再次,本發明提供了上述方法在檢測多種目的基因片段中的應用,所述應用提供針對多個不同的目的基因片段的步驟(2)和(3)所述的交叉引物CP1、CP2,置換引物F1、F2,擴增引物C1、C2、D1、D2、R1和R2。
在一個優選的技術方案中,所述多種目的基因片段分別為沙門菌的invA基因和志賀菌的ipaH基因。
又次,本發明還提供了一組用于恒溫擴增沙門菌invA基因的引物序列,所述序列包括:如SEQ ID NO:1所示的置換引物F1,SEQ ID NO:2所示的置換引物F2,如SEQ ID NO:3所示的交叉引物CP1,如SEQ ID NO:5所示的交叉引物CP2,如SEQ ID NO:6所示的擴增引物C1,如SEQ ID NO:8所示的擴增引物C2,如SEQ ID NO:9所示的擴增引物D1,如SEQ ID NO:11所示的擴增引物D2,如SEQ ID NO:12所示的擴增引物R1,如SEQ ID NO:13所示的擴增引物R2。
同時,本發明還提供了一組用于恒溫擴增志賀菌ipaH基因的引物序列,所述序列包括:如SEQ ID NO:14所示的置換引物F1,SEQ ID NO:15所示的置換引物F2,如SEQ ID NO:16所示的交叉引物CP1,如SEQ ID NO:18所示的交叉引物CP2,如SEQ ID NO:19所示的擴增引物C1,如SEQ ID NO:20所示的擴增引物C2,如SEQ ID NO:22所示的擴增引物D1,如SEQ ID NO:23所示的擴增引物D2,如SEQ ID NO:25所示的擴增引物R1,如SEQ ID NO:26所示的擴增引物R2。
最后,本發明提供了一種用于對恒溫擴增基因產物進行檢測的金納米生物傳感器,所述傳感器包括一背板,在所述背板上依次設置裝有樣品墊、金標墊、硝酸纖維素膜及吸水墊,在所述纖維素膜上依次設置檢測線1、檢測線2及控制線,在金標墊、檢測線1、檢測線2及控制線區域依次包被有SA-G、抗熒光素抗體、抗地高辛抗體及B-BSA。
在本發明的MCDA擴增體系中,能夠形成大量雙標的可檢測產物。引物C1或C2的5’端標記生物素,引物D1或D2的5’端標記半抗原。該雙標的產物能被金納米生物傳感器(LFB)檢測,從而進行可視檢測。當針對不同靶標設計的引物D2進行不同半抗原標記時,可實現多重檢測。因此,在利用MCDA-LFB技術進行靶序列檢測時,可利用引物C1和D1構建可檢測產物,也可利用引物C2和D2構建可檢測產物。
在標準的MCDA-LFB檢測體系中,其獨立檢測沙門菌的invA基因和志賀菌的ipaH基因的檢測下限為10fg/反應管,其靈敏度與ET-MCDA技術相同。
MCDA-LFB多重檢測體系在檢測沙門菌時的檢測下限為10fg DNA/反應管。MCDA-LFB多重檢測體系在檢測志賀菌時的檢測下限為10fgDNA/反應管。
以常見的致病菌及條件致病菌(沙門菌、志賀菌、單增李斯特菌、霍亂弧菌、副溶血性弧菌、創傷弧菌、糞腸球菌、金黃色葡萄球菌、空腸彎曲菌、蠟樣芽胞桿菌、腸致病性大腸桿菌、腸產毒性大腸桿菌、腸侵襲性大腸桿菌等共63株菌)DNA為模板評價MCDA-LFB技術的特異性。MCDA-LFB技術能準確鑒別沙門菌和志賀菌,說明MCDA-LFB方法的特異性良好。
附圖說明
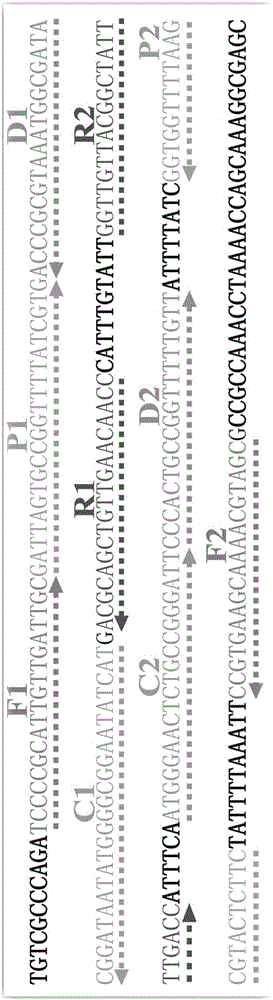
圖1.MCDA-LFB引物設計的位置和方向示意圖;
圖2.MCDA擴增原理及金納米生物傳感器結構示意圖;
圖3.標準MCDA-LFB檢測結果圖譜;
圖4.標準MCDA-LFB最佳反應溫度測試結果圖譜;
圖5.MCDA-LFB檢測單一靶標的靈敏度結果圖譜;
圖6.多重MCDA-LFB檢測擴增曲線圖;
圖7.運用LFB可視化讀取多重MCDA擴增結果圖;
圖8.多重MCDA-LFB技術的最佳反應時間測試結果圖譜;
圖9.MCDA-LFB技術的特異性檢測評價圖譜
具體實施方式
下面結合具體實施例來進一步描述本發明,本發明的優點和特點將會隨著描述而更為清楚。但這些實施例僅是范例性的,并不對本發明的保護范圍構成任何限制。
一、MCDA-LFB檢測原理
1.MCDA反應體系包括10條引物,識別靶序列的10個區域,包括2條交叉內引物,即CP1和CP2(Cross Primer,CP),2條置換引物,即F1和F2,6條擴增引物,即D1、C1、R1、D2、C2和R2。為了構建可檢測產物,擴增引物C1或C2在5’端標記生物素,擴增引物D1或D2在5’端標記半抗原(熒光素或者地高辛),新標記的引物被命名為C1*,C2*,D1*和D2*。CP1包含序列C1和與序列P1s互補的序列P1,即5′-Cl-P1;CP2包含序列C2s互補的序列C2和序列P2,即5′-C2-P2。兩條交叉引物CP1和CP2是介導MCDA擴增的主要引物;置換引物F1和F2在MCDA反應中發揮置換作用,置換交叉引物CP1和CP2;六條擴增引物D1*、C1*、R1、D2*、C2*和R2能夠加速MCDA反應及增加MCDA產物量(見圖2A)。
在既定的恒溫條件下,雙鏈DNA在處于半解離和半結合的動態平衡狀態中,任何一個引物向雙鏈DNA的互補部位進行堿基配對延伸時,另一條鏈就會解離,變成單鏈。首先在Bst DNA聚合酶的作用下,以CP1引物P1區段的3′末端為起點,與對應的DNA互補序列配對,啟動鏈置換DNA合成。F1引物與C1s前端F1s序列互補,以3′末端為起點,通過鏈置換活性DNA聚合酶的作用,首先置換出CP1引物合成的DNA鏈,同時合成自身DNA。最終F1引物合成而得的DNA鏈與模板DNA形成雙鏈。然后由交叉引物CP1先合成的DNA鏈被F1引物進行鏈置換產生一單鏈,該單鏈的D1s、C1s、R1s、P2s、F2s區域能夠依次與擴增引物D1*、C1*、R1,交叉引物CP2及置換引物F2結合,并發揮鏈置換擴增作用(步驟1、2)。C1*引物擴增并置換D1*的擴增鏈,生成短片段C1s-D1*產物,該產物能夠與C1*和CP1引物結合,啟動鏈置換擴增,進入循環擴增1(步驟3和循環1)。在循環擴增1中,隨著MCDA擴增的進行,大量的雙標產物被形成,C1*端標記生物素,D1*端標記半抗原。該雙標的產物能被金納米生物傳感器檢測,從而進行可視檢測。當針對不同靶標設計的D1*引物進行不同半抗原標記時,可實現多重檢測。后續的MCDA擴增,包括步驟4、5和6,詳見中國專利CN104946744A,該專利內容通過引用形式并入本發明的公開內容之中。此外,由于C2*和D2*的擴增過程與C1*和D1*的擴增過程相似,在MCDA擴增體系中,同樣能夠形成大量的雙標的可檢測產物。C2*端標記生物素,D2*端標記半抗原。該雙標的產物能被金納米生物傳感器(LFB)檢測,從而進行可視檢測。當針對不同靶標設計的D2*引物進行不同半抗原標記時,可實現多重檢測。因此,在利用MCDA-LFB技術進行靶序列檢測時,可利用C1*和D1*引物構建可檢測產物,也可利用C2*和D2*引物構建可檢測產物。
2.生物傳檢測器(LFB)的設計
生物檢測器(LFB)的設計見圖2B。LFB包含五個部分:1.背板;2.樣品墊;3.金標墊;4.硝酸纖維素膜(反應區域);5.吸水墊。首先將樣品墊、金標墊、纖維膜及吸水墊依次組裝在背板上。然后將金納米粒子偶聯的鏈霉素親和素(SA-GNP)、抗熒光素抗體(anti-FITC)、抗地高辛抗體(anti-Dig)及生物素偶聯的牛血清蛋白(Biotin-BSA)分別包被在金標墊、檢測線1(TL1)、檢測線2(TL2)及控制線(CL)區域,待干燥后備用。圖2B中,擴增子(I)為生物素和熒光素同時標記的MCDA擴增,擴增子(II)為生物素和地高辛同時標記的MCDA擴增。
LFB的檢測原理:將MCDA產物滴加到LFB的樣品墊區域,然后將LFB的底部1~1.5cm置于緩沖液中,MCDA產物在虹吸作用下,從下往上運動(從樣品墊向吸水墊方向運動)。當MCDA產物達到金標墊后,雙標產物的一端(即生物素標記端)與SA-G反應。當產物繼續運動,雙標產物的另一端(即半抗原標記端)與TL1或TL2區域的抗體結合,將雙標產物固定在TL1或TL2區域。隨著產物在TL1或TL2區域的積累,通過另一端的SA-G進行顯色反應,從而對MCDA產物進行可視化檢測。此外,過剩的SA-G可與CL區域的B-BSA反應,進行直接顯色反應,判斷LFB的功能是否正常。
LFB結果的判讀:僅僅CL區域出現紅色條帶,表示陰性對照,沒有陽性產物;CL及TL1區域出現紅色條帶,表示針對靶標一的檢測為陽性結果;CL及TL2區域出現紅色條帶,表示針對靶標二的檢測為陽性結果;CL、TL1和TL2區域均出現紅色條帶,表示針對靶標一和二的檢測都為陽性結果;當LFB不出現紅色條帶時,表示LFB失效;當TL1和/或TL2出現紅色條帶時,CL無紅色條帶,代表結果不可信,需要重新檢測。
3.MCDA擴增后的檢測
MCDA擴增之后,三種檢測方法被用于MCDA擴增判別。首先,在反應混合物中加入可視染料(如FD試劑,朗普熒光可視試劑),陽性反應管的顏色從淺灰色變為綠色,陰性反應管則保持原來的淺灰色。其次,MCDA產物可以通過瓊脂糖電泳后檢測擴增子,由于產物中包含了不同大小的擴增片段,因此陽性擴增產物的電泳圖呈特異性階梯狀,陰性反應不出現任何條帶。更為直接簡單的方法為通過LFB對產物進行檢測。
二、本發明實施例涉及的材料方法
1.本發明中所涉及的試劑:
抗熒光素抗體(anti-FITC)、抗地高辛抗體(anti-Dig)、金納米粒子偶聯的鏈霉素親和素(SA-G)及生物素偶聯的牛血清蛋白(B-BSA)購于Resenbio公司。背板、樣品墊、金標墊、纖維膜及吸水墊購于Jie-Yi公司。Loopamp Kit(Eiken Chemical Co.Ltd.,Tokyo,Japan)購于日本榮研公司。DNA提取試劑盒(QIAamp DNA minikits;Qiagen,Hilden,Germany)購于德國Qiagen公司。PCR反應體系混合物MIX(Taq DNA聚合酶,dNTP和緩沖液)購于北京康為世紀生物科技有限公司。DL50 DNA Marker購于寶生物工程(大連)有限公司。其余試劑均為市售分析純產品。
2.本發明實驗中使用的主要儀器
恒溫實時濁度儀LA-320C(Eiken Chemical Co.,Ltd,Japan)購于日本榮研公司。PCR儀為Sensoquest Labcycler,德國Sensoquest公司產品;電泳設備為北京君意東方電泳設備有限公司產品;凝膠成像系統為Bio-Rad Gel Dox XR,美國Bio-Rad公司產品。
3.基因組提取:志賀菌、沙門菌及其他細菌的基因組DNA的提取使用Qiagen公司的DNA提取試劑盒(QIAamp DNA minikits;Qiagen,Hilden,Germany),按照說明書進行操作。利用紫外分光光度計測定基因組DNA的濃度和純度,志賀菌及沙門菌的DNA用GE緩沖液連續稀釋(從10ng、10pg、10fg、1fg到0.1fg/微升)。各種基因組DNA均少量分裝,-20℃保存備用。
連續稀釋的志賀菌及沙門菌DNA用于MCDA及多重MCDA擴增步驟的最佳溫度的探索及多重擴增體系的建立。以常見的致病菌及條件致病菌DNA為模板評價MCDA-LFB技術的特異性。菌株信息見表3。
4.引物設計
為了驗證、評價MCDA-LFB技術,以及建立針對志賀菌和沙門菌病原體的快速、敏感和特異的MCDA-LFB檢測體系,本發明針對志賀菌的特異基因ipaH和沙門菌的特異基因invA分別設計兩套MCDA擴增引物,旨在驗證MCDA-LFB技術的可行性、敏感性、特異性及可靠性。
invA存在于沙門菌所有血清型中,其特異性好,可以將沙門菌與其他密切相近的菌種區分開。ipaH存在于所有的志賀菌中,其特異性好,可以將志賀菌與其他密切相近的菌種區分開。利用引物設計軟件PrimerExplorer V4(Eiken Chemical)(http://primerexplorer.jp/e/)和引物設計軟件Primer Premier 5.0設計MCDA引物,并將獲得的特異性引物在NCBI數據庫(http://blast.ncbi.nlm.nih.gov/Blast.cgi)中進行序列比對分析,以排除引物與其他物種序列可能存在的非特異性匹配,最終獲得優化后的兩套完整MCDA擴增引物,一套引物針對沙門菌檢測,另一套引物針對志賀菌檢測。引物設計的位置和方向見圖1(圖1A為沙門菌,圖1B為志賀菌),序列及修飾見表1。
表1引物序列及修飾
a Sal,沙門菌;Shi,志賀菌;Sal-C1*,該引物用于MCDA-LFB檢測體系,在5’端標記生物素;Sal-D1*,該引物用于MCDA-LFB檢測體系,在5’端標記熒光素;Shi-C2*,該引物用于MCDA-LFB檢測體系,在5’端標記生物素;Shi-D2*,該引物用于MCDA-LFB檢測體系,在5’端標記地高辛;
b FITC,熒光素;Dig,地高辛;
c mer,monomeric unit(單體單元);nt,nucleotide(核苷酸)。
實施例1標準MCDA-LFB檢測
1.標準的MCDA反應體系
交叉引物CP1和CP2的濃度為60pmol,置換引物F1和F2的濃度為10pmol,擴增引物R1、R2、D1(D1*)和D2(D2*)的濃度為30pmol,擴增引物C1(C1*)和C2(C2*)的濃度為20pmol,10mM的Betain,6mM的MgSO4,1mM的dNTP,12.5μL的10×Bst DNA聚合酶緩沖液,10U的鏈置換DNA聚合酶,1μL的模板,補加去離子水至25μL。整個反應恒溫在65℃1小時,80℃5min終止反應。
2.結果檢測
(1)可視顏色變化法:MCDA在合成DNA的同時產生大量的焦磷酸根離子,該離子能夠奪取與鈣黃綠素結合的錳離子,使鈣黃綠素恢復游離狀態而發熒光。該發光混合物能夠與反應中產生的鎂離子結合,使熒光得到增強。可以通過熒光目視檢測顏色變化判讀結果,陽性反應管從淺灰色變為綠色,陰性反應保持淺灰色不變,參見圖3A和圖3B。圖3A表示針對沙門菌的MCDA引物的驗證,圖3A1表示陽性擴增(反應管中加入10pg的沙門菌模板,作為陽性對照),A2表示陰性擴增(反應管中加入10pg的志賀菌模板,測定是否存在交叉反應),A3表示陰性擴增(反應管中加入10pg的Gram-大腸桿菌模板,作為陰性對照),A4表示陰性擴增(反應管中加入10pg的Gram+李斯特菌模板,作為陰性對照),A5表示陰性擴增(1微升雙蒸水代替10pg的模板,作為空白對照)。只有陽性對照出現陽性擴增,說明針對invA設計的檢測沙門菌的MCDA引物可用。圖3B表示針對志賀菌的MCDA引物的驗證,圖3B1表示陽性擴增(反應管中加入10pg的志賀菌模板,作為陽性對照),B2表示陰性擴增(反應管中加入10pg的沙門菌模板,測定是否存在交叉反應),B3表示陰性擴增(反應管中加入10pg的Gram-大腸桿菌模板,作為陰性對照),B4表示陰性擴增(反應管中加入10pg的Gram+李斯特菌模板,作為陰性對照),B5表示陰性擴增(1微升雙蒸水代替10pg的模板,作為空白對照)。只有陽性對照出現陽性擴增,說明針對ipaH設計的檢測志賀菌的MCDA引物可用。
(2)電泳檢測法:將圖3A和圖3B的產物進行電泳檢測,由于MCDA的擴增產物包含了許多大小不一的短片段及一系列反向重復的靶序列構成的莖環結構和多環花椰菜樣結構的DNA片段混合物,電泳后在凝膠上顯現不同大小區帶組成的階梯式圖譜,見圖3C和圖3D。通過電泳檢測法判讀MCDA擴增結果,陽性反應出現了預期的結果,而陰性反應和空白對照未出現任何擴增條帶,進一步驗證了本研究所設計的MCDA引物可行,可用于靶序列擴增檢測。
(3)LFB檢測:將圖3A和圖3B的產物進行LFB檢測,由于針對沙門菌檢測的MCDA引物標記的半抗原為FITC,因此,當TL1和CL出現紅色條帶時表示為沙門菌檢測陽性。由于針對志賀菌檢測的MCDA引物標記的半抗原為Dig,因此,當TL2和CL出現紅色條帶時表示為志賀菌檢測陽性。通過LFB檢測法判讀MCDA擴增結果,陽性反應出現了預期的結果,而陰性反應和空白對照僅出現CL紅色條帶,驗證了本研究所設計的MCDA-LFB技術及MCDA引物可行,能夠用于目的靶序列的檢測(圖3E和圖3F)。
3.測定MCDA技術的最佳反應溫度
在標準反應體系條件下,加入針對沙門菌及志賀菌DNA模板及所設計的對應MCDA引物,其模板濃度為10pg/μl。反應在恒溫條件下進行(60-67℃),結果運用實時濁度儀進行檢測,在不同的溫度下得到不同的動態曲線圖,見圖4和圖5。64-66℃被推薦作為兩套MCDA引物的最佳反應溫度。本發明中的后續驗證選擇65℃作為恒溫條件進行MCDA擴增。圖4A表示針對invA設計的檢測沙門菌的MCDA引物溫度動態曲線圖;圖4B表示針對ipaH設計的檢測志賀菌的MCDA引物溫度動態曲線圖。
4.MCDA-LFB檢測單一靶標的靈敏度
運用連續稀釋好的沙門菌基因組DNA進行標準的MCDA擴增反應后,運用LFB檢測顯示:MCDA-LFB的檢測范圍為10ng~10fg,LFB在TL1和CL區域出現紅色線(圖5A1-A3)。當反應體系中基因組模板量降低至10fg以下時,LFB僅在CL區域出現紅色線,表示陰性結果(圖5A4-A5)。圖5A運用LFB可視化讀取MCDA擴增結果;圖5A1到A5表示沙門菌的模板量為10ng、10pg、10fg、1fg和0.1fg,圖5A6、A7、A8、A9分別表示志賀菌模板(10pg)、大腸桿菌模板(10pg)、李斯特菌模板(10pg)、空白對照(1微升雙蒸水)。
運用連續稀釋好的志賀菌基因組DNA進行標準的MCDA擴增反應后,運用LFB檢測顯示:MCDA-LFB的檢測范圍為10ng~10fg,LFB在TL2和CL區域出現紅色線(圖5B1-B3)。當反應體系中基因組模板量降低至10fg以下時,LFB僅在CL區域出現紅色線,表示陰性結果(圖5B4-B5)。圖5B運用LFB可視化讀取MCDA擴增結果;圖5B1到B5表示志賀菌的模板量為10ng、10pg、10fg、1fg和0.1fg,圖5B6、B7、B8、B9分別表示沙門菌模板(10pg)、大腸桿菌模板(10pg)、李斯特菌模板(10pg)、空白對照(1微升雙蒸水)。
電泳檢測法確認結果:將圖5A和圖5B的產物進行電泳檢測,由于MCDA的擴增產物包含了許多大小不一的短片段及一系列反向重復的靶序列構成的莖環結構和多環花椰菜樣結構的DNA片段混合物,電泳后在凝膠上顯現不同大小區帶組成的階梯式圖譜,見圖5C和圖5D。通過電泳檢測法判讀MCDA擴增結果,陽性反應出現了預期的結果,而陰性反應和空白對照未出現任何擴增條帶,進一步驗證了MCDA-LFB的檢測靈敏度。
實施例2多重ET-MCDA反應體系:
ET-MCDA,即內切酶介導的實時多交叉置換核酸擴增技術,詳見CN105755134A,本發明通過引用該專利文件,將其作為本發明公開內容的一部分。
交叉引物Sal-CP1和Sal-E-CP1的濃度為30pmol,Sal-CP2的濃度為60pmol,置換引物Sal-F1和Sal-F2的濃度為10pmol,擴增引物Sal-R1,Sal-R2,Sal-D1和Sal-D2的濃度為30pmol,擴增引物Sal-C1和Sal-C2的濃度為20pmol,交叉引物Shi-CP1和Shi-E-CP1的濃度為8pmol,Shi-CP2的濃度為16pmol,置換引物Shi-F1和Shi-F2的濃度為10pmol,擴增引物Shi-R1、Shi-R2、Shi-D1和Shi-D2的濃度為8pmol,擴增引物Shi-C1和Shi-C2的濃度為10pmol,10mM的Betain,6mM的MgSO4,1mM的dNTP,12.5μL的10×Bst DNA聚合酶緩沖液,10U的鏈置換DNA聚合酶,15U Nb.BsrDI的內切酶,沙門菌及志賀菌各1μL的模板,補加去離子水至25μL。整個反應恒溫在65℃1小時,80℃5min終止反應。
為了實現MCDA-LFB技術同時檢測多個靶標,內切酶介導的實時多重MCDA技術(ET-MCDA)被用于調節多重MCDA的反應體系。在上述描述的多重ET-MCDA擴增條件下,沙門菌和志賀菌在同一反應中能夠被同時檢測(圖6)。圖6A和圖6B實時擴增曲線被同時產生,來自不同的熒光通道。此外多重ET-MCDA針對沙門菌和志賀菌的檢測下限也為10fg。
實施例3多重MCDA反應體系:
1.多重MCDA反應體系
交叉引物Sal-CP1和Sal-CP2的濃度為60pmol,置換引物Sal-F1和Sal-F2的濃度為10pmol,擴增引物Sal-R1、Sal-R2、Sal-D1*和Sal-D2的濃度為30pmol,擴增引物Sal-C1*和Sal-C2的濃度為20pmol,交叉引物Shi-CP1和Shi-CP2的濃度為16pmol,置換引物Shi-F1和Shi-F2的濃度為10pmol,擴增引物Shi-R1,Shi-R2,Shi-D1和Shi-D2*的濃度為8pmol,擴增引物Shi-C1和Shi-C2*的濃度為10pmol,10mM的Betain,6mM的MgSO4,1mM的dNTP,12.5μL的10×Bst DNA聚合酶緩沖液,10U的鏈置換DNA聚合酶,沙門菌及志賀菌各1μL的模板,補加去離子水至25μL。整個反應恒溫在65℃1小時,80℃5min終止反應。
2.MCDA-LFB同時檢測多個靶標的靈敏度
為了實現MCDA-LFB能夠同時檢測多個靶標,首先要保證MCDA-LFB技術在擴增步驟能實現在一個反應體系中同時擴增多個目的序列。多重MCDA擴增體系與多重ET-MCDA體系相似,僅僅用相同量的Sal-CP1和Shi-CP1代替Sal-E-CP1和Shi-E-CP1,這樣保證在同一反應體系中,多重MCDA體系能夠同時擴增多個目的序列。
運用連續稀釋好的沙門菌和志賀菌基因組DNA進行多重MCDA擴增反應后,運用LFB檢測顯示:MCDA-LFB技術在檢測多個靶標時,檢測范圍仍然為10ng~10fg,LFB在TL1、TL2和CL區域出現紅色線(LFB1-LFB3)。當反應體系中基因組模板量降低至10fg以下時,LFB僅在CL區域出現紅色線,表示陰性結果(LFB4-LFB5)。圖7運用LFB可視化讀取多重MCDA擴增結果;LFB1到LFB5表示沙門菌和志賀菌的模板量為10ng、10pg、10fg、1fg和0.1fg,LFB6、LFB7、LFB8分別表示大腸桿菌模板(10pg)、李斯特菌模板(10pg)、空白對照(1微升雙蒸水)。表2是本發明與其它幾種檢測方法的敏感性比較。
表2sMCDA-LFB、mMCDA-LFB和ET-MCDA針對invA和ipaH基因檢測的敏感性比較
1sMCDA-LFB,singlex MCDA-LFB assay(單重MCDA-LFB檢測);mMCDA-LFB,multiplex MCDA-LFB assay(多重MCDA-LFB檢測);ET-MCDA,endonuclease restriction-mediated real-time multiple cross displacement amplification(限制性內切酶介導的實時多交叉置換擴增);LFB,lateral flow biosensors(納米生物傳感檢測技術);MCDA,multiple cross displacement amplification(多交叉置換擴增)。
3.測定MCDA-LFB技術的最佳反應時間
在多重反應體系條件下,同時加入針對沙門菌及志賀菌所設計的對應的兩套MCDA引物,運用連續稀釋好的沙門菌和志賀菌基因組DNA作為模板。反應在恒溫條件下進行(65℃),恒溫時間分別10分鐘、20分鐘、30分鐘、40分鐘、50分鐘和60分鐘。運用LFB檢測顯示:MCDA-LFB技術在檢測多個靶標時,最佳反應時間為40分鐘(圖8)。當多重MCDA體系在擴增步驟恒溫40分鐘時,檢測限水平的模板能夠被檢出(圖8D)。圖8D中,LFB檢測范圍為10ng~10fg,LFB在TL1、TL2和CL區域出現紅色線(LFB1-LFB3)。當反應體系中基因組模板量降低至10fg以下時,LFB僅在CL區域出現紅色線,表示陰性結果(LFB4-LFB5)。圖8運用LFB可視化讀取多重MCDA體系從10分鐘到60分鐘的擴增結果;LFB1到LFB5表示沙門菌和志賀菌的模板量為10ng、10pg、10fg、1fg和0.1fg,LFB6、LFB7、LFB8分別表示大腸桿菌模板(10pg)、李斯特菌模板(10pg)、空白對照(1微升雙蒸水)。
實施例3.MCDA-LFB技術的特異性
以常見的致病菌及條件致病菌DNA(沙門菌、志賀菌、單增李斯特菌、霍亂弧菌、副溶血性弧菌、創傷弧菌、糞腸球菌、金黃色葡萄球菌、空腸彎曲菌、蠟樣芽胞桿菌、腸致病性大腸桿菌、腸產毒性大腸桿菌、腸侵襲性大腸桿菌等)為模板評價MCDA-LFB技術的特異性(菌株信息詳見表3)。MCDA-LFB技術能準確的鑒別沙門菌和志賀菌,說明MCDA-LFB方法的特異性良好,見圖9。LFB1:陽性對照(10pg沙門菌和志賀菌模板各10pg);LFB2-16,沙門菌模板;LFB17-37,志賀菌模板;LFB38-56,非沙門菌、非志賀菌模板;LFB57,空白對照。結果表明,MCDA-LFB能夠正確的檢測靶序列,通過TL1和TL2可視線將不同靶序列鑒別開。
表3.菌株信息
a U,unidentified serotype(未鑒別的血清型);ATCC,American Type Culture Collection(美國模式培養物保藏中心);ICDC,National Institute for Communicable Disease Control and Prevention,Chinese Center for Disease Control and Prevention(中國疾病預防控制中心傳染病預防控制所)。
- 還沒有人留言評論。精彩留言會獲得點贊!