一種提高釀酒酵母異戊二烯合成能力的方法與流程
本發明涉及一種提高釀酒酵母中異戊二烯合成能力的方法,屬于生物工程領域。
背景技術:
異戊二烯是合成橡膠的重要單體,其年消耗量超過100萬噸。自然界有許多植物能釋放異戊二烯。異戊二烯以氣體形式釋放到大氣中,不易收集,從而難以用于工業生產。目前異戊二烯的主要來源是C5餾分。由于石油資源不可再生和石油化工帶來的環境污染問題日趨嚴重,以微生物作為細胞工廠合成異戊二烯已經變成一個重要的研究課題。大多數微生物都具有2-甲基赤蘚醇磷酸(MEP)或甲羥戊酸(MVA)途徑,可以合成異戊二烯的前體物質二甲基烯丙基焦磷酸(DMAPP)。將植物來源的異戊二烯合成基因IspS轉入這些微生物中,就可以使其具備合成異戊二烯的能力。目前對生物合成異戊二烯主的研究要集中在對上游MEP和MVA途徑的調控,而對于下游異戊二烯合成途徑的研究鮮有報道。異戊二烯合成酶作為催化異戊二烯合成的酶,其在微生物體內的表達量和催化活性都比較低。下游異戊二烯合成途徑強度太弱已經成為限制異戊二烯合成能力提高的瓶頸問題。
技術實現要素:
本發明主要目的是增強釀酒酵母合成異戊二烯的能力。
一種提高釀酒酵母合成異戊二烯能力的方法,通過酶切連接將來源于銀白楊的IspS基因序列SEQ ID NO:1克隆到質粒上,轉化到釀酒酵母體內,以實現在釀酒酵母中合成異戊二烯;并通過GAL4過表達增強IspS轉錄水平,以實現提高釀酒酵母合成異戊二烯能力。
進一步,所述IspS由SEQ ID NO.1中的基因編碼,并且所述IspS氨基酸序列是序列表中SEQ ID NO.2的氨基酸序列。
進一步,所述質粒為p416xwp01質粒,在釀酒酵母中以附著型低拷貝質粒存在,篩選標記為URA3。
進一步,通過DNA同源重組,將含有GAL4表達盒的線性化質粒整合到釀酒酵母基因組上GAL1/7/10區域,敲除GAL1/7/10基因,同時增強GAL4的表達,以實現增強IspS轉錄水平。
進一步,所述含有GAL4表達盒的線性化質粒為含有KanMX篩選標記、GAL1/7/10同源臂序列、多克隆位點和GAL4表達盒。
進一步,所述GAL4表達盒序列如SEQ ID NO.17所示。
進一步,所述IspS基因序列為下列突變基因序列中的一個:
a.序列表中SEQ ID NO.3的核苷酸序列;
b.序列表中SEQ ID NO.5的核苷酸序列;
c.序列表中SEQ ID NO.7的核苷酸序列;
d.序列表中SEQ ID NO.9的核苷酸序列;
e.序列表中SEQ ID NO.11的核苷酸序列;
f.序列表中SEQ ID NO.13的核苷酸序列;
g.序列表中SEQ ID NO.15的核苷酸序列。
IspS由上述突變基因編碼,并且,所述IspS氨基酸序列是下列氨基酸序列之一:
(1)序列表中SEQ ID NO.4的氨基酸序列;
(2)序列表中SEQ ID NO.6的氨基酸序列;
(3)序列表中SEQ ID NO.8的氨基酸序列;
(4)序列表中SEQ ID NO.10的氨基酸序列;
(5)序列表中SEQ ID NO.12的氨基酸序列;
(6)序列表中SEQ ID NO.14的氨基酸序列;
(7)序列表中SEQ ID NO.16的氨基酸序列。
其中,序列表中SEQ ID NO.4的氨基酸序列編碼的異戊二烯合成酶命名為IspSM1,相對于野生型其第340位苯丙氨酸突變為亮氨酸;序列表中SEQ ID NO.6的氨基酸序列編碼的異戊二烯合成酶命名為IspSM2,相對于野生型其第478位異亮氨酸突變為纈氨酸;序列表中SEQ ID NO.8的氨基酸序列編碼的異戊二烯合成酶命名為IspSM3(IspSMA),相對于野生型其第570位丙氨酸突變為蘇氨酸;序列表中SEQ ID NO.10的氨基酸序列編碼的異戊二烯合成酶命名為IspSM4,相對于野生型其第340位苯丙氨酸突變為亮氨酸,第570位丙氨酸突變為蘇氨酸;序列表中SEQ ID NO.12的氨基酸序列編碼的異戊二烯合成酶命名為IspSM5,相對于野生型其第478位異亮氨酸突變為纈氨酸,第570位丙氨酸突變為蘇氨酸;序列表中SEQID NO.14的氨基酸序列編碼的異戊二烯合成酶命名為IspSM6,相對于野生型其第340位苯丙氨酸突變為亮氨酸,第478位異亮氨酸突變為纈氨酸,第570位丙氨酸突變為蘇氨酸;序列表中SEQ ID NO.16的氨基酸序列編碼的異戊二烯合成酶命名為IspSMB,相對于野生型其第340位苯丙氨酸突變為亮氨酸,第478位異亮氨酸突變為纈氨酸。
本發明所采用的技術方案,利用GAL4表達盒敲除釀酒酵母基因組中的GAL1/7/10,增強IspS表達水平。然后利用定向進化的方法提高IspS催化活性。
其中上述增強釀酒酵母合成異戊二烯能力的技術方案中,所述GAL4表達盒序列如SEQ IDNO.17所示。
上述增強釀酒酵母合成異戊二烯能力的技術方案中,GAL4表達盒在基因組上的整合,其特征在于:將GAL4表達盒以酶切連接的方式克隆到整合型質粒pLGL-△GAL1/7/10上,構建質粒pLGL-△GAL1/7/10-GAL4;將pLGL-△GAL1/7/10-GAL4線性化,通過電轉化整合到釀酒酵母基因組上,涂布G418平板,篩選陽性克隆菌株。
上述增強釀酒酵母合成異戊二烯能力的技術方案中,對釀酒酵母使用的宿主菌過度積累中間代謝產物DMAPP進行定向進化。
與現有技術相比,本發明具有如下優點:
本發明以釀酒酵母為宿主,通過將銀白楊的IspS基因轉化至釀酒酵母中,然后過表達轉錄因子GAL4,增強IspS的轉錄水平;并建立以DMAPP細胞毒性為基礎的高通量篩選方法對異戊二烯合成酶進行定向進化,獲得高活性的異戊二烯合成酶突變體。結合轉錄因子調控和異戊二烯合成酶定向進化,強化下游異戊二烯合成途徑,提高了釀酒酵母的異戊二烯合成能力。
本發明利用同源重組技術,將GAL4表達框整合到酵母基因組中GAL1/7/10區段,增強IspS轉錄水平。此外,利用定向進化提高IspS催化活性。二者結合起來,增強了異戊二烯合成途徑的強度,提高了釀酒酵母的異戊二烯合成能力。
本發明所構建的GAL4過表達菌株,在發酵過程中IspS轉錄水平是出發菌株的3-7倍。
本發明通過篩選獲得的突變體IspSMA和IspSMB,催化活性相比野生型有明顯的提高。
本發明通過單點組合獲得的突變體IspSM1、IspSM2、IspSM3、IspSM4IspSM5和IspSM6,IspSM4是最優突變體,催化活性比其他突變體及野生型高。
附圖說明
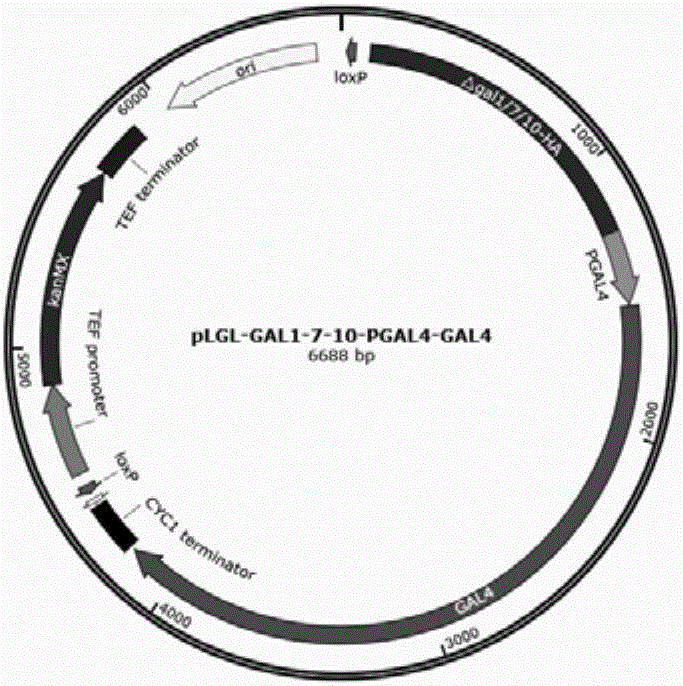
圖1為pLGL-△GAL1/7/10-GAL4質粒圖譜。
圖2為p416xwp01質粒圖譜。
圖3為結合GAL4過表達和定向進化對異戊二烯產量的影響。C代表出發菌株,作為對照組;E1代表GAL4過表達菌株;E2代表在E1基礎上轉入最優突變體IspSM4。
具體實施方式
本發明所用質粒pLGL-△GAL1/7/10-GAL4圖譜如圖1所示。
本發明所用質粒p416xwp01圖譜如圖2所示。
本發明培養基如下:
(1)YPD培養基(1%酵母粉,2%蛋白胨,2%葡糖糖),固體培養基加入2%瓊脂粉,115℃滅菌,用于釀酒酵母活化和預培養。
(2)YPD(G418)培養基(1%酵母粉,2%蛋白胨,2%葡糖糖,200μg/mL G418),固體培養基加入2%瓊脂粉,115℃滅菌,用于篩選KanMX標記。
(3)LB培養基(1%氯化鈉,1%胰蛋白胨,0.5%酵母粉),固體培養基加入2%瓊脂粉,121℃滅菌,用于大腸桿菌活化和預培養。
(4)LB(Amp/Kan)培養基(1%氯化鈉,1%胰蛋白胨,0.5%酵母粉,100μg/mL氨芐青霉素或50μg/mL卡那霉素),固體培養基加入2%瓊脂粉,121℃滅菌,用于含有質粒的大腸桿菌培養。
實施例1:異戊二烯合成途徑在釀酒酵母中的構建
用密碼子優化軟件將來源于銀白楊的異戊二烯合成酶基因進行優化,并人工合成優化后的序列。用引物IspS-F(26)和IspS-R(27)將優化后的IspS克隆到p416xwp01質粒上,轉入釀酒酵母中,以實現異戊二烯的合成。
實施例2:一種構建GAL4過表達菌株的方法。
用于構建GAL4過表達菌株的質粒PLGL-△GAL1/7/10-PGAL4-GAL4,其步驟如下:
以質粒PUG6為模板,用引物loxp-F1(30)和loxp-R1(31)擴增獲得loxp-KanMX-loxp片段。以質粒pESC-URA質粒為模板,用引物loxp-F2(32)和loxp-R2(33)擴增獲得ori片段,用引物TADH1-F2(34)和TCYC1-R2(35)擴增獲得TADH1-MCS1-PGAL10-PGAL1-MCS2-TCYC1區段。將三個片段融合構建質粒PMRI-28。
以釀酒酵母BY4741基因組為模板,用引物△GAL1/7/10-UP-F1(22)和△GAL1/7/10-UP-R1(23)擴增獲得GAL1/7/10區段的上游534bp,用引物△GAL1/7/10-DN-F1(24)和△GAL1/7/10-DN-R1(25)擴增獲得下游671bp。兩個片段有同源序列,利用重疊延伸PCR將兩個片段融合獲得用于敲除GAL1/7/10區段的同源臂△GAL1/7/10(1151bp)。
將△GAL1/7/10片段和克隆到質粒PMRI-28上,構建質粒PLGL-△GAL1/7/10。
以釀酒酵母BY4741基因組為模板,用引物PGAL4-F1(18)和PGAL4-R1(19)擴增獲得GAL4的啟動子片段,用引物GAL4-F1(20)和GAL4-R1(21)擴增獲得GAL4基因片段。
將PGAL4-GAL4片段克隆到質粒PLGL-△GAL1/7/10的PGAL10-PGAL1-MCS2區段,構建質粒PLGL-△GAL1/7/10-PGAL4-GAL4。
GAL4過表達菌株的構建,具體步驟如下:
(1)用EcoRI單酶切質粒PLGL-△GAL1/7/10-PGAL4-GAL4,使其線性化。
(2)制備釀酒酵母感受態。
(3)電擊轉化,將線性化質粒整合到釀酒酵母基因組上,涂布G418平板。
(4)從平板上挑選出單菌落,在搖瓶中過夜培養,提取基因組,PCR驗證GAL4表達盒是否整合到基因組上的GAL1/7/10區段。
(5)根據PCR驗證結果,篩選出陽性克隆。
實施例3:IspS轉錄水平測定。
將出發菌株(C)和GAL4過表達菌株(E1)培養在在液體SS-URA培養基中。在搖瓶發酵過程中第18小時、24小時、48小時和72小時分別取2mL發酵液。
用RNA提取試劑盒(Takara)提取各個樣品的總RNA。使用反轉錄試劑盒(Takara)去除基因組DNA并反轉錄獲得cDNA。實驗操作按試劑盒說明書進行。
以ACT1基因為內參,對IspS做實時熒光定量PCR,獲得擴增曲線,記錄CT值。用2-△△CT計算IspS的相對轉錄水平。
表1 IspS的相對轉錄水平
實施例4:異戊二烯產量的檢測。
將出發菌株和GAL4過表達菌株培養在密封的裝有液體SS-URA培養基的搖瓶中,培養24h。
采用頂空進樣法,用GC-FID檢測異戊二烯產量。柱溫箱、進樣口和檢測器溫度分別為80℃、180℃和180℃。結果如圖3所示
實施例5:IspS陽性突變體的獲得。
以p416xwp01-IspS為模板,GAL1-F(28)和qtHMG1-R1(29)為前后引物,對IspS做易錯PCR反應,構建IspS突變體文庫。體系中Mn2+濃度為0.1mM,用于增加突變率。
酶切p416xwp01-IspS,獲得切除野生型IspS片段的質粒。
制備釀酒酵母感受態細胞,將IspS突變體文庫和酶切質粒轉入釀酒酵母體內。涂布SS平板。
從平板上挑取10個長得較快的單菌落。
將野生型菌株和10個突變菌株在液體SS培養基培養,24h后測量OD600,篩選出4個生長比野生型菌株快的突變菌株。
提取這4個突變菌株的質粒,并轉入大腸桿菌擴增。
將質粒重新轉入原宿主菌,搖瓶培養,檢測異戊二烯產量。
分析結果發現兩個突變菌株比野生型菌株產量高,分別命名為IspSMA和IspSMB。
對兩個突變質粒IspSMA和IspSMB進行測序反應。構建單點和組合突變體,突變體如表2所示。
檢測突變體異戊二烯產量,比較相對酶活(相對酶活=突變菌株產量/野生菌株產量1),篩選出最優突變體IspSM4,其相對酶活為2.5。
表2 單點組合突變體
實施例6:結合GAL4過表達和定向進化提高異戊二烯產量
將質粒p416xwp01-IspSM4轉入到GAL4過表達菌株中,構建重組菌(E2)。
兩個重組菌在密封的搖瓶中培養24h,檢測異戊二烯產量。結果如圖3所示。
- 還沒有人留言評論。精彩留言會獲得點贊!