蛋白質GmGATA44在調控植物粒重中的應用的制作方法
本發明涉及生物
技術領域:
,具體涉及蛋白質GmGATA44在調控植物粒重中的應用。
背景技術:
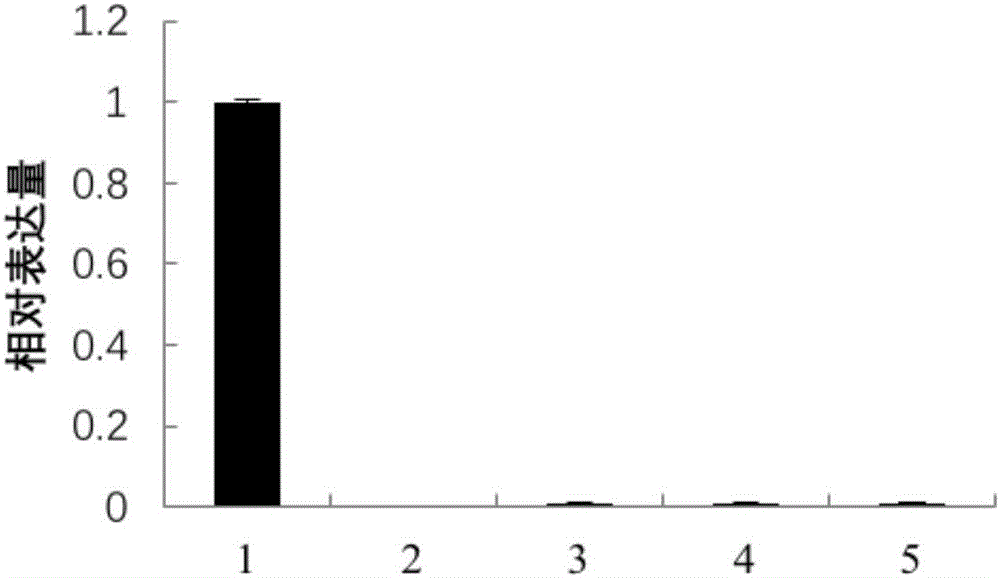
:大豆(Glycinemax(L.)Merr.)是優質的植物蛋白資源,也是健康的食用植物油源。目前,我國大豆平均畝產120公斤,而美國平均畝產214公斤,巴西平均畝產191公斤,阿根廷平均畝產185公斤。我國居民對高蛋白食品需求日益增加,國產大豆是食用大豆的主體。為了滿足居民對植物蛋白的需求,提高國內大豆產量勢在必行。提高大豆產量主要是通過提高單株粒數和百粒重來實現(劉玉庫等,2006),其中百粒重是影響大豆單產的重要農藝性狀。因此,挖掘調控植物百粒重的基因對大豆育種具有重要的意義。技術實現要素:本發明所要解決的技術問題是如何提高植物粒重。為解決上述技術問題,本發明首先提供了蛋白質GmGATA44在調控植物粒重中的應用;所述蛋白質GmGATA44可為a1)或a2)或a3):a1)氨基酸序列是序列表中序列2所示的蛋白質;a2)在序列表中序列2所示的蛋白質的N端或/和C端連接標簽得到的融合蛋白質;a3)將序列表中序列2所示的氨基酸序列經過一個或幾個氨基酸殘基的取代和/或缺失和/或添加得到的與植物粒重相關的蛋白質。其中,序列表中序列2由314個氨基酸殘基組成。為了使a1)中的蛋白質便于純化,可在序列表中序列2所示的蛋白質的氨基末端或羧基末端連接上如表1所示的標簽。表1標簽的序列標簽殘基序列Poly-Arg5-6(通常為5個)RRRRRFLAG8DYKDDDDKStrep-tagII8WSHPQFEKc-myc10EQKLISEEDL上述a3)中的蛋白質,所述一個或幾個氨基酸殘基的取代和/或缺失和/或添加為不超過10個氨基酸殘基的取代和/或缺失和/或添加。上述a3)中的蛋白質可人工合成,也可先合成其編碼基因,再進行生物表達得到。上述a3)中的蛋白質的編碼基因可通過將序列表中序列1所示的DNA序列中缺失一個或幾個氨基酸殘基的密碼子,和/或進行一個或幾個堿基對的錯義突變,和/或在其5′端和/或3′端連上表1所示的標簽的編碼序列得到。編碼所述蛋白質GmGATA44的核酸分子在調控植物粒重中的應用也屬于本發明的保護范圍。編碼所述蛋白質GmGATA44的核酸分子可為如下b1)或b2)或b3)或b4)所示的DNA分子:b1)編碼區如序列表中序列1所示的DNA分子;b2)核苷酸序列是序列表中序列1所示的DNA分子;b3)與b1)或(b2)限定的核苷酸序列具有75%或75%以上同一性,且編碼所述蛋白質GmGATA44的DNA分子;b4)在嚴格條件下與(b1)或(b2)限定的核苷酸序列雜交,且編碼所述蛋白質GmGATA44的DNA分子。其中,所述核酸分子可以是DNA,如cDNA、基因組DNA或重組DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。其中,序列表中序列1由945個核苷酸組成,序列表中序列1的核苷酸編碼序列表中序列2所示的氨基酸序列。本領域普通技術人員可以很容易地采用已知的方法,例如定向進化和點突變的方法,對本發明的編碼所述蛋白質GmGATA44的核苷酸序列進行突變。那些經過人工修飾的,具有與本發明分離得到的所述蛋白質GmGATA44的核苷酸序列75%或者更高同一性的核苷酸,只要編碼所述蛋白質GmGATA44,均是衍生于本發明的核苷酸序列并且等同于本發明的序列。這里使用的術語“同一性”指與天然核酸序列的序列相似性。“同一性”包括與本發明的編碼序列表的序列2所示的氨基酸序列組成的蛋白質GmGATA44的核苷酸序列具有75%或更高,或80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或計算機軟件進行評價。使用計算機軟件,兩個或多個序列之間的同一性可以用百分比(%)表示,其可以用來評價相關序列之間的同一性。上述應用中,所述調控植物粒重可為增加植物粒重。上述應用中,所述粒重可為百粒重。為解決上述技術問題,本發明還提供了一種培育轉基因植物的方法。本發明所提供的培育轉基因植物的方法,可包括向受體植物中導入編碼所述蛋白質GmGATA44的核酸分子,得到轉基因植物的步驟;所述轉基因植物與所述受體植物相比粒重增加。上述方法中,編碼所述蛋白質GmGATA44的核酸分子可為如下b1)或b2)或b3)或b4)所示的DNA分子:b1)編碼區如序列表中序列1所示的DNA分子;b2)核苷酸序列是序列表中序列1所示的DNA分子;b3)與b1)或(b2)限定的核苷酸序列具有75%或75%以上同一性,且編碼所述蛋白質GmGATA44的DNA分子;b4)在嚴格條件下與(b1)或(b2)限定的核苷酸序列雜交,且編碼所述蛋白質GmGATA44的DNA分子。其中,所述核酸分子可以是DNA,如cDNA、基因組DNA或重組DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。其中,序列表中序列1由945個核苷酸組成,序列表中序列1的核苷酸編碼序列表中序列2所示的氨基酸序列。為解決上述技術問題,本發明還提供了一種植物育種方法。本發明所提供的植物育種方法,可包括如下步驟:增加植物中所述蛋白質GmGATA44的含量或活性,從而增加植物的粒重。上述任一所述方法中,所述粒重可為百粒重。上述任一所述方法中,所述植物可為如下c1)至c6)中的任一種:c1)雙子葉植物;c2)單子葉植物;c3)豆科植物;c4)大豆;c5)大豆品種天隆一號;c6)大豆耐低氮品種坡黃。實驗證明,將編碼蛋白質GmGATA44的基因導入天隆一號,獲得的轉GmGATA44基因大豆。與天隆一號相比,轉GmGATA44基因大豆的T3代種子的百粒重顯著提高。因此,蛋白質GmGATA44在調控大豆粒重中具有重要的應用價值。附圖說明圖1為組織表達模式分析結果。圖2為亞細胞定位分析結果。圖3為轉GmGATA44基因大豆的檢測結果。圖4為百粒重的統計結果。具體實施方式下面結合具體實施方式對本發明進行進一步的詳細描述,給出的實施例僅為了闡明本發明,而不是為了限制本發明的范圍。下述實施例中的實驗方法,如無特殊說明,均為常規方法。下述實施例中所用的材料、試劑等,如無特殊說明,均可從商業途徑得到。大豆耐低氮品種坡黃記載于如下文獻中:郝青南,王程,陳水蓮等.大豆苗期氮高效和氮敏感資源的篩選研究.大豆科學,2011,30(6):910-920。大豆耐低氮品種坡黃在下文中簡稱坡黃。大豆品種天隆一號記載于如下文獻中:王瑞珍,楊中路,周新安等.高產優質春大豆天隆一號的引種與推廣應用.大豆科技,2015,5:6-10.,其母本為中豆32,父本為中豆29,為中國農業科學院油料作物研究所經有性雜交和系譜法選育而成。大豆品種天隆一號在下文中簡稱天隆一號。載體pMD18-T為TaKaRa公司的產品,產品目錄號為6011。SYBRPremixExTaqII試劑盒為TaKaRa公司的產品,產品目錄號RR820A。2×SYBRPremixExTaqII和50×ROXReferenceDyeII均為SYBRPremixExTaqII試劑盒中的組件。載體pBI221-GFP記載于如下文獻中:HuangWJ,SunW,LvHYetal.AR2R3-MYBtranscriptionfactorfromEpimediumsagittatumregulatestheflavonoidbiosyntheticpathway.PLoSOne,2013,8(8):e70778.doi:10.1371.入門載體pGWC記載于如下文獻中:ChenQJ,ZhouHM,ChenJetal.UsingamodifiedTAcloningmethodtocreatentryclones.AnalyicalBiochemistry,2006,358(1):120-125.載體pB2GW7記載于如下文獻中:KarimiM,InzéD,DepickerA.GATEWAYvectorsforAgrobacterium-mediatedplanttransformation.TrendsinPlantScience,2002,7(5):193-195.實施例1、GmGATA44基因的克隆1、提取坡黃葉片組織的總RNA,然后將該總RNA用逆轉錄酶反轉錄出第一鏈cDNA,即得到坡黃葉片組織的cDNA。2、以步驟1得到的坡黃葉片組織的cDNA為模板,以5’-GTGTTTTTATGTGTGTTCTCCCA-3’和5’-GTGAAGCGGTGGTAGCTCTAG-3’為引物進行PCR擴增,得到約1kb的PCR擴增產物。3、將步驟2得到的PCR擴增產物和載體pMD18-T連接,得到重組質粒pMD18-T-GmGATA44。對重組質粒pMD18-T-GmGATA44進行測序。測序結果表明,重組質粒pMD18-T-GmGATA44中含有序列表中序列1所示的DNA分子(以下命名為GmGATA44基因)。實施例2、組織表達模式分析1、提取處于成株期的坡黃材料(坡黃根、坡黃莖、坡黃幼嫩葉片、坡黃成熟花或坡黃幼嫩種子)的總RNA,將該總RNA用逆轉錄酶反轉錄出第一鏈cDNA,得到坡黃材料的cDNA。2、以步驟1得到的坡黃材料的cDNA為模板,使用SYBRPremixExTaqII試劑盒檢測坡黃材料中GmGATA44基因的相對表達量(以GmACT11基因作為內參基因)。檢測GmGATA44基因的引物為正向引物1:5’-GTCGCTTTGCAATGCCTGC-3’和反向引物1:5’-GCTTCCACAATAACTGCTCCATC-3’,目的片段如序列表中序列1自5’末端起第591位至第692位所示。檢測GmACT11基因的引物為正向引物2:5’-ATCTTGACTGAGCGTGGTTATTCC-3’和反向引物2:5’-GCTGGTCCTGGCTGTCTCC-3’。反應體系為20μL,由10μL2×SYBRPremixExTaqII、0.6μL濃度為10μM的正向引物、0.6μL濃度為10μM的反向引物、0.4μL50×ROXReferenceDyeII、2μL坡黃材料的cDNA和6.4μL無核酸酶水組成。熒光定量PCR檢測的反應程序為:95℃預變性15min;95℃變性10sec,60℃退火15sec,72℃延伸20sec,40個循環。以坡黃幼嫩葉片中GmGATA44基因的相對表達量作為1,其它坡黃材料中GmGATA44基因的相對表達量見圖1(1為坡黃幼嫩葉片,2為坡黃根,3為坡黃莖,4為坡黃成熟花,5為坡黃幼嫩種子)。結果表明,GmGATA44基因在坡黃幼嫩葉片中的相對表達量較高,在坡黃根、坡黃莖、坡黃成熟花和坡黃幼嫩種子中的相對表達量均極低。實施例3、亞細胞定位分析一、重組質粒pBI221-GmGATA44的構建1、以實施例1步驟3得到的重組質粒pMD18-T-GmGATA44為模板,以5’-CGGGATCCATGATTCCAGCCTATCGCCA-3’(下劃線為限制性內切酶BamHI的識別位點)和5’-GCGTCGACATGAACAAGGCCATAAGATAA-3’(下劃線為限制性內切酶SalI的識別位點)為引物進行PCR擴增,得到約960bp的PCR擴增產物。2、用限制性內切酶BamHI和SalI雙酶切步驟1得到的PCR擴增產物,回收約960bp的片段甲。3、用限制性內切酶BamHI和SalI雙酶切載體pBI221-GFP,回收約4.5kb的載體骨架甲。4、將片段甲和載體骨架甲連接,得到重組質粒pBI221-GmGATA44。根據測序結果,對重組質粒pBI221-GmGATA44進行結構描述如下:向載體pBI221-GFP的BamHI和SalI酶切位點之間插入核苷酸序列是序列表中的序列1自5’末端起第1位至第942位所示的DNA分子。二、亞細胞定位分析1、用鑷子剝取洋蔥內表皮,分割成小塊(1cm×1cm),然后置于MS固體培養基上。2、完成步驟1后,采用基因槍介導的遺傳轉化方法(ZhengLL,GaoZ,WangJ,etal.MolecularcloningandfunctionalcharacterizationofanovelCBL-interactingproteinkinaseNtCIPK2inthehalophyteNitrariatangutorum[J].GeneticsandMolecularResearch,2014,13(3):4716-4728.),將重組質粒pBI221-GmGATA44轉化洋蔥內表皮。3、完成步驟2后,取所述洋蔥內表皮,置于MS固體培養基上25℃暗培養24h;然后置于載玻片上,在激光共聚焦顯微鏡下觀察;待觀察到熒光后,在所述洋蔥內表皮上滴加0.5mol/L的NaCl水溶液(目的為進行質壁分離),然后繼續在激光共聚焦顯微鏡下觀察。按照上述方法,將重組質粒pBI221-GmGATA44替換為載體pBI221-GFP,其它步驟均不變,在共聚焦顯微鏡下觀察,作為對照。實驗結果見圖2(a和b為白光,c和d為紫外光,e和f為白光和紫外光的疊加,a、c和e為重組質粒pBI221-GmGATA44,b、d和f為載體pBI221-GFP):載體pBI221-GFP轉化洋蔥內表皮后,在細胞核、細胞質和細胞膜上均可觀察到綠色熒光;重組質粒pBI221-GmGATA44轉化洋蔥內表皮后,僅在細胞核上觀察到綠色熒光。因此,GmGATA44蛋白定位在細胞核。實施例4、轉GmGATA44基因大豆的獲得及其鑒定一、重組質粒pB2GW7-GmGATA44和重組農桿菌的構建1、重組質粒pB2GW7-GmGATA44的構建(1)以實施例1步驟3中的重組質粒pMD18-T-GmGATA44為模板,以5’-ATGATTCCAGCCTATCGCC-3’和5’-TCAATGAACAAGGCCATAAGATA-3’為引物,進行PCR擴增,得到約950bp的PCR擴增產物。(2)用限制性內切酶AhdI酶切入門載體pGWC,回收約2500bp的載體骨架1。(3)完成步驟(2)后,將步驟(1)得到的PCR擴增產物和載體骨架1連接,得到重組質粒pGWC-GmGATA44。(4)完成步驟(3)后,將重組質粒pGWC-GmGATA44和載體pB2GW7進行LR重組反應,得到重組質粒pB2GW7-GmGATA44。對重組質粒pB2GW7-GmGATA44進行測序。測序結果表明,重組質粒pB2GW7-GmGATA44中含有序列表中序列1所示的DNA分子,表達序列表中序列2所示的蛋白質(以下命名為GmGATA44蛋白或蛋白質GmGATA44)。2、重組農桿菌的構建將重組質粒pB2GW7-GmGATA44導入根癌農桿菌EHA105,得到重組農桿菌,命名為EHA105/pB2GW7-GmGATA44。將載體pB2GW7導入根癌農桿菌EHA105,得到重組農桿菌,命名為EHA105/pB2GW7。二、T0代擬轉GmGATA44基因大豆的獲得采用農桿菌介導的大豆子葉節遺傳轉化方法(PazM,MartinezJC,KalvigABetal.ImprovedcotyledonarynodemethodusinganalternativeexplantderivedfrommatureseedforefficientAgrobacterium-mediatedsoybeantransformation.PlantCellReports,2006,25(3):206-213),將EHA105/pB2GW7-GmGATA44轉化天隆一號(轉化過程中,用除草劑進行篩選),獲得T0代擬轉GmGATA44基因大豆。按照上述方法,將EHA105/pB2GW7-GmGATA44替換為EHA105/pB2GW7,其它步驟均不變,得到T0代轉空載體大豆,以下簡稱轉空載體大豆。三、擬轉GmGATA44基因大豆的檢測1、分子水平檢測隨機選取4個T0代擬轉GmGATA44基因大豆植株(分別命名為植株1、植株2、植株3和植株4)進行分子水平檢測。待測大豆為植株1、植株2、植株3、植株4、天隆一號或轉空載體大豆。以待測大豆葉片組織的基因組DNA為模板,以5’-CATTTGGAGAGGACTCCGG-3’和5’-CCTATAAGAACCCTAATTCC-3’為引物進行PCR擴增,得到PCR擴增產物,然后進行如下判斷:如果PCR擴增產物中含有大小為1.4kb的條帶,則待測大豆即為轉GmGATA44基因大豆;如果PCR擴增產物中不含有大小為1.4kb的條帶,則待測大豆即為非轉GmGATA44基因大豆。按照上述方法,將待測大豆葉片組織的基因組DNA替換為重組質粒pB2GW7-GmGATA44,其它步驟均不變,作為陽性對照。部分實驗結果見圖3中a(M為DNA分子Marker,1為植株1,2為植株2,3為植株3,4為植株4,5為天隆一號,6為重組質粒pB2GW7-GmGATA44)。結果表明,轉空載體大豆和天隆一號的PCR擴增產物中均不含有大小為1.4kb的條帶,植株1、植株2、植株3和植株4的PCR擴增產物中均含有大小為1.4kb的條帶。2、蛋白水平檢測完成步驟1后,采用Bar免疫檢測試劑盒對植株1、植株2、植株3和植株4進行蛋白水平檢測。Bar免疫檢測試劑盒為美國Envirologix公司的產品,產品目錄號為AS013LS。檢測試紙條、離心管、研磨棒和EB2抽屜緩沖液均為Bar免疫檢測試劑盒中的組件。(1)處理液的獲得待測大豆為植株1、植株2、植株3、植株4、天隆一號或轉空載體大豆。取待測大豆的葉片0.1g,置于離心管中,先用力旋轉研磨棒20-30s(目的為搗碎葉片),然后加入500μLEB2抽提緩沖液,用力旋轉研磨棒20-30s,得到處理液。(2)檢測將檢測試紙條恢復至室溫,然后垂直插入處理液(浸入深度約為0.5cm),10min后取出放平閱讀檢測結果。(3)結果判斷檢測線及對照線一般可在3-7min內出現,檢測標準為:在檢測試紙條上僅出現一條紫紅色條帶,即一條紫紅色質控線,為陰性結果;在檢測試紙條上出現兩條紫紅色條帶,一條為紫紅色檢測線,一條為紫紅色質控線,此為陽性結果。凡能得到兩條紫紅色條帶的待測大豆即為轉GmGATA44基因大豆;凡能得到一條紫紅色條帶的待測大豆即為非轉GmGATA44基因大豆。部分實驗結果見圖3中b(WT為天隆一號,1為植株1,2為植株2,3為植株3,4為植株4)。結果表明,轉空載體大豆和天隆一號在檢測試紙條上均僅出現一條紫紅色條帶,植株1、植株2、植株3和植株4在檢測試紙條上均出現兩條紫紅色條帶。上述結果表明,植株1、植株2、植株3和植株4均為轉GmGATA44基因大豆植株。每個轉GmGATA44基因大豆植株及其后代均為一個株系。將植株1及其后代的株系命名為GATA44OX-1,將植株2及其后代的株系命名為GATA44OX-2。將植株1經連續兩代自交,獲得T2代GATA44OX-1的純合株系。將植株2經連續兩代自交,獲得T2代GATA44OX-2的純合株系。將轉空載體大豆經連續兩代自交后,獲得T2代純合轉空載體大豆。四、轉GmGATA44基因大豆植株的實時定量PCR檢測待測大豆為GATA44OX-1的T2代純合植株、GATA44OX-2的T2代純合植株、天隆一號或T2代純合轉空載體大豆。1、提取處于幼苗期的待測大豆葉片組織的總RNA,將該總RNA用逆轉錄酶反轉錄出第一鏈cDNA,得到待測大豆的cDNA。2、以步驟1得到的待測大豆的cDNA為模板,使用SYBRPremixExTaqII試劑盒檢測待測大豆中GmGATA44基因的相對表達量(以GmACT11基因作為內參基因)。檢測GmGATA44基因的引物為正向引物1:5’-GTCGCTTTGCAATGCCTGC-3’和反向引物1:5’-GCTTCCACAATAACTGCTCCATC-3’,目的片段如序列表中序列1自5’末端起第591位至第692位所示。檢測GmACT11基因的引物為正向引物2:5’-ATCTTGACTGAGCGTGGTTATTCC-3’和反向引物2:5’-GCTGGTCCTGGCTGTCTCC-3’。反應體系為20μL,由10μL2×SYBRPremixExTaqII、0.6μL濃度為10μM的正向引物、0.6μL濃度為10μM的反向引物、0.4μL50×ROXReferenceDyeII、2μL坡黃材料的cDNA和6.4μL無核酸酶水組成。熒光定量PCR檢測的反應程序為:95℃預變性15min;95℃變性10sec,60℃退火15sec,72℃延伸20sec,40個循環。以天隆一號中的GmGATA44基因的相對表達量作為1,GATA44OX-1的T2代純合植株、GATA44OX-2的T2代純合植株或T2代純合轉空載體大豆中GmGATA44基因的相對表達量部分結果見圖3中c(WT為天隆一號)。結果表明,與天隆一號相比,GATA44OX-1的T2代純合植株和GATA44OX-2的T2代純合植株中GmGATA44基因的相對表達量顯著提高,T2代純合轉空載體大豆中GmGATA44基因的相對表達量無顯著差異。五、統計轉GmGATA44基因大豆的百粒重將30株待測大豆材料(T2代GATA44OX-1純合株系、T2代GATA44OX-2純合株系、天隆一號或T2代純合轉空載體大豆)種植于中國農業科學院油料作物研究所轉基因圃(株距10cm,行距40cm),成熟后將種子收獲并晾干。隨機取100粒成熟種子作為樣品1。隨機取100粒成熟種子作為樣品2。隨機取100粒成熟種子作為樣品3。將樣品1、樣品2和樣品3先分別稱重,再取平均值,得到待測大豆材料種子的百粒重。實驗結果見圖4(WT為天隆一號)。結果表明,與天隆一號種子相比,T2代GATA44OX-1純合株系的種子和T2代GATA44OX-2純合株系的種子的百粒重顯著提高(分別增加了12.9%和33.3%),T2代純合轉空載體大豆的種子的百粒重無顯著差異。上述結果表明,蛋白質GmGATA44在調控大豆粒重(如百粒重)中具有重要的應用價值。<110>中國農業科學院油料作物研究所<120>蛋白質GmGATA44在調控植物粒重中的應用<160>2<170>PatentInversion3.5<210>1<211>945<212>DNA<213>大豆(Glycinemax(L.)Merr.)<400>1atgattccagcctatcgccactcagtatcttctgttatgcctctggatcttaatgaagat60caaaaccacgagttcttcagtccaattcatcacccttcctcttcgttttcttctctatct120tcatcatatcctattctcttcaacccgccaaatcaagatcaagaagctcgatcatacgac180tgggaaacaacaaagcacttaccaagtcatgaagaagaggctgagaagattatccctact240agtggatcatggggtcactcggtggaagaaagtgagcataaggtgacagtttggagaaaa300gaagagaggaatgaaaatcttgctgaagatggttcggtgaagtggatgccttcgaagatg360agaattatgcggaagatgttggtgtccaatcaaactgatgcatacacttcagacaacaac420actacgcacaagtttgatgatcataaacaacaactgtcgtcaccgcttggaattgatgat480aacagcagcaacaactattcagacaaaagtaacaacagtattgttagggtttgttctgat540tgccacaccaccaagactcctctatggaggagtggaccaagaggccccaagtcgctttgc600aatgcctgcggaattcgacaaaggaaggcaagacgagccatggcagctgctgcggcggca660gcattgggagatggagcagttattgtggaagctgagaaatctgtgaagggaaagaagttg720cagaagaagaaagagaagaagacaagaattgagggtgcagctcagatgaaaatgaagcgg780aagcttggagttggagcaaaggcatcacaaagtagaaacaagtttggttttgaggatttg840acattgcgcttgagaaagaacttggctatgcatcaagttttccctcaggacgagaaggag900gctgcgatcctcctcatggctttatcttatggccttgttcattga945<210>2<211>314<212>PRT<213>大豆(Glycinemax(L.)Merr.)<400>2MetIleProAlaTyrArgHisSerValSerSerValMetProLeuAsp151015LeuAsnGluAspGlnAsnHisGluPhePheSerProIleHisHisPro202530SerSerSerPheSerSerLeuSerSerSerTyrProIleLeuPheAsn354045ProProAsnGlnAspGlnGluAlaArgSerTyrAspTrpGluThrThr505560LysHisLeuProSerHisGluGluGluAlaGluLysIleIleProThr65707580SerGlySerTrpGlyHisSerValGluGluSerGluHisLysValThr859095ValTrpArgLysGluGluArgAsnGluAsnLeuAlaGluAspGlySer100105110ValLysTrpMetProSerLysMetArgIleMetArgLysMetLeuVal115120125SerAsnGlnThrAspAlaTyrThrSerAspAsnAsnThrThrHisLys130135140PheAspAspHisLysGlnGlnLeuSerSerProLeuGlyIleAspAsp145150155160AsnSerSerAsnAsnTyrSerAspLysSerAsnAsnSerIleValArg165170175ValCysSerAspCysHisThrThrLysThrProLeuTrpArgSerGly180185190ProArgGlyProLysSerLeuCysAsnAlaCysGlyIleArgGlnArg195200205LysAlaArgArgAlaMetAlaAlaAlaAlaAlaAlaAlaLeuGlyAsp210215220GlyAlaValIleValGluAlaGluLysSerValLysGlyLysLysLeu225230235240GlnLysLysLysGluLysLysThrArgIleGluGlyAlaAlaGlnMet245250255LysMetLysArgLysLeuGlyValGlyAlaLysAlaSerGlnSerArg260265270AsnLysPheGlyPheGluAspLeuThrLeuArgLeuArgLysAsnLeu275280285AlaMetHisGlnValPheProGlnAspGluLysGluAlaAlaIleLeu290295300LeuMetAlaLeuSerTyrGlyLeuValHis305310當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1