藥用激肽原酶及其制備方法和應用與流程
本發明涉及蛋白類藥物,特別是藥用激肽原酶及其制備方法和其在藥物制備中的應用。
背景技術:
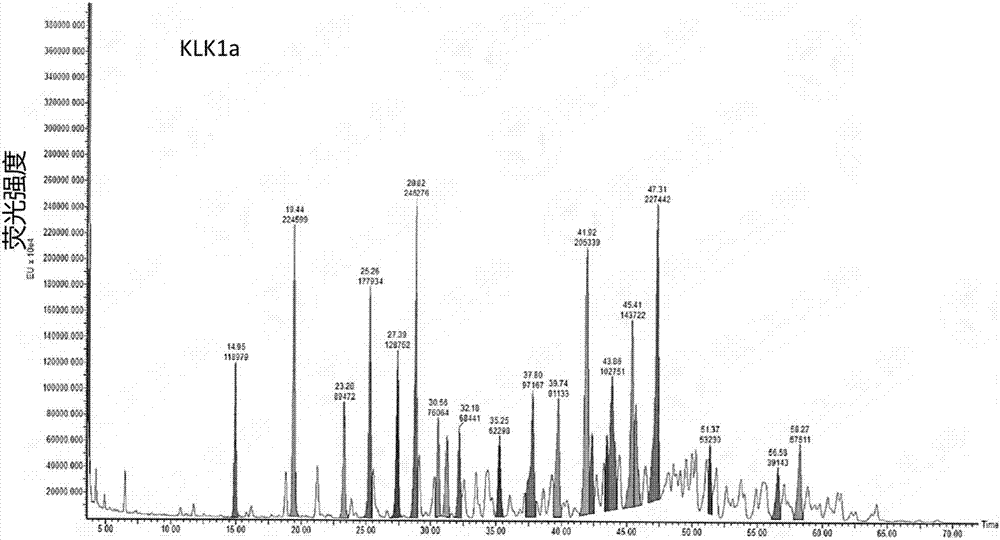
:激肽原酶,又稱激肽釋放酶(kininogenase)或血管舒緩素(kallidinogenase),它是屬于絲氨酸蛋白酶的一種,存在于各種組織和生物液體中,催化大分子前體物(激肽原,kininogen)釋放生物活性肽(激肽,kinin)。激肽原酶的生理效應包括使毛細血管和動脈血管舒張以及通透性增加,使冠狀動脈、腦、視網膜處的血流供應增加,適用于高血壓冠狀血管以及動脈血管硬化等癥,對心絞痛、血管痙攣、血栓性閉塞性脈管炎、凍瘡以及創傷等癥也有治療作用。同時,激肽原酶也可以作為活化因子,使纖溶酶原激活成纖溶酶,將不溶性的纖維蛋白水解成可溶性的小肽,從而對腦梗塞、動脈粥樣硬化等起到治療作用,并用于治療血栓、預防血栓再形成(g.m.yousef,e.p.diamandisclinbiochem,2003(36):443-452)。體外研究顯示,激肽原酶對離體動脈具有舒張作用,并可抑制血小板聚集、增強血細胞變形能力和氧解離能力。動物試驗顯示,激肽原酶靜脈注射可增加麻醉犬椎間、頸總和股動脈血流量,增加麻醉犬后肢、家兔肌肉血流量。因此,激肽原酶在人類微循環障礙及輕-中度急性血栓性腦梗死等疾病的治療中具有較高的應用價值。國內市場上現有的激肽原酶藥物分為兩類:一類是從豬胰臟中提取的激肽原酶,它來源廣泛。另一類是從新鮮人尿中提取精制的人尿激肽原酶。其中從豬胰臟提取的激肽原酶的相關產品目前市場上主要有麗珠醫藥、上海第一生化、沈陽濟世、河南靈佑、南昌萬華、濟南維爾康,常州千紅。但是市售豬胰激肽原酶注射液使用時注射部位常有紅腫、疼痛的癥狀,并且,申請人也在大鼠急性缺血性腦卒中實驗中發現有大鼠在用藥后死亡的情況,因此,申請人推測在現有市售產品中有副作用較大的成分存在。技術實現要素:解決的技術問題:本發明主要解決了如何進一步提高豬胰臟來源激肽原酶產品質量的問題,提供了一種活性更高、穩定性更好的激肽原酶;同時解決了豬胰臟來源激肽原酶分離純化困難,無法產業化的問題,提供了一種可以應用于大規模生產制備的分離純化klk1b,klk1a和klk1c單組分的方法。技術方案:豬胰臟來源的激肽原酶是由3種不同糖基化程度的組分所組成,蛋白電泳分析是呈3條條帶,依據分子量由大到小依次命名為klk1b、klk1a、klk1c。目的之一是提供一種激肽原酶(klk1),所述激肽原酶中不含有組分klk1c,所述klk1c是在豬胰臟來源的klk1的sds-page蛋白電泳時三條帶中分子量最低的條帶。優選的,上述激肽原酶(klk1),其由組分klk1b、klk1a中的一種或兩種組成。所述組分klk1b是在豬胰臟來源的klk1的sds-page蛋白電泳時三條帶中分子量最高的條帶,所述klk1a是在豬胰臟來源的klk1的sds-page蛋白電泳時三條帶中分子量第二的條帶。最優選的,上述激肽原酶(klk1),其為klk1b。本發明的另一個目的是,提供一種激肽原酶klk1的精純方法,包括如下步驟:步驟1,激肽原酶溶液用陰離子交換色譜柱純化,梯度洗脫;步驟2,步驟1梯度洗脫分步收集的樣品溶液繼續用陰離子交換色譜柱純化。所述陰離子交換色譜柱的填料為hpq。所述步驟1梯度洗脫條件為:首先以流動相:88%~90%a液與12%~10%b液,洗脫10個柱體積;然后梯度洗脫,洗脫30個柱體積,期間b液濃度逐漸增加至30%;流速5~10ml/min。所述步驟1中激肽原酶溶液的濃度是0.1~30mg/ml,由a液稀釋而成。所述步驟2梯度洗脫條件為:首先以流動相:88%~90%a液與12%~10%b液,洗脫10個柱體積;然后梯度洗脫,洗脫20個柱體積,期間b液濃度逐漸增加至20%;流速5~10ml/min。a液為20~50mmtris-hcl,ph8.0~9.0;上述所述b液為含1mnacl的20~50mmtris-hcl。使用該方法進行純化,產品的收率較高,單組分達到60%以上,操作簡單,適用于規模放大,且產品的純度較高,可達95%以上。所述ph8~9的調節緩沖液是tris-hcl、磷酸、硼酸硼砂等緩沖液。本發明的另一個目的是,提供一種上述所述激肽原酶在制備治療腦卒中藥物中的應用。本發明的另一個目的是,提供一種上述所述激肽原酶在制備治療糖尿病引起的腎病的藥物中的應用。本發明的另一個目的是,提供一種上述所屬所述激肽原酶在制備治療其它微循環疾病藥物中的應用。本發明的另一個目的是,提供一種上述所述激肽原酶臨床使用為靜脈注射或肌肉注射型,劑量為10ug/m2~100ug/m2。本發明的另一個目的是,提供一種治療腦卒中以及糖尿病引起的腎病藥物,有效成分為上述激肽原酶及其藥學上可接受的鹽及其復合物。藥學上可接受的鹽在其被施用的量和濃度存在時是非毒性的。制備此類鹽可通過改變化合物的物理特征而不妨礙其發揮生理學效果來促進藥物應用。在物理特性方面有用的改變包括降低熔點以促進經粘膜施用、增加溶解性以促進施用更高濃度的藥物等。上述所述的藥學上可接受的鹽包括酸加成鹽,例如含有硫酸鹽、鹽酸鹽、延胡索酸鹽、馬來酸鹽、磷酸鹽、醋酸鹽、檸檬酸鹽、乳酸鹽、酒石酸鹽、甲磺酸鹽、苯磺酸鹽等。上述所述的藥學上可接受的鹽可來自酸,包括鹽酸、馬來酸、硫酸、磷酸、乙酸、檸檬酸、乳酸、酒石酸等。藥學上可接受的載體和/或賦形劑也可被摻入根據本發明的藥物組合物中促進特定激肽原酶的施用。適于實施本發明的載體包括碳酸鈣,磷酸鈣,各種糖類(乳糖、葡萄糖、蔗糖),或各種淀粉,纖維素衍生物,明膠,植物油,聚乙二醇,以及生理學上相容的溶劑(包括用于注射的無菌水溶液,鹽溶液和右旋糖)等。有益效果:本發明提供的豬胰臟來源激肽原酶,和現有市場上的豬胰臟來源激肽原酶比較,純度更高去除了副作用最大的klk1c組分,生物活性及藥效更高,副作用小,更具穩定性。由于klk1b,klk1a,klk1c這三個組分僅在糖基化程度上有微小差別,其蛋白的氨基酸序列完全一致,理化性質相似性較高,因此要把其中的單組分分離純化出來并實現產業化具有較大難度。同時藥效結果也顯示糖基化修飾程度最低的klk1c是原產品產生安全性問題的主要原因。目前國內外未見有相關的klk1單組分純化分離并對其藥效進行研究的報道,而本發明很好地解決了klk1b,klk1a和klk1c分離困難、無法產業化的問題。附圖說明圖1a、1b:單組分klk1b的純化色譜圖其中圖1a是經過第一步離子交換層析的色譜圖,峰1的箭頭部分區域為目的產物的收集范圍。圖1b是經過第二步離子交換層析的色譜圖,圖中的單個主峰即是目的產物klk1b。圖2a、2b:單組分klk1a的純化色譜圖其中圖2a是經過第一步離子交換層析的色譜圖,峰2的箭頭部分區域為目的產物的收集范圍。圖2b是經過第二步離子交換層析的色譜圖,圖中的箭頭部分區域即是目的產物klk1a。圖3a、3b:單組分klk1c的純化色譜圖其中圖3a是經過第一步離子交換層析的色譜圖,峰3的箭頭部分區域為目的產物的收集范圍。圖3b是經過第二步離子交換層析的色譜圖,圖中的箭頭部分區域即是目的產物klk1c的收集峰。圖4:單組分klk1的蛋白電泳純度分析圖中第1-5泳道的樣品分別是:蛋白marker,klk1,klk1b,klk1a,klk1c。圖5:單組分klk1的westernblot鑒定圖中第1-5泳道的樣品分別是:蛋白marker,klk1,klk1b,klk1a,klk1c。從圖中可以看出,klk1的單組分和klk1一樣,都能和klk1的抗體很好的結合。圖6a、6b:klk1糖型分析其中圖6a:klk1b的糖型分析圖。圖6b:klk1a的糖型分析圖圖7a、7b:klk1質譜分析圖其中圖7a:klk1b質譜分析圖。圖7b:klk1a質譜分析圖圖8:klk1單組分的氨基酸覆蓋譜圖,由上至下分別為klk1b、klk1a、klk1c三個單組分的氨基酸覆蓋譜圖。圖9:單組分klk1的熱穩定性比較由圖可知,在65℃水浴條件下,klk1b,klk1a的穩定性最高,放置2小時依然保留了75%以上的活性;含有klk1b和klk1a的混合物的穩定性和klk1b或klk1a基本無差別,均高于未精純的klk1原蛋白及klk1c;而klk1c的熱穩定性最差,在放置2小時后只保留了50%的活性。圖10aklk1單組分靜脈注射組藥時曲線圖10bklk1單組分肌肉注射組藥時曲線具體實施方式定義:本發明使用以下縮寫:klk1:豬胰臟中提取的激肽原酶,含有klk1b,klk1a,klk1c的混合物。klk1b:sds-page蛋白電泳中分子量最大的條帶所代表的klk1組分;klk1a:sds-page蛋白電泳中分子量第二的條帶所代表的klk1組分;klk1c:sds-page蛋白電泳中分子量第三的條帶所代表的klk1組分;單組分klk1:即klk1b或klk1a或klk1c,根據以下實施例進一步分析確定,該三種單組分klk1都是豬胰臟激肽原酶,具有相同的氨基酸序列,klk1b、klk1a、klk1c,僅為分子量由高到底,糖基化修飾程度由高到低。實施例1不同介質純化klk1單組分的比較為了純化得到klk1中的單組分樣品,進行了純化條件的摸索,篩選了大量的介質。具體結果見表1所示。表1不同介質篩選介質名稱純化得到單組分klk1b的純度總蛋白收率captoqimpres(ge)80%10%captoqadhere(ge)84%10%deaesepharoseff(ge)50%20%hpq(ge)98%30%qff(ge)90%20%sourceq(ge)88%10%captodeae(ge)60%25%superq650(tosh)86%18%q-600ar(tosh)80%15%通過大量的介質篩選結果得出,使用hpq介質(購自ge公司)的分離效果最好,單組分klk1b的純度可達到98%,收率達85%。實施例2豬胰激肽原酶單一組分klk1b、klk1a以及klk1c分離純化制備例1用a液將豬胰激肽原酶(來自常州千紅生化制藥股份有限公司)稀釋成6mg/ml,用離子交換色譜層析進行純化。純化的色譜法條件:離子交換介質(qff),a液:50mm的tris-hcl(ph9.0),b液:含1mnacl的50mm的tris-hcl(ph9.0);流速10ml/min,檢測波長為280nm。上樣:上述豬胰激肽原酶稀釋液,結合至qff離子交換柱。平衡:a液沖洗5個柱體積。洗脫:流動相配比為12%b,88%a,洗脫10個柱體積后,進行梯度洗脫。梯度條件為12%b~30%b,30個柱體積。收集:收集峰1前部分洗脫產物作為klk1b,如圖1a所示;收集峰2后部分洗脫產物作為klk1a,如圖2a所示,收集峰3后部分洗脫產物作為klk1c,如圖3a所示。用a液將第一次分離純化收集到的3種洗脫產物分別稀釋2倍后,用離子交換色譜層析分別進行第二次純化。純化的色譜法條件:離子交換介質(hp-q),a液:50mm的tris-hcl(ph9.0),b液:含1mnacl的50mm的tris-hcl(ph9.0),流速10ml/min,檢測波長為280nm。上樣:上述收集產物稀釋液,結合至hp-q離子交換柱。平衡:a液沖洗5個柱體積。洗脫:流動相配比為12%b,88%a,洗脫10個柱體積后,進行梯度洗脫。梯度條件為12%b~20%b,洗脫體積為20個柱體積。收集:收集洗脫峰,klk1b、klk1a、klk1c的洗脫峰,分別如圖1b、2b、3b所示。制備例2、3為在制備例1調整部分參數的重復試驗,如表2所示為調整的第一次分離純化時的部分參數;如表3所示為調整的第二次分離純化時的部分參數。表2調整第一次分離純化的部分參數表3調整第二次分離純化的部分參數后續純度檢測試驗顯示制備例1-3能夠較好地分離出klk1b、klk1a,klk1c組分,純度可達95%以上。實施例3豬胰激肽原酶單一組分klk1b、klk1a以及klk1c分離產物純度檢測sds-page法檢測(1)電泳:制備12%的聚丙烯酰胺凝膠后,上樣運行。80v運行30min,待溴酚藍指示劑跑出濃縮膠后改為150v運行30min。(2)考馬斯亮藍染色:電泳結束后,將膠剝開置于考馬斯亮藍染液中,染色30min。(3)脫色:染色結束后,將膠置于脫色液中,過夜脫色。分析結果如圖4所示。收率方面,klk1b的收率可達到85%以上,klk1a的收率可達到60%,而klk1c的收率較低,但是分離純化后klk1各組分純度均可達到95%。因此本實施例中的純化方法,在用于純化klk1b時,有較高的收率,產品的純度較高。實施例4豬胰激肽原酶單一組分klk1b、klk1a以及klk1c的westernblot檢測(1)電泳:制備12%的聚丙烯酰胺凝膠后,上樣運行。80v運行30min,待溴酚藍指示劑跑出濃縮膠后改為150v運行30min。(2)轉膜(半干式電轉印):電泳結束后,取出凝膠。按照以下順序放置濾紙,凝膠和pvdf膜到半干槽中:濾紙→pvdf膜→膠→濾紙。轉膜電流為膜面積的0.8~2倍,本實驗室的6x9cm的膜所用電流一般為100ma,1h。(3)膜的封閉:加入封閉液(5%脫脂奶粉+tbst),室溫,搖床搖1h。用tbst洗三次,每次5min。(4)一抗孵育:按照1:500比例用一抗稀釋液稀釋一抗,室溫搖床上緩慢搖動孵育1h。tbst洗膜3次,每次5min。(5)二抗孵育:按照1:5000比例用2.5%脫脂奶粉稀釋羊抗鼠的igg,常溫搖床搖1h。tbst洗膜3次,每次5min。(6)顯色:剪取適當大小的膜于保鮮膜上,將膜上的tbst溶液去盡,加顯色液(0.5ml魯米諾/強劑溶液+0.5ml穩定型過氧化物溶液,一張膜用量),顯色1min,去盡顯色液,置于凝膠成像系統曝光、顯色。分析結果如圖5所示。制備例1、2、3中各個條帶的位置和各樣品在蛋白電泳中的相同。說明純化的單組分klk1均可以和klk1的抗體很好結合,說明不同的單組分klk1具有相同的氨基酸序列,而分子量的差異是由于糖基化修飾的不同產生的。實施例5:klk1單組分的糖型分析、質譜分析樣品處理步驟大致如下:把klk1b,klk1a樣品分別用超濾管進行緩沖液置換,置換至酶解緩沖液中,然后加入pngasef進行酶切。酶切結束后用hilic固相萃取柱去除溶液中的蛋白和鹽,真空離心凍干。凍干后的樣品用2-ab進行熒光標記。根據flr圖譜(圖6a、6b)結果可知,klk1b的糖型較復雜,多為三天線及四天線糖型結構。豐度最高的糖型比例為14.04%,大于5%的糖型種類僅占4種,且這四種糖總比例僅為36%,其余70%左右的幾十種糖型的單個比例均在5%以下。質譜檢測其分子量約為29kda。而klk1a中,豐度最高的糖型比例為10.3%,大于5%的糖型種類有七種,且這七種糖總比例占約50%,其余含量的十幾種糖型單個比例均在5%以下。質譜檢測其分子量約為27kda。由糖形分析的結果可知,豬胰臟來源的klk1不同組分的糖基化不同。由質譜圖譜分析得出klk1b和klk1a的分子量分別為29427da和27046.87da。如圖7a和7b所示。但由于豬胰激肽原酶的糖型會受到動物飼養環境,飼料等的影響而產生一定的變化,因此其分子量一般會有100da的上下浮動。klk1b的分子量比klk1a大2000da左右,主要是由于其糖基化水平顯著高于klk1a造成的,這和蛋白電泳的分析結果以及糖型分析的結果是一致的。實施例6klk1單組分的氨基酸覆蓋率比較為了比較分離純化出的3種單組分的氨基酸序列是否一致,我們進行了氨基酸覆蓋率的比較。3種單組分樣品用胰蛋白酶酶解后,進行一定的處理然后用lc-ms(xevo-g2s-q-tof)進行肽圖分析檢測,最終用biopharmlynx,unifi,proteinlynx分析軟件進行數據分析。最終分析的結果見圖8所示,由圖8可看出,3個單組分中75%左右的肽段被鑒定出,三者之間無差異,并且和豬胰激肽原酶的理論序列一致,進一步驗證了三種單組分僅僅是糖基化不同,氨基酸一級序列完全一致。圖8中沒有覆蓋的個別肽段,可能是由于胰酶切后肽段太小而不能有效檢測,但n端和c端區域的肽段都已覆蓋,三者無差異,和理論序列一致。實施例7:豬胰激肽原酶單一組分klk1b、klk1a以及klk1c的藥效比較選擇240~260g健康雄性sd大鼠作為實驗動物,設置假手術組、溶媒對照組、klk1組、klk1b組、klk1a組以及klk1c組,動物隨機分組,每組20只。大鼠麻醉后仰臥保定,分離右側頸總動脈(cca)、頸外動脈(eca)和頸內動脈(ica),結扎cca近心端與eca,在ica處掛線備用;栓線經由ica插入20mm至中動脈,結扎血管,逐層縫合肌肉和皮膚,將線栓線頭留于皮膚外;假手術組僅分離血管,不插入栓線。手術操作結束后,肌注一定量的抗生素。1.5h后,輕輕拔出線栓進行再灌注,同時肌注各組相應受試藥物,劑量分別為klk1b組12μg/kg、klk1a組12μg/kg以及klk1c組12μg/kg,模型組和假手術組給予對應溶媒。給藥24h后對大鼠進行采用改良型神經損傷嚴重程度評分(mnss);在整個試驗過程中,進行一般情況觀察,主要內容包括:死亡、昏迷、呼吸、大小便性狀、毛色、精神狀況、嘔吐及嘔吐物、出血、驚厥、抽搐等,剔除因意外因素導致異常的動物。mnss評分結束后用10%的水合氯醛麻醉大鼠,取腦,去除嗅球、小腦和低位腦干,用生理鹽水沖洗大腦表面血跡,吸去表面殘留水跡,于-20℃放置30min,取出后立即于視線交叉平面垂直向下作冠狀切面,并向后每隔2mm切一片,將腦片置于2%ttc染液中溫育20min,正常腦組織染成深紅色,缺血腦組織則呈蒼白色,用生理鹽水沖洗后,4%甲醛溶液固定,吸干表面殘留水跡,拍照,計算梗死面積。腦梗死面積的計算采用如下的方法進行。sd大鼠大腦用ttc(2,3,5-氯化三苯基四氮唑,sigma)染色后用圖像分析軟件對照片進行統計,按如下公式計算腦梗死面積的百分比。試驗結果表明,在神經缺陷癥狀評分及腦梗死面積計算實驗中,klk1c未有明顯改善神經癥狀缺陷和腦梗死面積,并且死亡率比模型組更高;klk1b組和klk1a組相對于模型組均具有顯著性差異,且死亡率較低。結果如表4所示。表4klk1b、klk1a、klk1c神經缺陷癥狀、腦梗死面積從實驗結果可以看出,klk1b組,klk1a組在治療腦梗時,能夠顯著縮小腦梗死面積,改善神經缺陷癥狀,且老鼠死亡率低,總體藥效優于klk1對照組。而klk1c組分,沒有顯示出顯著藥效,同時,動物的死亡率較高,說明該組分副作用較大。klk1b組分和klk1a組分的成藥性最好,和原有的klk1比較,有望開發出藥效更好,副作用更小的藥物。實施例8:klk1單組分的熱穩定性為了比較不同klk1單組分的穩定性,本實施例分別檢測了klk1b、klk1a、klk1c及原蛋白在65℃水浴放置一段時間后的活性。具體方法如下:把pbs緩沖液溶解的蛋白濃度為1mg/ml的klk1b、klk1a、klk1c、klk1b和klk1a的混合物(以下簡稱klk1b&klk1a)及原蛋白klk1置于65℃水浴中,分別于一定時間內取樣并放入4℃冰箱備用。取樣結束后采用實施例9中的方法(即2005版《中華人民共和國藥典》第三部的附錄ⅸf所述方法)檢測其生物活性。檢測結果如圖9所示。由圖9可以看出,與原蛋白klk1相比,klk1b,klk1a的熱穩定性均有提高,含有klk1b&klk1a穩定性和klk1b或klk1a基本無差別,而klk1c組分的穩定性顯著較弱。說明糖基化的不同對組分的熱穩定性有明顯的影響,去除了klk1c組分的豬激肽原酶穩定性較高。實施例9:豬胰激肽原酶單一組分klk1b、klk1a以及klk1c純化樣品等體外活性檢測2010版藥典第二部第850頁所述方法進行。檢測的樣品分別是豬胰激肽原酶未分離純化的klk1和單一組分klk1b、klk1a、klk1c純化樣品以及klk1b&klk1a,它們的活性比較結果如表5所示。由表中可以看出,klk1b較klk1原蛋白比活高400個單位;klk1a與klk1原蛋白比活相近;而klk1c純化樣品較klk1原蛋白比活低近250個單位,klk1b&klk1a介于單組分klk1b、klk1a之間。由此可見,雖然豬胰激肽原酶的klk1b、klk1a以及klk1c的氨基酸序列完全相同,但是由于其糖基化修飾程度的不同導致體外活性出現較大的差異。表5單組分klk1樣品的比活樣品klk1klk1bklk1aklk1cklk1b&klk1a比活(u/mg)1200163113349521489實施例10klk1及單組分的藥代動力學比較本試驗主要采用tca沉淀蛋白的方法結合hplc對經同位素(125i)標記的125i-klk1a、125i-klk1b和125i-klk1c在sd大鼠體內藥代動力學特征及生物利用度進行了研究。動物共分6組,每組均6只動物,雌雄各半,3組動物靜脈注射給藥,3組動物肌肉注射給藥。125i-klk1a、125i-klk1b和125i-klk1c靜脈和肌肉給藥劑量均為15μg/kg。根據分組前測定的動物體重,選擇檢疫合格、體重相近的72只動物,使用計算機系統將動物按性別區段隨機分為6組。每組6只,雌雄各半。分組信息見表6。表6給藥后,每隔一定時間取血,取血前大鼠采用異氟烷麻醉,各時間點大鼠眼眶靜脈叢取血,約200μl。立即加入有肝素鈉抗凝的ep管中,反復顛倒5~10次。血樣采集后4000rpm離心5min分離出血漿。取50μl血漿,加入等體積的20%三氯乙酸(tca),渦旋混勻后,γ計數器計數1min測定總放射性。之后4500rpm,離心5min,棄上清,γ計數器計數1min測定沉淀部分放射性。濃度計算:所有動物在所有藥代指標的血樣留取后,采用3%戊巴比妥鈉麻醉動物,然后用腹主動脈放血法將動物安樂死。使用代謝動力學數據分析軟件winnonlin對血藥物濃度數據進行分析。代謝參數計算使用理論采樣時間點。利用非房室模型法(nca)對相關動力學參數進行計算,并計算生物利用度。利用microsoftexcel計算均值、標準差、變異系數等。從試驗結果可以看出:125i-klk1a靜脈和肌肉注射給藥后半衰期分別為3.07h和3.79h,auc(0-t)分別為355.13和623.65hr*ng/ml,清除率cl分別為37.06和19.76ml/hr/kg,平均體內滯留時間分別為11.58和62.63hr;125i-klk1b靜脈和肌肉注射給藥后半衰期分別為4.78h和5.12h,auc(0-t)分別為336.21和564.76hr*ng/ml,清除率cl分別為38.09和22.1ml/hr/kg,平均體內滯留時間分別為12.27和68.72hr;125i-klk1c靜脈和肌肉注射給藥后半衰期分別為2.66h和2.74h,auc(0-t)分別為269.30和451.58hr*ng/ml,清除率cl分別為49.23和24.94ml/hr/kg,平均體內滯留時間分別為11.54和64.43hr。如圖10a、10b和表7所示。表7klk1單組分大鼠體內藥代動力學參數從藥代動力學的結果可看出,klk1中三種單組分的藥代動力學特性無顯著差異,klk1b和klk1a組分略優,klk1c樣品相對較差。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1