一種循環腫瘤細胞陰性富集方法與流程
本發明涉及分子生物學領域,特別涉及一種循環腫瘤細胞陰性富集方法。
背景技術:
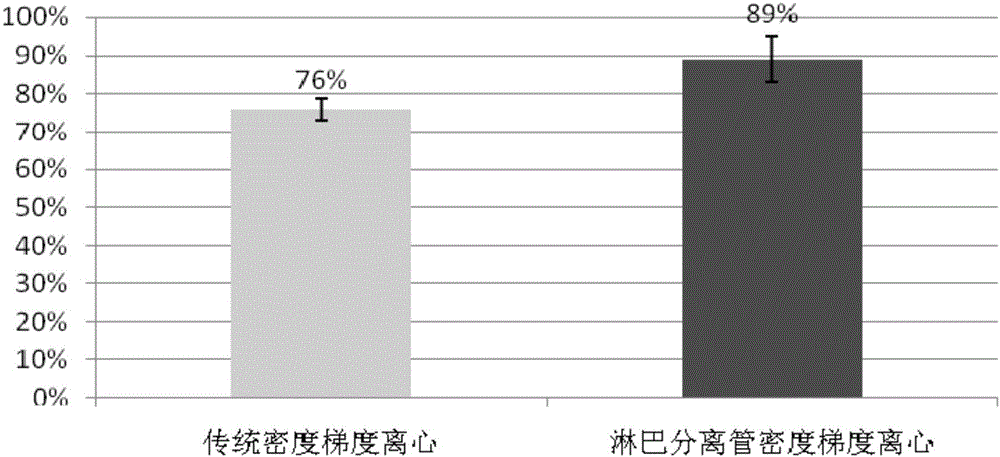
:循環腫瘤細胞(circulatingtumorcells,CTC)是指自發或因診療操作由實體瘤或轉移灶釋放進入外周血循環的腫瘤細胞,是惡性腫瘤患者出現遠處轉移的主要原因。據統計,轉移是超過90%的腫瘤患者的死亡原因。近年來,隨著一些基礎學科相關技術的不斷改進,CTC檢測作為一種新型的非侵入性診斷工具,相比傳統組織活檢具有無創、可多次獲取、可實時監測等優勢,因此檢測CTC被形象地稱為“液體活檢”,具有重要的臨床研究及應用價值,已成為臨床研究的熱點。已有大量臨床研究已經證實:通過對循環腫瘤細胞的檢測,可有效地進行對多種腫瘤進行早期診斷、預后判斷、監測術后復發、個體化治療、化療藥物的快速評估、耐藥性的監測等。近10年的大量臨床研究表明,檢測CTC數量有助于結腸癌、肝癌、乳腺癌、前列腺癌患者的預后評估;當CTC出現上皮間質轉換(EMT)、過表達上皮細胞粘附分子(EpCAM)時,往往提示腫瘤患者預后不佳,臨床研究發現,早期發現的癌癥患者,90%可以治愈。但是,由于常規檢測技術的局限性,早期發現癌癥的人群只占少數,我國早期(Ⅰ期)癌癥病人約占總體病人數5%-10%,70%的病人都屬于晚期發現,這類病人5年生存率僅10%~30%。世界衛生組織早在2006年就指出癌癥的防治三原則:早發現、早診斷、早治療,可見,盡早發現是癌癥防治的關鍵。但是在腫瘤的常規檢測手段中,例如CT或核磁共振檢查,對小于5毫米的腫瘤診斷比較困難,如胰腺癌、肺癌往往發現確診以后都是中晚期的。現在發現,很多腫瘤在1毫米的情況下已經可以在血液里查到循環腫瘤細胞(circulatingtumorcells,CTC)。因此,早期發現微轉移不僅對腫瘤復發和預后的判斷有重要意義,而且對指導臨床治療也有很大價值。而目前臨床腫瘤的發現和診斷仍高度依賴于影像學及血清腫瘤標志物的檢查,難以早期發現腫瘤的轉移或復發,也難以及時反映療效。因此,現有腫瘤常規篩查、診斷方法不能滿足臨床需求,臨床迫切需要安全、準確性高、操作方便的癌癥篩查、診斷新方法。血液中循環腫瘤細胞以較低的數量存在于血液中,一般需要富集后才能有效檢測和分析。血液中的細胞種類繁多,要絕對準確地鑒定血液中的腫瘤細胞,并不容易。CTC在腫瘤患者外周血中極為稀少,約1~10個/mL,而正常成人外周血中所有血細胞濃度為109/mL,白細胞的濃度是4~10×106/mL。遠低于血液中其他類型細胞數量的稀缺性使得CTC在血液檢測中極具挑戰性。CTC檢測一般包括CTC富集和CTC鑒定兩個部分,通常要通過富集的步驟以去除大部分正常細胞,然后再鑒定得到的細胞的確是CTC。CTC的富集方法主要分為物理方法和生物化學方法兩大類。CTC的鑒定主要通過細胞形態學或核酸分子水平進行分析鑒定。CTC的富集方法主要分為物理方法和生物化學方法兩大類。物理法基于腫瘤細胞與正常細胞物理性質,如大小、變形性、密度、介電性等的差異,利用外力場比如磁場,流體場,電場等的作用進行分離捕獲。生物化學法通常依賴于細胞膜表面的抗原與偶聯在分離介質上的抗體相結合,達到分離捕獲的目的。現階段應用于CTC的富集技術主要包括:基于細胞密度的離心法、基于細胞體積的濾膜過濾法(isolationbysizeofepithelialtumourcells,ISET)、免疫磁珠法(magneticactivatedcellsorting,MACS)、CTC-Chip微流控芯片技術等。現有密度梯度離心法特異性低、敏感性低、回收率低、穩定性低,不僅容易造成腫瘤細胞丟失,且依賴于腫瘤細胞的特性、離心的時間、溫度等多種因素,作為單一的CTC分離手段未來發展潛力十分有限。ISET法雖然操作簡便、價格低廉、通量高,可同時大批量處理樣本,耗時較短,但存在缺乏特異性、腫瘤細胞被漏檢(≦8um)的可能,同樣不可能成為未來的發展趨勢與潮流。CTC當前循環腫瘤細胞富集應用最廣發的是陽性富集的方法,包括免疫磁珠法陽性富集、微流控芯片法陽性富集。微流控芯片應用于稀有細胞分選的不足主要表現在耗時長、效果差、細胞活性受損三個方面。此外,通量和純度在大多數芯片中往往是互相制約的兩個指標,通量上升則意味著純度下降,反之亦然,如何兼顧兩者是微流控分選技術發展的又一挑戰。最后,考慮到捕獲到的細胞可能含有不同的亞型,或是同一類細胞的不同生長階段,后續的表型分析對臨床診斷具有重要意義,這對捕獲細胞的活性提出了較高的要求。但是,微通道中微結構的擠壓,高剪切流的流場,外加的電場、聲場等都會對細胞的活性造成一定的損傷,對后續分析造成困擾。申請號為201110161224.7的中國專利公開了一種定量分析循環腫瘤細胞的試劑及試劑盒,通過設計適宜檢測循環腫瘤細胞的探針,從而可配合流式細胞技術,獲得循環腫瘤細胞的測定結果。免疫磁珠法是目前應用最為廣泛的CTC分離方法,主要是指陽性富集法,具有簡便易行、分離純度高的優點,但回收率低、存在漏檢的缺陷也非常明顯。目前,大量的免疫磁珠法CTC研究根據腫瘤的上皮抗原進行分離,并且認為EpCAM是目前最優的腫瘤生物標記物,但有研究表明大多數惡性腫瘤的CTC會丟失EpCAM抗原。這就意味著這種方法有可能會漏檢具有侵害性的CTC。事實上,研究發現134種組織類型不同的腫瘤細胞只有70%表達EpCAM,但存在表達強度不一的差異性。目前,尚沒有一種100%特異性的腫瘤生物標記物。但循環腫瘤細胞陽性富集方法存在著CTC特異性標志物缺乏、單克隆抗體篩選困難、回收率低、存在漏檢(抗體無法識別的腫瘤細胞被忽略)等缺點,影響檢測結果。由于CTC缺乏特異性的標志物,目前普遍采用EpCAM(上皮細胞粘附分子)磁珠標記并分離CTC,基于這一原理發展起來的CellSearch等儀器已經投入市場運作。然而,該方法無法檢出低表達和不表達EpCAM的CTC。已有研究指出,基于這一原理分離CTC將低估其數量并丟失具有高轉移及增殖潛力的CTC亞群。一個典型的例子就是,發生上皮-間質轉化(EMT)的CTC低表達或不表達EpCAM亞群因為具有高的遷移力而被認為是造成轉移的最主要原因之一。與免疫磁珠陽性富集方法相比,CTC免疫磁珠陰性富集方法具有更多的優勢。該技術利用結合有CD45單克隆抗體的免疫磁珠特異性結合白細胞表面的CD45抗原(白細胞共同抗原),對白細胞進行磁性標記,通過外加磁場去除白細胞,從而可以不依賴CTC表面標記物,把CTC所有亞群、全部類型富集出來。CTC免疫磁珠陰性富集技術在分離出全部類型的CTC上具有技術優勢,同時由于不依賴于CTC表面標記物,預期可用于所有類型實體瘤的CTC富集。因此,開發不依賴于CTC表面標記物的分離方法是一個具有巨大前景的技術方向。另一方面,陰性富集策略的免疫磁珠法通過有效去除CD45+的白細胞或CD61+的巨噬細胞、血小板等外周血其他細胞而間接富集稀有上皮細胞,某種程度上克服了EMT導致的EpCAM陽性富集策略的缺陷。此外,通過陰性富集策略得到的循環腫瘤細胞還具有沒有經過任何標記、高細胞活性等優勢。綜上所述,現經報道的多種CTC分離方法雖然各自具有獨特的檢測優勢,但仍暴露出一些問題,如循環腫瘤細胞回收率不高(70%-80%)、不能獲得有活性的CTC、生物標記物選擇困難、分離技術復雜等。技術實現要素:本發明所要解決的技術問題是:提供一種循環腫瘤細胞陰性富集方法,解決現有循環腫瘤細胞分離方法存在的循環腫瘤細胞回收率不高、不能獲得有活性的循環腫瘤細胞,生物標記物選擇困難、分離技術復雜的問題。為了解決上述技術問題,本發明采用的技術方案為:一種循環腫瘤細胞陰性富集方法,包括以下步驟:S1:將密度梯度分離液(Ficollpagueplus,GEHealth)和腫瘤患者血樣在淋巴細胞分離管中混合,加入洗滌緩沖液,進行第一次離心;S2:將經過第一次離心的淋巴細胞分離管中擋板上層溶液轉移至第一離心管中,進行第二次離心,吸去上清,加入紅細胞裂解液,靜置;S3:將經過靜置后的第一離心管進行第三次離心,吸去上清,加入磁珠孵育緩沖液,再加入陰性富集免疫磁珠,混勻,孵育20-40min,所述陰性富集免疫磁珠結合有靶向白細胞表面廣譜標記物CD45;S4:將上述經過孵育后的第一離心管放置在磁力架上靜置,將上清液全部轉移至第二離心管中,用洗滌緩沖液沖洗第二離心管;S5:將上述第二離心管進行第四次離心,吸去第二離心管上清液,在第二離心管中加入細胞固定液重懸后涂于載玻片上,過夜干燥,得到干燥的循環腫瘤細胞。本發明的有益效果在于:本發明公開的循環腫瘤細胞陰性富集方法,采用淋巴細胞分離管基礎上的密度梯度離心對血樣進行前處理,簡化了白細胞分離操作步驟,縮短了循環腫瘤細胞的富集時間,整個操作在2.5h內即可完成;經處理后留下的白細胞數量相當于血樣原始白細胞數量的30-50%,對留下的白細胞采用自制陰性富集免疫磁珠CD45標記白細胞并去除,減少了免疫磁珠的用量,大大節約了循環腫瘤細胞陰性富集的成本;本發明采用淋巴細胞分離管對血樣進行前處理,并對循環腫瘤細胞陰性富集方法進行改良,有效提高了富集操作穩定性,循環腫瘤細胞的回收率達到85%以上;本發明還具有高靈敏度的優點,可以在數量極少的樣品中穩定檢出循環腫瘤細胞。附圖說明圖1為本發明具體實施方式的一種循環腫瘤細胞陰性富集方法與傳統密度梯度離心法制得的循環腫瘤細胞的富集回收率柱狀圖;圖2為本發明具體實施方式的一種循環腫瘤細胞陰性富集方法對不同類型腫瘤細胞的富集回收率柱狀圖;圖3為本發明具體實施方式的一種循環腫瘤細胞陰性富集方法富集的SKOV3細胞后免疫熒光鑒定結果圖;圖4為本發明具體實施方式的一種循環腫瘤細胞陰性富集方法對不同數量NCI-H226循環腫瘤細胞的平均回收率柱狀圖;圖5為本發明具體實施方式的一種循環腫瘤細胞陰性富集方法對不同數量NCI-H226循環腫瘤細胞的回收率線性回歸圖。具體實施方式為詳細說明本發明的技術內容、所實現目的及效果,以下結合實施方式并配合附圖予以說明。本發明涉及的縮略語和關鍵術語定義:CTC:循環腫瘤細胞;CD45:白細胞表面共同抗原;CK-FITC:異硫氰酸熒光素偶聯細胞角蛋白抗體;CD45-PE:藻紅蛋白蛋白偶聯CD45抗體;DAPI:4',6-二脒基-2-苯基吲哚。本發明最關鍵的構思在于:采用淋巴細胞分離管基礎上的密度梯度離心對血樣進行前處理,簡化了白細胞分離操作步驟,縮短了循環腫瘤細胞的富集時間,對留下的白細胞采用自制陰性富集免疫磁珠CD45標記白細胞并去除,減少了免疫磁珠的用量,大大節約了循環腫瘤細胞陰性富集的成本。一種循環腫瘤細胞陰性富集方法,包括以下步驟:S1:將密度梯度分離液(Ficollpagueplus,GEHealth)和腫瘤患者血樣在淋巴細胞分離管中混合,加入洗滌緩沖液,進行第一次離心;S2:將經過第一次離心的淋巴細胞分離管中擋板上層溶液轉移至第一離心管中,進行第二次離心,吸去上清,加入紅細胞裂解液,靜置;S3:將經過靜置后的第一離心管進行第三次離心,吸去上清,加入磁珠孵育緩沖液,再加入陰性富集免疫磁珠,混勻,孵育20-40min,所述陰性富集免疫磁珠結合有靶向白細胞表面廣譜標記物CD45;S4:將上述經過孵育后的第一離心管放置在磁力架上靜置,將上清液全部轉移至第二離心管中,用洗滌緩沖液沖洗第二離心管;S5:將上述第二離心管進行第四次離心,吸去第二離心管上清液,在第二離心管中加入細胞固定液重懸后涂于載玻片上,過夜干燥,得到干燥的循環腫瘤細胞。本發明的循環腫瘤細胞陰性富集原理:本發明公開了一種循環腫瘤細胞的檢測方法,主要步驟包括利用密度梯度離心去除紅細胞及大量中性粒細胞,通過紅細胞裂解,進一步去除殘余紅細胞,將得到的白細胞與自制陰性富集免疫磁珠(靶向白細胞表面廣譜標記物CD45)進行孵育,經磁場吸附去除白細胞,收集未與磁珠結合的上清部分,離心后涂片,空氣干燥制片,制得干燥的循環腫瘤細胞。上述循環腫瘤細胞陰性富集方法,采用淋巴細胞分離管基礎上的密度梯度離心對血樣進行前處理,簡化了白細胞分離操作步驟,縮短了循環腫瘤細胞的富集時間,整個操作在2.5h內即可完成;留下的白細胞數量相當于血樣原始白細胞數量的30-50%,對留下的白細胞采用自制陰性富集免疫磁珠CD45標記白細胞并去除,減少了免疫磁珠的用量,大大節約了循環腫瘤細胞陰性富集的成本;本發明采用淋巴細胞分離管對血樣進行前處理,并對循環腫瘤細胞陰性富集方法進行改良,有效提高了富集操作穩定性,循環腫瘤細胞的回收率達到85%以上;本發明還具有高靈敏度的優點,可以在數量極少的樣品中穩定檢出循環腫瘤細胞。進一步的,所述S1具體為:在淋巴細胞分離管中加入密度梯度分離液,瞬時離心使密度梯度分離液全部離心到管底;在裝有密度梯度分離液的淋巴細胞分離管中加入3mL的腫瘤患者血樣,并加入大于3mL的洗滌緩沖液,進行第一次離心,所述第一次離心的條件為25℃、800g/15min。進一步的,所述S2具體為:將上述經過第一次離心的淋巴細胞分離管中擋板上層溶液轉移至第一離心管中,進行第二次離心,所述第二次離心的條件為25℃、300g/10min,吸去上清,加入5mL的紅細胞裂解液,靜置5min。進一步的,所述S3具體為:將經過靜置后的第一離心管進行第三次離心,所述第三次離心的條件為25℃、300g/10min,吸去上清,加入5mL磁珠孵育緩沖液,再加入200uL陰性富集免疫磁珠,吹打混勻,于4℃低速垂直混勻,孵育30min,所述陰性富集免疫磁珠結合有靶向白細胞表面廣譜標記物CD45。進一步的,所述S4具體為:將上述經過孵育后的第一離心管放置在磁力架上靜置5min,將上清液全部轉移至第二離心管中,用洗滌緩沖液沖洗第二離心管2次。進一步的,所述S5具體為:將上述第二離心管進行第四次離心,吸去上清液至剩余體積為100uL,在第二離心管中加入100uL細胞固定液,重懸后涂于載玻片上,25℃過夜干燥,得到干燥的循環腫瘤細胞,所述第四次離心的條件為25℃、600g/5min。進一步的,所述的循環腫瘤細胞陰性富集方法還包括步驟:S6:利用多色免疫熒光技術對干燥的循環腫瘤細胞進行鑒定并熒光計數。進一步的,所述多色免疫熒光技術采用的染料為CK-FITC、CD45-PE或DAPI。對比實施例1在健康人外周血中摻入一定數量的SiHa細胞,以模擬宮頸癌患者含有循環腫瘤細胞血樣,按比例稀釋得到2×104的細胞懸液,并在熒光顯微鏡下精確計數并調整至100個/5uL,將計數后細胞懸液摻入3mL外周血,分別制得含有100個SiHa細胞/3mL的外周血樣,以上述血樣作為腫瘤患者血樣,分別按照以下三種血液前處理方案(A、紅細胞裂解;B、密度梯度離心;C、紅細胞裂解+密度梯度離心)處理后,分別按照實施例1的步驟進行循環腫瘤細胞陰性富集;對紅細胞去除效率、白細胞去除效率進行評價。不同血液前處理方案紅細胞去除效率、白細胞去除效率如表1所示。表1.不同血液前處理方案的紅細胞去除效率、白細胞去除效率血液前處理方案紅細胞去除效率白細胞去除效率紅細胞裂解~98~99.5%>99.5%密度梯度離心>99.5%~99.7-99.9%紅細胞裂解+密度梯度離心>99.99%~99.7-99.9%由表1看出,采用紅細胞裂解+密度梯度離心的前處理方式,紅細胞去除效率和白細胞去除效率最高。實施例1一種循環腫瘤細胞陰性富集方法,包括以下步驟:S1:在淋巴細胞分離管中加入密度梯度分離液,瞬時離心使密度梯度分離液全部離心到管底;在裝有密度梯度分離液的淋巴細胞分離管中加入3mL的腫瘤患者血樣,并加入大于3mL的洗滌緩沖液,進行第一次離心,所述第一次離心的條件為25℃、800g/15min;S2:將上述經過第一次離心的淋巴細胞分離管中擋板上層溶液轉移至第一離心管中,進行第二次離心,所述第二次離心的條件為25℃、300g/10min,吸去上清,加入5mL的紅細胞裂解液,靜置5min;S3:將經過靜置后的第一離心管進行第三次離心,所述第三次離心的條件為25℃、300g/10min,吸去上清,加入5mL磁珠孵育緩沖液,再加入200uL陰性富集免疫磁珠,吹打混勻,于4℃低速垂直混勻,孵育30min,所述陰性富集免疫磁珠結合有靶向白細胞表面廣譜標記物CD45;S4:將上述經過孵育后的第一離心管放置在磁力架上靜置5min,將上清液全部轉移至第二離心管中,用洗滌緩沖液沖洗第二離心管2次;S5:將上述第二離心管進行第四次離心,吸去上清液至剩余體積為100uL,在第二離心管中加入100uL細胞固定液重懸后涂于載玻片上,25℃過夜干燥,得到干燥的循環腫瘤細胞,所述第四次離心的條件為25℃、600g/5min;S6:利用多色免疫熒光技術對干燥的循環腫瘤細胞進行鑒定并熒光計數,所述多色免疫熒光技術采用的染料為CK-FITC、CD45-PE或DAPI。實施例2請參照圖1,在健康人外周血中摻入一定數量的SiHa細胞,以模擬宮頸癌患者含有循環腫瘤細胞血樣,并評價所建立循環腫瘤細胞陰性富集方法對循環腫瘤細胞的富集效率,具體監測步驟如下:1、將培養并消化收獲的SiHa細胞用CelltrackerGreen進行綠色熒光預先標記,按比例稀釋得到2×104的細胞懸液,并在熒光顯微鏡下精確計數并調整至100個/5uL;2、將計數后細胞懸液摻入3mL外周血,分別制得含有100個SiHa細胞/3mL的外周血樣本;3、對含有100個SiHa細胞/3mL的外周血樣本分別按照以下兩種方案分別進行循環腫瘤細胞陰性富集;A、傳統密度梯度離心法;B、淋巴細胞分離管密度梯度離心(改進方案)4、采用實施例1的循環腫瘤陰性富集方法富集并檢測外周血樣本,并對循環腫瘤細胞陰性富集方法的富集效率進行評價。從圖1看出,采用淋巴細胞分離管密度梯度離心結合循環腫瘤陰性富集方法得到SiHa細胞的回收率達到89%,顯著高于傳統密度梯度離心法得到SiHa細胞的回收率76%。實施例3請參照圖2及圖3,在健康人外周血中摻入一定數量的卵巢癌SKOV-3、宮頸癌SiHa細胞、乳腺癌SKBR3細胞,評價本方案涉及的循環腫瘤細胞陰性富集方法是否適用于不同腫瘤類型的循環腫瘤細胞檢測,具體檢測步驟如下:1、在本實施例中以100個卵巢癌SKOV-3、宮頸癌SiHa細胞、乳腺癌SKBR3細胞摻入健康人外周血的方法,以模擬不同腫瘤患者含有循環腫瘤細胞血樣,將培養并消化收獲的不同腫瘤類型細胞用CelltrackerGreen進行綠色熒光預先標記,按比例稀釋得到不同濃度的細胞懸液,并在熒光顯微鏡下精確計數。2、將計數后細胞懸液摻入3mL外周血,制得100個不同類型腫瘤細胞/3mL的外周血樣本。3、采用實施例1的循環腫瘤陰性富集方法富集并檢測外周血樣本。從圖2看出,采用本發明涉及的循環腫瘤陰性富集方法對不同類型腫瘤細胞的富集回收率均在85%以上。實施例4請參照圖4,在健康人外周血中摻入不同數量NCI-H226細胞,以其為血樣,采用實施例1的循環腫瘤細胞富集方法評價循環腫瘤細胞富集效率,具體檢測步驟如下:1、在本實施例中以非小細胞肺癌NCI-H226細胞摻入健康人外周血的方法,以模擬肺癌患者含有循環腫瘤細胞血樣。將培養并消化收獲的NCI-H226細胞用CelltrackerGreen進行綠色熒光預先標記,按比例稀釋得到不同濃度的細胞懸液,并在熒光顯微鏡下精確計數。2.將計數后細胞懸液摻入3ml外周血,分別制得含有6、9、15、30、90、300個NCI-H226細胞/3ml的外周血樣本。3.采用本發明所公開的循環腫瘤細胞陰性富集試劑盒,利用上述方法富集外周血樣本中的循環腫瘤細胞,空氣干燥制片后,對CellTracker+的綠色熒光細胞計數,對循環腫瘤細胞陰性富集方法的富集效率、靈敏度進行評價。從圖4看出,采用本發明涉及的循環腫瘤細胞陰性富集方法對不用數量的NCI-H226細胞的外周血樣本進行循環腫瘤細胞富集的回收率均達到較高的水平,其中,含有9、15、30個NCI-H226細胞/3ml的外周血樣本的平均回收率均在85%以上,從圖5看出,不同數量循環腫瘤細胞整體富集的整體回收率為77.66%,說明本發明涉及的循環腫瘤細胞富集方法具有較高的靈敏度。綜上所述,本發明提供的循環腫瘤細胞陰性富集方法,采用淋巴細胞分離管基礎上的密度梯度離心對血樣進行前處理,簡化了白細胞分離操作步驟,縮短了循環腫瘤細胞的富集時間,整個操作在2.5h內即可完成;留下的白細胞數量相當于血樣原始白細胞數量的30-50%,對留下的白細胞采用自制陰性富集免疫磁珠CD45標記白細胞并去除,減少了免疫磁珠的用量,大大節約了循環腫瘤細胞陰性富集的成本;本發明采用淋巴細胞分離管對血樣進行前處理,并對循環腫瘤細胞陰性富集方法進行改良,有效提高了富集操作穩定性,循環腫瘤細胞的回收率達到85%以上;本發明還具有高靈敏度的優點,可以在數量極少的樣品中穩定檢出循環腫瘤細胞。以上所述僅為本發明的實施例,并非因此限制本發明的專利范圍,凡是利用本發明說明書及附圖內容所作的等同變換,或直接或間接運用在相關的
技術領域:
,均同理包括在本發明的專利保護范圍內。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1