PRRSV誘導RAW264.7細胞氧化脅迫模型的建立方法與流程
本發明屬于病毒誘導免疫細胞氧化脅迫模型技術領域,尤其涉及一種PRRSV誘導RAW264.7細胞氧化脅迫模型的建立方法。
背景技術:
氧化應激是指細胞內氧化和抗氧化系統失衡,導致活性氧(ROS)自由基產生速率大于清除速率,從而引起細胞和組織損傷的一種病理狀態。氧化損傷主要包括生物膜脂質過氧化、細胞內蛋白及酶變性、DNA損害,最后導致細胞死亡或凋亡,并引發疾病。病毒感染是導致多種疾病的直接原因,并與氧化損傷密切相關;一方面,病毒感染引起ROS釋放;另一方面,感染使吞噬細胞活化并釋放如TNF和IL-1等前氧化性細胞因子。機體通過維持氧化物和抗氧化物平衡來保持正常狀態,而病毒可以影響細胞內抗氧化系統,如谷胱甘肽(GSH)水平和誘生型一氧化氮合酶(MOS)活性,增加細胞的前氧化物如NO,從而引起細胞凋亡。
豬繁殖與呼吸綜合征病毒(PRRSV)是豬繁殖與呼吸綜合征的主要病原,能感染誘發機體免疫抑制,造成免疫失敗、繼發感染及其他疾病,給世界養豬業造成巨大經濟損失。
技術實現要素:
:
本發明要解決的技術問題是提供一種PRRSV誘導RAW264.7細胞氧化脅迫模型的建立方法,為后續深入研究PRRSV的感染機制和開發應用于PRRSV感染的制劑提供技術平臺和理論參考。
為解決上述技術問題,本發明采用以下技術方案:PRRSV誘導RAW264.7細胞氧化脅迫模型的建立方法,采用PRRSV體外處理RAW264.7細胞,病毒濃度為TCID50是10-5.5/0.1mL的PRRSV病毒原液的100-10-4,感染時間為4-48h。
所述病毒濃度為TCID50是10-5.5/0.1mL的PRRSV病毒原液的10-2,感染時間為4h。
上述PRRSV誘導RAW264.7細胞氧化脅迫模型的建立方法,包括以下步驟:
設細胞對照組和病毒組,調節細胞濃度為5×106個/mL,按500μL/孔加至24孔板內,對照組加500μL培養液,實驗組分別加入500μL病毒液,置于37℃,5%CO2培養44h后每孔棄去10μL上清液,加入10μL MTT(5mg/mL),繼續孵育4h后離心并棄掉上清液,每孔加入100μL DMSO,搖勻使顆粒溶解后靜置10min,用酶標儀測定490nm波長處吸光度值;
分別收集細胞上清液或細胞,用于測定表征氧化脅迫模型的相關指標。
病毒組中病毒濃度為TCID50是10-5.5/0.1mL的PRRSV病毒原液的100、10-1、10-2、10-3、10-4。
PRRSV病毒與細胞吸附時間為2h。
收集細胞上清液或細胞在培養后第4h、8h、12h、24h、48h。
相關指標包括NO、ROS、GSH、GSSG、XOD、MPO和iNOS。
為研究PRRSV體外處理RAW264.7細胞與細胞氧化應激之間的關系,發明人以RAW264.7細胞為研究對象,建立了一種PRRSV誘導RAW264.7細胞氧化脅迫模型的建立方法,采用PRRSV體外處理RAW264.7細胞,病毒濃度為TCID50是10-5.5/0.1mL的PRRSV病毒原液的100-10-4,培養時間為4-48h。應用本發明,利用不同濃度PRRSV作用不同時間,通過檢測細胞存活率,NO釋放,細胞內ROS水平,GSH和GSSG含量,XOD、MPO和iNOS活性等指標,可以確定建立PRRSV體外誘導RAW264.7細胞氧化脅迫模型的最佳條件,為闡明PRRSV體外誘導RAW264.7細胞氧化應激與免疫抑制之間的關系和疾病的發生發展機制提供了有力的理論依據,也為后續深入研究PRRSV的感染機制和開發應用于PRRSV感染的制劑提供技術平臺和理論參考。
附圖說明
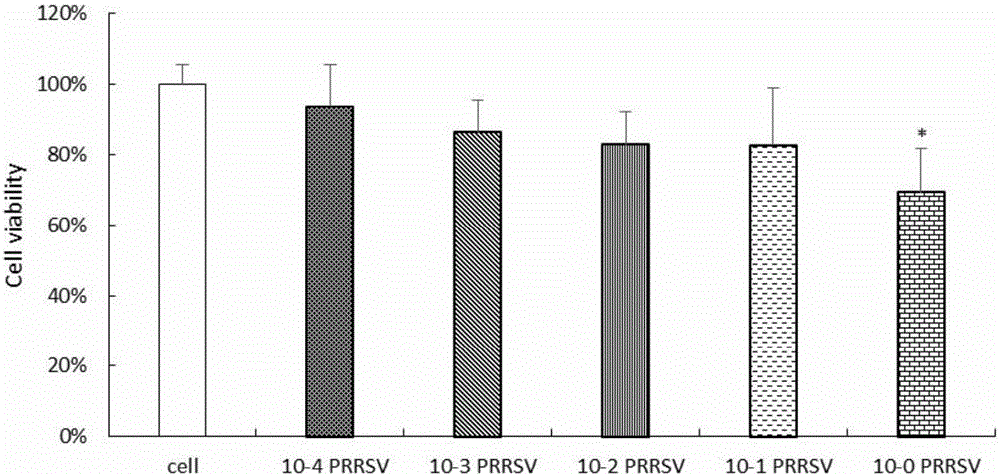
圖1是PRRSV對RAW264.7細胞存活率的影響圖。
圖2是PRRSV體外處理RAW264.7細胞對NO分泌的影響圖。
圖3是PRRSV體外處理對RAW264.7細胞內ROS水平的影響圖。
圖4是PRRSV體外處理對RAW264.7細胞內GSH含量的影響圖。
圖5是PRRSV體外處理對RAW264.7細胞內GSSG含量的影響圖。
圖6是PRRSV體外處理對RAW264.7細胞內GSH/GSSG的影響圖。
圖7是PRRSV體外處理對RAW264.7細胞內XOD活力的影響圖。
圖8是PRRSV體外處理對RAW264.7細胞內MPO活力的影響圖。
圖9是PRRSV體外處理對RAW264.7細胞內iNOS活力的影響圖。
具體實施方式
一、研究思路
本發明通過PRRSV體外處理RAW264.7細胞,測定細胞分泌一氧化氮(NO)的水平、細胞內總活性氧(ROS)水平、還原型谷胱甘肽(GSH)含量、氧化型谷胱甘肽(GSSG)含量、黃嘌呤氧化酶(XOD)活性、髓過氧化物酶(MPO)活性、誘生型一氧化氮合酶(iNOS)活性,探討PRRSV體外誘導RAW264.7細胞氧化應激與免疫抑制之間的關系,建立RAW264.7細胞氧化脅迫體外模型。
二、實驗方法
(1)設置細胞對照組和5個不同梯度病毒組(100、10-1、10-2、10-3、10-4),調節細胞濃度為5×106個/mL,按500μL/孔加至24孔板內,對照組加500μL培養液,實驗組分別加入500μL不同濃度病毒液,使病毒終濃度分別為100、10-1、10-2、10-3、10-4,置于37℃,5%CO2培養44h后每孔棄去10μL上清液,加入10μL MTT(5mg/mL),繼續孵育4h后離心并棄掉上清液,每孔加入100μL DMSO,搖勻使顆粒溶解后靜置10min,用酶標儀測定490nm波長處吸光度值。其中,PRRSV病毒原液的TCID50為10-5.5/0.1mL。
(2)分別在培養后第4h、8h、12h、24h、48h分別收集細胞上清液或細胞,用于測定表征氧化脅迫模型的相關指標(肝臟丙二醛含量、谷胱甘肽含量、谷胱甘肽過氧化物酶活力、T-SOD、總抗氧化力);MTT法檢測細胞存活率,Griess法檢測NO水平,DCFH-DA熒光探針法檢測ROS水平,熒光光度法檢測GSH、GSSG水平,分光光度法檢測XOD、MPO、iNOS酶活力。
(3)所測得數據用SPSS 21.0統計軟件進行統計學處理。所有實驗結果以均數±標準差表示,采用單因素方差分析及Duncan多重比較進行統計學分析。以P<0.05表示為差異顯著,P<0.01為差異極顯著,P>0.05為差異不顯著。
三、實驗結果
1.PRRSV體外處理對RAW264.7細胞存活率的影響
結果如圖1所示,不同稀釋度PRRSV體外處理RAW264.7細胞,隨著病毒濃度升高,細胞存活率逐漸下降,其中病毒原液的抑制作用最為明顯,與對照組比較差異顯著(P<0.05)。而10-4~10-1稀釋度病毒液體外感染的細胞存活率較大,分別為93.7%、86.3%、82.9%和82.7%,適用于造模的后續試驗。
2.PRRSV體外處理RAW264.7細胞對NO分泌的影響
NO分泌結果如圖2所示,PRRSV體外感染RAW264.7細胞引起細胞NO分泌增加,且隨著作用時間增加逐漸升高。與對照組相比,10-2稀釋度病毒液體外處理RAW264.7細胞8h、12h、24h均能極顯著升高細胞NO的分泌(P<0.01),48h能顯著升高(P<0.05);10-4稀釋度病毒液體外感染RAW264.7細胞8h和48h分別能極顯著(P<0.01)和顯著(P<0.05)升高細胞NO的分泌;10-3稀釋度病毒液體外感染8h能極顯著(P<0.01)細胞NO的分泌,12h和24h顯著升高;10-1稀釋度病毒液體外處理8h、24h和12h、48h分別能極顯著(P<0.01)和顯著(P<0.05)升高細胞NO的分泌;病毒原液體外感染8h和48h能極顯著(P<0.01)細胞NO的分泌。
3.PRRSV體外處理對RAW264.7細胞內ROS水平的影響
細胞內活性氧水平如圖3所示,PRRSV體外處理RAW264.7細胞能升高細胞內ROS水平,一定范圍內隨著作用時間的延長,ROS水平逐漸降低,但始終高于對照組。與對照組相比,10-2稀釋度病毒液體外感染4h、12h和8h、24h分別能顯著(P<0.05)和極顯著(P<0.01)升高細胞內ROS水平;10-4稀釋度病毒液體外感染RAW264.7細胞4h和24h能顯著升高細胞內ROS水平(P<0.05);10-3稀釋度病毒液體外感染8h能極顯著升高細胞內ROS水平(P<0.01);10-1稀釋度病毒液體外感染8h能極顯著升高細胞內ROS水平(P<0.01);病毒原液體外感染8h和4h、24h分別能極顯著(P<0.01)和顯著(P<0.05)升高細胞內ROS水平。
4.PRRSV體外處理對RAW264.7細胞內GSH和GSSG含量的影響
細胞內還原型谷胱甘肽含量如圖4所示,與對照組相比,不同稀釋度PRRSV體外處理RAW264.7細胞4h和24h均能極顯著升高細胞內GSH含量(P<0.01);其中10-2稀釋度病毒液感染8h和12h均能極顯著升高細胞內GSH含量(P<0.01);10-3稀釋度病毒液感染48h能極顯著升高細胞內GSH含量(P<0.01)。
細胞內氧化型谷胱甘肽含量如圖5所示,PRRSV體外處理RAW264.7細胞能升高細胞內GSSG含量。與對照組相比,10-2稀釋度病毒液體外處理4h、12h和24h均能顯著升高細胞內GSSG含量(P<0.05);10-1稀釋度病毒液體外處理8h、12h和48h均能極顯著升高細胞內GSSG含量(P<0.01);病毒原液體外處理48h能極顯著升高細胞內GSSG含量(P<0.01)。
細胞內氧化還原狀態如圖6所示,PRRSV體外處理RAW264.7細胞能降低細胞內GSH/GSSG比值,且隨著作用時間的增加呈先降低后上升的趨勢。與對照組相比,不同稀釋度PRRSV體外處理RAW264.7細胞4h均能極顯著降低細胞內GSH/GSSG比值(P<0.01);其中10-2稀釋度病毒液感染24h和48h均能顯著降低細胞內GSH/GSSG比值(P<0.05);10-1稀釋度病毒液和病毒原液體外感染細胞8h、48h均能顯著降低細胞內GSH/GSSG比值(P<0.05)。
5.PRRSV體外處理對RAW264.7細胞內XOD、MPO和iNOS活力的影響
XOD活力如圖7所示,PRRSV體外處理RAW264.7細胞能升高細胞內黃嘌呤氧化酶活力,且與病毒濃度呈一定的濃度依賴性。其中與對照組相比,10-2稀釋度病毒液在培養各個時間段均能顯著升高細胞內XOD活力(P<0.05);10-3稀釋度病毒液在感染4h、8h和24h均能顯著升高細胞內XOD活力(P<0.05);10-4稀釋度病毒液在培養24h時能顯著升高細胞內XOD活力(P<0.05)。
MPO活力如圖8所示,PRRSV體外處理RAW264.7細胞能升高細胞內髓過氧化物酶活力,且與病毒濃度呈一定的濃度依賴性。其中與對照組相比,10-2稀釋度病毒液處理4h能極顯著升高細胞內MPO活力(P<0.01),處理8h、12h能顯著升高細胞內MPO活力(P<0.05);處理4h,10-1稀釋度病毒液和病毒原液聚能顯著升高細胞內MPO活力(P<0.05)。
iNOS活力如圖9所示,PRRSV體外處理RAW264.7細胞能升高細胞內誘生型一氧化氮合酶活力,且隨培養時間的增加呈上升趨勢,培養8h時達到峰值,當培養24h時,iNOS活力降至最低值。其中與對照組相比,培養4h時,各稀釋度病毒液均能極顯著升高細胞內iNOS活力(P<0.01);處理8h,10-2、10-1稀釋度病毒液分別能極顯著(P<0.01)和顯著(P<0.05)升高細胞內iNOS活力。
四、研究結論
從實驗結果可知,隨著病毒濃度的增加及作用時間延長,RAW264.7細胞存活率下降,NO分泌水平和細胞內XOD、MPO、iNOS活力逐漸升高,細胞內GSH和GSSG含量逐漸增加,GSH/GSSG比值和ROS水平逐漸下降。其中,在10-2PRRSV體外處理RAW264.7細胞4h條件下,細胞分泌的NO含量極顯著高于對照組(P<0.01),細胞內活性氧水平、GSSG含量、MPO活力和iNOS活力均極顯著高于對照組(P<0.01),GSH/GSSG比值顯著低于對照組(P<0.05),細胞內XOD活力顯著高于對照組(P<0.05),且該條件下細胞有較高存活率(86.31%)。因此,PRRSV體外能誘導RAW264.7細胞產生氧化應激,選擇10-2PRRSV體外處理RAW264.7細胞4h是建立RAW264.7細胞氧化脅迫模型的最佳條件。
- 還沒有人留言評論。精彩留言會獲得點贊!