作為轉染重排(RET)抑制劑的新化合物的制作方法
發明領域
本發明涉及轉染重排(rearrangedduringtransfection,ret)激酶的抑制劑的新化合物、含有其的藥物組合物、其制備方法及其單獨或組合在治療中用途,用于胃腸道敏感性、運動性和/或分泌作用的正常化、和/或腹部病況或疾病、和/或與ret功能障礙有關的或其中調節ret活性可能具有治療益處的下述疾病的治療:包括但不限于全部類型的腸易激綜合征(ibs),包括腹瀉主導型、便秘主導型或交替排便模式、功能性胃氣脹、功能性便秘、功能性腹瀉、非特異性功能性腸病、功能性腹痛綜合征、慢性特發性便秘、功能性食管病、功能性胃十二指腸病、功能性肛門直腸疼痛、炎性腸病,增殖性疾病例如非小細胞肺癌、肝細胞癌、結腸直腸癌、髓樣甲狀腺癌、濾泡性甲狀腺癌、未分化甲狀腺癌、乳頭狀甲狀腺癌、腦瘤、腹膜腔癌、實體瘤、其它肺癌、頭頸癌、神經膠質瘤、神經母細胞瘤、vonhipple-lindau綜合征和腎腫瘤、乳腺癌、輸卵管癌、卵巢癌、過渡型細胞癌、前列腺癌、食道和食管胃連接處的癌癥、膽道癌和腺癌、及帶有增加的ret激酶活性的任何惡性腫瘤。
發明背景
腸易激綜合征(ibs)是一種常見的疾病,在發達國家中影響10,1或20%的個體,并且其特征為異常腸排便習慣、胃氣脹和內臟超敏反應(camilleri,m.,n.engl.j.med.,2012,367:1626-1635)。雖然ibs的病因不明,但拒信是由腦和胃腸道之間的病癥、腸微生物的干擾或增加的炎癥所導致的。所導致的胃腸道變化會影響正常的腸道輸送,從而造成腹瀉或便秘。此外,在大多數ibs患者中,外周神經系統的敏化導致內臟超敏反應或異常性疼痛(keszthelyi,d.,eur.j.pain,2012,16:1444-1454)。
雖然ibs并不直接改變預期壽命,但其對患者的生活質量有很大的影響。而且,針對ibs相關的健康護理以及由于工作者缺勤導致的生產力損失會存在顯著的經濟成本(nellesen,d.,etal.,j.manag.carepharm.,2013,19:755-764)。極大影響ibs患者生活質量的最重要的癥狀之一是內臟痛(spiegel,b.,etal.,am.j.gastroenterol.,2008,103:2536-2543)。抑制ibs相關的內臟痛的分子策略將極大影響ibs患者的生活質量并降低相關花費。
轉染重排(ret)是一種神經生長因子受體酪氨酸激酶,其在與分別與共受體神經營養因子(gdnf)家族受體α-1、2、3和4組合的四種神經營養因子(神經膠質細胞系衍生的神經營養因子、neurturin、artemin和persephin)之一結合后被活化(plaza-menacho,i.,etal.,trendsgenet.,2006,22:627-636)。已知ret在皮膚和腸的傳入疼痛感受器的發育和存活中起重要作用。ret激酶敲除的小鼠缺少腸神經元,并具有其他神經系統異常,表明在發育過程中需要功能性ret激酶蛋白產物(taraviras,s.etal.,development,1999,126:2785-2797)。而且,對患有特征為因缺乏正常結腸削弱作用(enervation)導致的結腸梗阻的hirschsprung病的患者群研究具有較高比例的家族性和偶發性功能性ret突變喪失(butlertjadenn.,etal.,transl.res.,2013,162:1-15)。
類似地,異常ret激酶活性與多發性內分泌瘤(men2a和2b)、家族性髓樣甲狀腺癌(fmtc)、乳頭狀甲狀腺癌(ptc)和hirschsprung病(hscr)有關(borello,m.,etal.,expertopin.ther.targets,2013,17:403-419)。men2a是一種由ret胞外富含半胱氨酸結構域中突變經二硫鍵導致二聚化(其造成酪氨酸激酶活性的組成性激活)導致的癌癥綜合征(wellsjr,s.,etal.,j.clin.endocrinol.metab.,2013,98:3149-3164)。具有該突變的個體可能會發展髓樣甲狀腺癌(mtc)、甲狀旁腺增生和嗜鉻細胞瘤。men2b是由于ret上的met918thr突變導致的,其改變了酪氨酸激酶的特異性。men2b與men2a類似,但缺乏甲狀旁腺增生,且還會導致嘴唇、舌頭和腸道的許多粘膜神經節的發育。連接啟動子和nh2末端結構域或與ret激酶cooh末端不相關的基因從而形成組成性活化的嵌合形式的受體(ret/ptc)的染色體重排被認為是ptc中的腫瘤引發事件(viglietto,g.etal.,oncogene,1995,11:1207-1210)。ptc涵蓋所有甲狀腺癌的約80%。這些數據表明,抑制ret可能是用于治療與ibs和其他胃腸病癥相關的疼痛以及用于治療具有組成性ret激酶活性的癌癥的有吸引力的治療策略。
發明簡述
本發明涉及根據式(i)的化合物或其藥學上可接受鹽∶
其中:
x為n或cr5;
y為鍵或-o-;
z1、z2、z3和z4各自獨立地為n、ch或cr6;
r1為氫、(c1-c6)烷基、鹵代(c1-c6)烷基或(c3-c6)環烷基;
r2和r3各自獨立地選自氫、鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、羥基、(c1-c6)烷氧基、鹵代(c1-c6)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c6)烷基)氨基-和((c1-c6)烷基)((c1-c6)烷基)氨基-;其中所述(c1-c6)烷基、(c3-c6)環烷基、(c1-c6)烷氧基或(c3-c6)環烷氧基任選地被羥基、(c1-c6)烷氧基、鹵代(c1-c6)烷氧基或(c3-c6)環烷氧基取代;
r4為苯基或5-或6-元雜芳基,其各自任選地被一個、兩個或三個獨立地選自下述的取代基取代:鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、苯基、5-或6-元雜芳基、羥基、-or7、-conr8r9、-so2r7和-so2nr8r9;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基、-nr8r9或-conr8r9取代;且其中所述5-或6-元雜芳基取代基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
r5為氫、鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、羥基、(c1-c6)烷氧基、鹵代(c1-c6)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c6)烷基)氨基-或((c1-c6)烷基)((c1-c6)烷基)氨基-;其中所述(c1-c6)烷基、(c3-c6)環烷基、(c1-c6)烷氧基或(c3-c6)環烷氧基任選地被羥基、(c1-c6)烷氧基、鹵代(c1-c6)烷氧基或(c3-c6)環烷氧基取代;
或者r3和r5與它們連接的碳原子結合在一起表示5-或6-元環,任選地包含一個、兩個或三個獨立地選自氮、氧和硫的雜原子,其中所述環任選地被一個或兩個獨立地選自下述的取代基取代:鹵素、(c1-c4)烷基、鹵代(c1-c4)烷基、(c3-c6)環烷基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c4)烷基)氨基-和((c1-c4)烷基)((c1-c4)烷基)氨基;
每個r6獨立地選自鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、羥基、(c1-c6)烷氧基、鹵代(c1-c6)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c6)烷基)氨基-和((c1-c6)烷基)((c1-c6)烷基)氨基-;
r7為(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基或4-至6-元雜環烷基;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基或-nr8r9取代;且其中所述(c3-c6)環烷基任選地被一個或兩個獨立地選自下述的取代基取代:(c1-c4)烷基、鹵代(c1-c4)烷基、羥基、羥基(c1-c4)烷基、(c1-c4)烷氧基和鹵代(c1-c4)烷氧基;且其中所述4-至6-元雜環烷基任選地被一個或兩個獨立地選自(c1-c4)烷基和鹵代(c1-c4)烷基的取代基取代;和
r8和r9各自獨立地選自氫、(c1-c4)烷基、鹵代(c1-c4)烷基、氨基(c1-c4)烷基-、((c1-c4)烷基)氨基(c1-c4)烷基-和((c1-c4)烷基)((c1-c4)烷基)氨基(c1-c4)烷基-;
或者r8和r9與它們連接的氮結合在一起表示5-或6-元飽和的環,任選地含有選自氧、氮和硫的另外的雜原子,其中所述環任選地被鹵素、(c1-c4)烷基、鹵代(c1-c4)烷基或羥基(c1-c4)烷基取代;
條件是所述化合物不是1-(4-(5-羥基-1-氧代-1,2-二氫異喹啉-4-基)苯基)-3-苯基脲、1-(5-(叔丁基)異噁唑-3-基)-3-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)脲、1-(4-氯-3-(三氟甲基)苯基)-3-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)脲、1-(4-乙基苯基)-3-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)脲、1-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(對-甲苯基)脲、1-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(3-(三氟甲基)苯基)脲或1-(4-(叔丁基)苯基)-3-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)脲。
本發明還涉及包括式(i)的化合物和藥學上可接受賦形劑的藥物組合物。
本發明還涉及一種治療腸易激綜合征的方法,其包括向有需要的人給藥有效量的式(i)的化合物或其藥學上可接受鹽。本發明還涉及一種治療癌癥的方法,其包括向有需要的人給藥有效量的式(i)的化合物或其藥學上可接受鹽。
本發明還涉及式(i)的化合物,用于治療。本發明還涉及式(i)的化合物或其藥學上可接受鹽用于治療腸易激綜合征的用途。本發明還涉及式(i)的化合物或其藥學上可接受鹽用于治療癌癥的用途。
本發明還涉及式(i)的化合物或其藥學上可接受鹽在制備用于治療ret介導的疾病的藥物中的用途。本發明還涉及式(i)的化合物或其藥學上可接受鹽在制備用于治療腸易激綜合征的藥物中的用途。本發明還涉及式(i)的化合物或其藥學上可接受鹽在制備用于治療癌癥的藥物中的用途。
附圖簡述
圖1顯示化合物a游離堿無水物的x射線粉末衍射圖案。
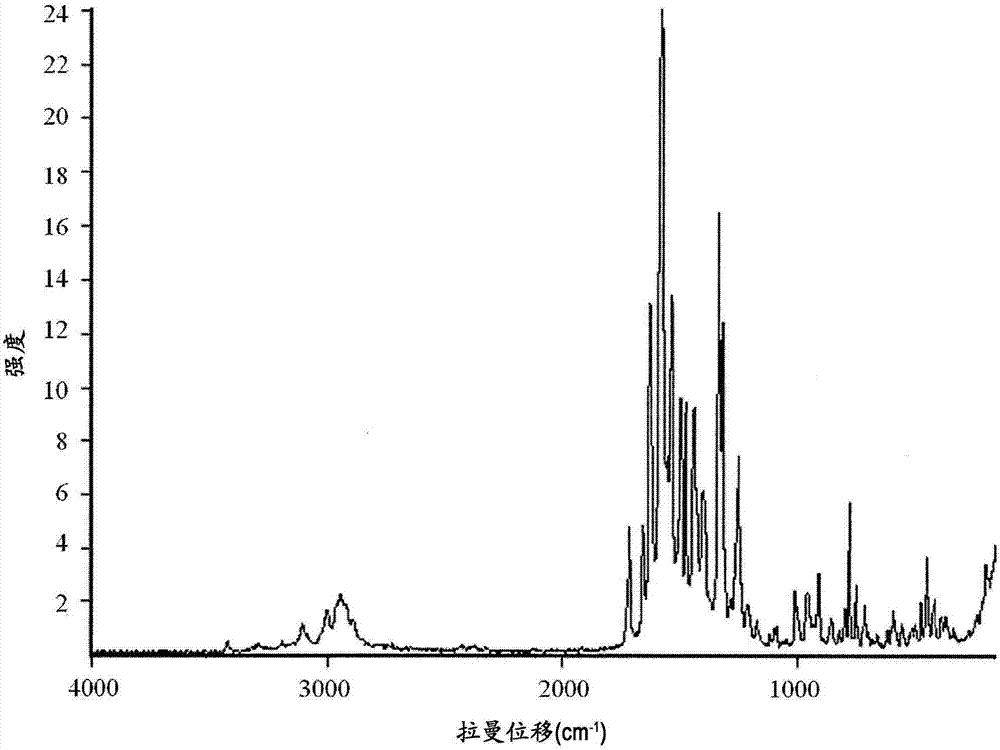
圖2顯示化合物a游離堿無水物的水合物1的拉曼光譜。
圖3顯示化合物a游離堿無水物的差示掃描量熱法跡線。
圖4顯示化合物a游離堿無水物的熱重量分析跡線。
圖5顯示化合物a游離堿水合物1的x射線粉末衍射圖案。
圖6顯示化合物a游離堿水合物1的拉曼光譜。
圖7顯示化合物a游離堿水合物1的差示掃描量熱法跡線。
圖8顯示化合物a游離堿水合物1的熱重量分析跡線。
圖9顯示化合物a游離堿水合物2的x射線粉末衍射圖案。
圖10顯示化合物a游離堿水合物2的拉曼光譜。
圖11顯示化合物a游離堿水合物2的差示掃描量熱法跡線。
圖12顯示化合物a游離堿水合物2的熱重量分析跡線。
圖13顯示化合物a游離堿水合物3的x射線粉末衍射圖案。
圖14顯示化合物a游離堿水合物3的拉曼光譜。
圖15顯示化合物a游離堿水合物3的差示掃描量熱法跡線。
圖16顯示化合物a游離堿水合物3的熱重量分析跡線。
圖17顯示化合物a游離堿水合物4的x射線粉末衍射圖案。
圖18顯示化合物a游離堿水合物4的拉曼光譜。
圖19顯示化合物a游離堿水合物4的差示掃描量熱法跡線。
圖20顯示化合物a游離堿水合物4的熱重量分析跡線。
圖21顯示化合物a游離堿水合物5的x射線粉末衍射圖案。
圖22顯示化合物a游離堿水合物5的拉曼光譜。
圖23顯示化合物a游離堿水合物5的差示掃描量熱法跡線。
圖24顯示化合物a游離堿水合物5的熱重量分析跡線。
圖25顯示化合物a鹽酸鹽無水物的x射線粉末衍射圖案。
圖26顯示化合物a鹽酸鹽無水物的拉曼光譜。
圖27顯示化合物a鹽酸鹽無水物的差示掃描量熱法跡線。
圖28顯示化合物a鹽酸鹽無水物的熱重量分析跡線。
圖29顯示化合物a鹽酸鹽水合物的x射線粉末衍射圖案。
圖30顯示化合物a鹽酸鹽水合物的拉曼光譜。
圖31顯示化合物a鹽酸鹽水合物的差示掃描量熱法跡線。
圖32顯示化合物a鹽酸鹽水合物的熱重量分析跡線。
圖33顯示化合物a乙磺酸鹽的x射線粉末衍射圖案。
圖34顯示化合物a乙磺酸鹽的拉曼光譜。
圖35顯示化合物a乙磺酸鹽的差示掃描量熱法跡線。
圖36顯示化合物a乙磺酸鹽的熱重量分析跡線。
圖37顯示化合物a硫酸鹽的x射線粉末衍射圖案。
圖38顯示化合物a硫酸鹽的拉曼光譜。
圖39顯示化合物a硫酸鹽的差示掃描量熱法跡線。
圖40顯示化合物a硫酸鹽的熱重量分析跡線。
發明詳述
本發明涉及如上定義的式(i)的化合物或其藥學上可接受鹽。本發明進一步涉及式(i)的化合物或其藥學上可接受鹽,其中∶
x為n或cr5;
y為鍵或-o-;
z1、z2、z3和z4各自獨立地為n、ch或cr6;
r1為氫、(c1-c6)烷基、鹵代(c1-c6)烷基或(c3-c6)環烷基;
r2和r3各自獨立地選自氫、鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、羥基、(c1-c6)烷氧基、鹵代(c1-c6)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c6)烷基)氨基-和((c1-c6)烷基)((c1-c6)烷基)氨基-;其中所述(c1-c6)烷基、(c3-c6)環烷基、(c1-c6)烷氧基或(c3-c6)環烷氧基任選地被羥基、(c1-c6)烷氧基、鹵代(c1-c6)烷氧基或(c3-c6)環烷氧基取代;
r4為苯基或5-或6-元雜芳基,其各自任選地被一個、兩個或三個獨立地選自下述的取代基取代:鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、苯基、5-或6-元雜芳基、羥基、-or7、-conr8r9、-so2r7和-so2nr8r9;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基、-nr8r9或-conr8r9取代;且其中所述5-或6--元雜芳基取代基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
r5為氫、鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、羥基、(c1-c6)烷氧基、鹵代(c1-c6)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c6)烷基)氨基-或((c1-c6)烷基)((c1-c6)烷基)氨基-;其中所述(c1-c6)烷基、(c3-c6)環烷基、(c1-c6)烷氧基或(c3-c6)環烷氧基任選地被羥基、(c1-c6)烷氧基、鹵代(c1-c6)烷氧基或(c3-c6)環烷氧基取代;
或者r3和r5與它們連接的碳原子結合在一起表示5-或6-元環,任選地包含一個、兩個或三個獨立地選自氮、氧和硫的雜原子,其中所述環任選地被一個或兩個獨立地選自下述的取代基取代:鹵素、(c1-c4)烷基、鹵代(c1-c4)烷基、(c3-c6)環烷基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c4)烷基)氨基-和((c1-c4)烷基)((c1-c4)烷基)氨基;
每個r6獨立地選自鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、羥基、(c1-c6)烷氧基、鹵代(c1-c6)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c6)烷基)氨基-和((c1-c6)烷基)((c1-c6)烷基)氨基-;
r7為(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基或4-至6-元雜環烷基;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基或-nr8r9取代;且其中所述(c3-c6)環烷基任選地被一個或兩個獨立地選自下述的取代基取代:(c1-c4)烷基、鹵代(c1-c4)烷基、羥基、羥基(c1-c4)烷基、(c1-c4)烷氧基和鹵代(c1-c4)烷氧基;和其中所述4-至6-元雜環烷基任選地被一個或兩個獨立地選自(c1-c4)烷基和鹵代(c1-c4)烷基的取代基取代;和
r8和r9各自獨立地選自氫、(c1-c4)烷基和鹵素(c1-c4)烷基;
或者r8和r9與它們連接的氮結合在一起表示5-或6-元飽和的環,任選地含有選自氧、氮和硫的另外的雜原子,其中所述環任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
條件是所述化合物不是1-(4-(5-羥基-1-氧代-1,2-二氫異喹啉-4-基)苯基)-3-苯基脲、1-(5-(叔丁基)異噁唑-3-基)-3-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)脲、1-(4-氯-3-(三氟甲基)苯基)-3-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)脲、1-(4-乙基苯基)-3-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)脲、1-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(對-甲苯基)脲、1-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(3-(三氟甲基)苯基)脲或1-(4-(叔丁基)苯基)-3-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)脲。
本發明還涉及式(ii)的化合物或其藥學上可接受鹽∶
其中x、z1、z2、z3、z4、r2、r3和r4為根據式(i)定義的,條件是所述化合物不是1-(4-(5-羥基-1-氧代-1,2-二氫異喹啉-4-基)苯基)-3-苯基脲。
本發明還涉及式(iii)的化合物或其藥學上可接受鹽∶
其中x、z1、z2、z3、z4、r2、r3和r4為根據式(i)定義的,條件是所述化合物不為1-(5-(叔丁基)異噁唑-3-基)-3-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)脲、1-(4-氯-3-(三氟甲基)苯基)-3-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)脲、1-(4-乙基苯基)-3-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)脲、1-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(對-甲苯基)脲、1-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(3-(三氟甲基)苯基)脲或1-(4-(叔丁基)苯基)-3-(4-((6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)脲。
本發明還涉及式(iv)的化合物或其藥學上可接受鹽∶
其中z1、z2、z3、z4、r2、r3、r4和r5為根據式(i)定義的,條件是所述化合物不是1-(4-(5-羥基-1-氧代-1,2-二氫異喹啉-4-基)苯基)-3-苯基脲。
本發明還涉及式(v)的化合物或其藥學上可接受鹽∶
其中r2、r3、r4、r5和r6為根據式(i)定義的。
本發明還涉及式(vi)的化合物或其藥學上可接受鹽∶
其中r2、r3、r4和r5為根據式(i)定義的,條件是所述化合物不是1-(4-(5-羥基-1-氧代-1,2-二氫異喹啉-4-基)苯基)-3-苯基脲。
本發明還涉及式(vii)的化合物或其藥學上可接受鹽∶
其中r2、r3、r4、r5和r6為根據式(i)定義的。
本發明還涉及式(viii)的化合物或其藥學上可接受鹽∶
其中r2、r3、r4、r5和r6為根據式(i)定義的。
本發明還涉及式(ix)的化合物或其藥學上可接受鹽∶
其中r2、r3、r4、r5和r6為根據式(i)定義的。
本發明還涉及式(x)的化合物或其藥學上可接受鹽∶
其中r2、r3、r4、r5和r6為根據式(i)定義的。
本發明還涉及式(xi)的化合物或其藥學上可接受鹽∶
其中x、z1、z2、z3、z4、r2和r3為根據式(i)定義的,和其中:
a為n或cr13;
r10為氫、鹵素或(c1-c4)烷氧基;
r11為氫、鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、5-或6-元雜芳基、羥基、-or7或-conr8r9;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基或-nr8r9取代;和其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
r12為氫、鹵素或鹵代(c1-c4)烷基;和
r13為氫、鹵素、鹵代(c1-c4)烷基或5-或6-元雜芳基,其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
條件是所述化合物不是1-(4-(5-羥基-1-氧代-1,2-二氫異喹啉-4-基)苯基)-3-苯基脲;
且條件是當a為cr13時,r10、r11、r12和r13中至少一個為氫。
本發明還涉及式(xii)的化合物或其藥學上可接受鹽∶
其中z1、z2、z3、z4、r2、r3和r5為根據式(i)定義的,和其中:
a為n或cr13;
r10為氫、鹵素或(c1-c4)烷氧基;
r11為氫、鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、5-或6-元雜芳基、羥基、-or7或-conr8r9;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基或-nr8r9取代;;和其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
r12為氫、鹵素或鹵代(c1-c4)烷基;和
r13為氫、鹵素、鹵代(c1-c4)烷基或5-或6-元雜芳基,其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
條件是所述化合物不是1-(4-(5-羥基-1-氧代-1,2-二氫異喹啉-4-基)苯基)-3-苯基脲;
且條件是當a為cr13時,r10、r11、r12和r13中至少一個為氫。
本發明還涉及式(xiii)的化合物或其藥學上可接受鹽∶
其中r2、r3、r4、r5和r6為根據式(i)定義的,和其中:
a為n或cr13;
r10為氫、鹵素或(c1-c4)烷氧基;
r11為氫、鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、5-或6-元雜芳基、羥基、-or7或-conr8r9;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基或-nr8r9取代;和其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
r12為氫、鹵素或鹵代(c1-c4)烷基;和
r13為氫、鹵素、鹵代(c1-c4)烷基或5-或6-元雜芳基,其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
且條件是當a為cr13時,r10、r11、r12和r13中至少一個為氫。
本發明還涉及式(xiv)的化合物或其藥學上可接受鹽∶
其中r2、r3、r4、r5和r6為根據式(i)定義的,和其中:
a為n或cr13;
r10為氫、鹵素或(c1-c4)烷氧基;
r11為氫、鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、5-或6-元雜芳基、羥基、-or7或-conr8r9;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基或-nr8r9取代;和其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
r12為氫、鹵素或鹵代(c1-c4)烷基;和
r13為氫、鹵素、鹵代(c1-c4)烷基或5-或6-元雜芳基,其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
條件是所述化合物不是1-(4-(5-羥基-1-氧代-1,2-二氫異喹啉-4-基)苯基)-3-苯基脲;
且條件是當a為cr13時,r10、r11、r12和r13中至少一個為氫。
本發明還涉及式(xv)的化合物或其藥學上可接受鹽∶
其中r2、r3、r4、r5和r6為根據式(i)定義的,和其中:
a為n或cr13;
r10為氫、鹵素或(c1-c4)烷氧基;
r11為氫、鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、5-或6-元雜芳基、羥基、-or7或-conr8r9;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基或-nr8r9取代;和其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
r12為氫、鹵素或鹵代(c1-c4)烷基;和
r13為氫、鹵素、鹵代(c1-c4)烷基或5-或6-元雜芳基,其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
且條件是當a為cr13時,r10、r11、r12和r13中至少一個為氫。
本發明還涉及式(xvi)的化合物或其藥學上可接受鹽∶
其中r2、r3、r4、r5和r6為根據式(i)定義的,和其中:
a為n或cr13;
r10為氫、鹵素或(c1-c4)烷氧基;
r11為氫、鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、5-或6-元雜芳基、羥基、-or7或-conr8r9;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基或-nr8r9取代;和其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
r12為氫、鹵素或鹵代(c1-c4)烷基;和
r13為氫、鹵素、鹵代(c1-c4)烷基或5-或6-元雜芳基,其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
且條件是當a為cr13時,r10、r11、r12和r13中至少一個為氫。
本發明還涉及式(xvii)的化合物或其藥學上可接受鹽∶
其中r2、r3、r4、r5和r6為根據式(i)定義的,和其中:
a為n或cr13;
r10為氫、鹵素或(c1-c4)烷氧基;
r11為氫、鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、5-或6-元雜芳基、羥基、-or7或-conr8r9;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基或-nr8r9取代;和其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
r12為氫、鹵素或鹵代(c1-c4)烷基;和
r13為氫、鹵素、鹵代(c1-c4)烷基或5-或6-元雜芳基,其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
且條件是當a為cr13時,r10、r11、r12和r13中至少一個為氫。
本發明還涉及式(xviii)的化合物或其藥學上可接受鹽∶
其中r2、r3、r4、r5和r6為根據式(i)定義的,和其中:
a為n或cr13;
r10為氫、鹵素或(c1-c4)烷氧基;
r11為氫、鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、5-或6-元雜芳基、羥基、-or7或-conr8r9;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基或-nr8r9取代;和其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
r12為氫、鹵素或鹵代(c1-c4)烷基;和
r13為氫、鹵素、鹵代(c1-c4)烷基或5-或6-元雜芳基,其中所述5-或6-元雜芳基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代;
且條件是當a為cr13時,r10、r11、r12和r13中至少一個為氫。
本發明還涉及式(xix)的化合物或其藥學上可接受鹽∶
其中z1、z2、z3、z4、r2、r3和r5為根據式(i)定義的,和其中:
a1、a2和a3之一選自o、s和nr15,且其余兩個各自獨立地選自n和ch;
r14為氫、鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、羥基、-or7、-conr8r9、-so2r7和-so2nr8r9;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基或-nr8r9取代;和
r15為氫、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基或苯基。
在另一個實施方案中,x為cr5。在一個特定實施方案中,x為n。
在一個特定實施方案中,y為鍵。在另一個特定實施方案中,y為-o-。
在另一個實施方案中,z1、z2、z3和z4各自獨立地為n、ch或cr6,其中z1、z2、z3和z4中0、1、2或3個為n,且z1、z2、z3和z4中0、1、2或3個為cr6。在另一個實施方案中,z1、z2、z3和z4各自獨立地為n、ch或cr6,其中z1、z2、z3和z4中0、1或2個為n,且z1、z2、z3和z4中0、1或2個為cr6。在另一個實施方案中,z1、z2、z3和z4各自獨立地為ch或cr6。在一個特定實施方案中,z1、z2、z3和z4各自獨立地為ch。在另一個實施方案中,z1、z2、z3和z4之一為cr6,且其它三個各自獨立地為ch。在另一個實施方案中,z2為cr6且z1、z3和z4各自獨立地為ch。在另一個實施方案中,z1為cr6且z2、z3和z4各自獨立地為ch。在另一個實施方案中,z1、z2、z3和z4中兩個各自獨立地為cr6,且其余兩個各自獨立地為ch。在另一個實施方案中,z1和z2各自獨立地為cr6,且z3和z4各自獨立地為ch。在另一個實施方案中,z2和z3各自獨立地為cr6,且z1和z4各自獨立地為ch。
在另一個實施方案中,z1、z2、z3和z4之一為n,且其余三個各自獨立地為ch或cr6。在一個特定實施方案中,z1、z2、z3和z4之一為n,且其余三個各自獨立地為ch。在另一個實施方案中,z1為n,且z2、z3和z4各自獨立地為ch或cr6。在另一個實施方案中,z1為n,z2為cr6,且z3和z4各自獨立地為ch。在另一個實施方案中,z2為n,且z1、z3和z4各自獨立地為ch或cr6。在另一個實施方案中,z2為n,z1為cr6,且z3和z4各自獨立地為ch。在另一個實施方案中,z1、z2、z3和z4中兩個為n,且其余兩個各自獨立地為ch或cr6。在另一個實施方案中,z1、z2、z3和z4中兩個為n,且其余兩個各自獨立地為ch。在另一個實施方案中,z1和z4為n,且z2和z3各自獨立地為ch或cr6。在另一個實施方案中,z1和z4為n,且z2和z3各自獨立地為cr6。在另一個實施方案中,z1和z4為n,z2為cr6,且z3為ch。在另一個實施方案中,z1和z3為n,且z2和z4各自獨立地為ch或cr6。在另一個實施方案中,z1和z3為n,且z2和z4各自獨立地為cr6。在另一個實施方案中,z1和z3為n,z2為cr6,且z4為ch。
在另一個實施方案中,r1為氫或(c1-c4)烷基。在一個特定實施方案中,r1為氫、甲基或乙基。在一個進一步的特定實施方案中,r1為氫。
在另一個實施方案中,r2為氫、氟、氯、(c1-c4)烷基、鹵代(c1-c4)烷基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c6)烷基)氨基-或((c1-c6)烷基)((c1-c6)烷基)氨基-。在另一個實施方案中,r2為氫、(c1-c4)烷基或(c1-c4)烷氧基。在一個特定實施方案中,r2為氫、甲基、乙基、甲氧基或乙氧基。在一個進一步的特定實施方案中,r2為氫。
在另一個實施方案中,r3為氫、氟、氯、(c1-c4)烷基、鹵代(c1-c4)烷基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c6)烷基)氨基-或((c1-c6)烷基)((c1-c6)烷基)氨基-。在另一個實施方案中,r3為氫、羥基、(c1-c4)烷氧基或(c3-c6)環烷氧基。在一個特定實施方案中,r3為氫、氟、甲基、羥基、甲氧基、二氟甲氧基、乙氧基、正丙氧基、異丙氧基、3-氟丙氧基、環丙氧基或甲基氨基-。在另一個實施方案中,r3為氫或(c1-c4)烷氧基。在另一個特定實施方案中,r3為氫或乙氧基。在一個進一步的特定實施方案中,r3為乙氧基。在另一個進一步的特定實施方案中,r3為氫。
在另一個實施方案中,r4為苯基,其任選地被一個、兩個或三個獨立地選自下述的取代基取代:鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、苯基、5-或6-元雜芳基、羥基、-or7、-conr8r9、-so2r7和-so2nr8r9;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基、-nr8r9或-conr8r9取代;和其中所述5-或6-元雜芳基取代基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代。在另一個實施方案中,r4為苯基,其任選地被一個、兩個或三個獨立地選自下述的取代基取代:氟、氯、(c1-c6)烷基、鹵代(c1-c4)烷基、氰基、(c1-c4)烷氧基、羥基(c2-c4)烷氧基-、(c1-c4)烷氧基(c2-c4)烷氧基-、氨基(c2-c4)烷氧基-、((c1-c4)烷基)氨基(c2-c4)烷氧基-、((c1-c4)烷基)((c1-c4)烷基)氨基(c2-c4)烷氧基-、(3-甲基氧雜環丁烷-3-基)氧基-和-conh2;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、氨基、((c1-c4)烷基)氨基-或((c1-c4)烷基)((c1-c4)烷基)氨基取代。在另一個實施方案中,r4為苯基,其任選地被一個或兩個獨立地選自(c1-c4)烷基、鹵代(c1-c4)烷基、(c1-c4)烷氧基和(3-甲基氧雜環丁烷-3-基)氧基-的取代基取代;其中所述(c1-c4)烷基任選地被氰基、羥基或二甲基氨基-取代。在另一個實施方案中,r4為苯基,其任選地被一個或兩個獨立地選自(c1-c4)烷基和鹵代(c1-c4)烷基的取代基取代;其中所述(c1-c4)烷基任選地被氰基、羥基或二甲基氨基-取代。
在另一個實施方案中,r4為呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噁唑基、噻唑基、異噁唑基、異噻唑基、噁二唑基、噻二唑基、吡啶基、噠嗪基、吡嗪基、嘧啶基或三嗪基,其各自任選地被一個、兩個或三個獨立地選自下述的取代基取代:鹵素、(c1-c6)烷基、鹵代(c1-c6)烷基、(c3-c6)環烷基、氰基、苯基、5-或6-元雜芳基、羥基、-or7、-conr8r9、-so2r7和-so2nr8r9;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基、-nr8r9或-conr8r9取代;和其中所述5-或6-元雜芳基取代基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代。在另一個實施方案中,r4為呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噁唑基、噻唑基、異噁唑基、異噻唑基、噁二唑基、噻二唑基、吡啶基、噠嗪基、吡嗪基、嘧啶基或三嗪基,其各自任選地被一個、兩個或三個獨立地選自下述的取代基取代:氟、氯、(c1-c6)烷基、鹵代(c1-c4)烷基、氰基、(c1-c4)烷氧基、羥基(c2-c4)烷氧基-、(c1-c4)烷氧基(c2-c4)烷氧基-、氨基(c2-c4)烷氧基-、((c1-c4)烷基)氨基(c2-c4)烷氧基-、((c1-c4)烷基)((c1-c4)烷基)氨基(c2-c4)烷氧基-和-conh2;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、氨基、((c1-c4)烷基)氨基-或((c1-c4)烷基)((c1-c4)烷基)氨基取代。
在另一個實施方案中,r4為吡啶基,其任選地被一個、兩個或三個獨立地選自下述的取代基取代:氟、氯、(c1-c6)烷基、鹵代(c1-c4)烷基、氰基、(c1-c4)烷氧基、羥基(c2-c4)烷氧基-、(c1-c4)烷氧基(c2-c4)烷氧基-、氨基(c2-c4)烷氧基-、((c1-c4)烷基)氨基(c2-c4)烷氧基-、((c1-c4)烷基)((c1-c4)烷基)氨基(c2-c4)烷氧基-和-conh2;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、氨基、((c1-c4)烷基)氨基-或((c1-c4)烷基)((c1-c4)烷基)氨基取代。在另一個實施方案中,r4為吡啶基,其任選地被一個或兩個獨立地選自(c1-c4)烷基和鹵代(c1-c4)烷基的取代基取代;其中所述(c1-c4)烷基任選地被氰基、羥基或二甲基氨基-取代。
在另一個實施方案中,r4為呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噁唑基、噻唑基、異噁唑基、異噻唑基、噁二唑基、噻二唑基、吡啶基、噠嗪基、吡嗪基、嘧啶基或三嗪基,其各自任選地被一個或兩個獨立地選自(c1-c4)烷基和鹵素(c1-c4)烷基的取代基取代。在另一個實施方案中,r4為異噁唑基,其任選地被(c1-c4)烷基或鹵代(c1-c4)烷基取代。
在另一個實施方案中,r5為氫、氟、氯、(c1-c4)烷基、鹵代(c1-c4)烷基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c6)烷基)氨基-或((c1-c6)烷基)((c1-c6)烷基)氨基-。在另一個實施方案中,r5為氫、羥基、(c1-c4)烷氧基或(c3-c6)環烷氧基。在一個特定實施方案中,r5為氫、氟、甲基、羥基、甲氧基、二氟甲氧基、乙氧基、正丙氧基、異丙氧基、3-氟丙氧基、環丙氧基或甲基氨基-。在另一個實施方案中,r5為氫或(c1-c4)烷氧基。在另一個特定實施方案中,r5為氫或乙氧基。在一個進一步的特定實施方案中,r5為乙氧基。在另一個進一步的特定實施方案中,r5為氫。
在另一個實施方案中,r3和r5與它們連接的碳原子結合在一起表示5-或6-元環,任選地包含一個、兩個或三個獨立地選自氮、氧和硫的雜原子,其中所述環任選地被一個或兩個獨立地選自下述的取代基取代:鹵素、(c1-c4)烷基、鹵代(c1-c4)烷基、(c3-c6)環烷基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c4)烷基)氨基和((c1-c4)烷基)((c1-c4)烷基)氨基。在另一個實施方案中,r3和r5與它們連接的碳原子一起代表苯基環,其任選地被一個或兩個獨立地選自下述的取代基取代:鹵素、(c1-c4)烷基、鹵代(c1-c4)烷基、(c3-c6)環烷基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c4)烷基)氨基和((c1-c4)烷基)((c1-c4)烷基)氨基。在一個特定實施方案中,r3和r5與它們連接的碳原子一起代表苯基環。
在另一個實施方案中,r3和r5與它們連接的碳原子一起代表吡啶基、噠嗪基、吡嗪基、嘧啶基或三嗪基,其各自任選地被鹵素、(c1-c4)烷基、鹵代(c1-c4)烷基、(c3-c6)環烷基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c4)烷基)氨基或((c1-c4)烷基)((c1-c4)烷基)氨基取代。在一個特定實施方案中,r3和r5與它們連接的碳原子一起代表吡啶基、噠嗪基、吡嗪基、嘧啶基或三嗪基。在一個進一步的特定實施方案中,r3和r5與它們連接的碳原子一起代表吡啶基。
在另一個實施方案中,r3和r5與它們連接的碳原子一起代表呋喃基、二氫呋喃基、噻吩基、吡咯基、吡咯啉基、咪唑基、咪唑啉基、吡唑基、吡唑啉基、三唑基、噁唑基、噻唑基、異噁唑基、異噻唑基、噁二唑基或噻二唑基,其中所述呋喃基、二氫呋喃基、噻吩基、吡咯基、吡咯啉基、咪唑基、咪唑啉基、吡唑基、吡唑啉基、三唑基、噁唑基、噻唑基、異噁唑基或異噻唑基任選地被鹵素、(c1-c4)烷基、鹵代(c1-c4)烷基、(c3-c6)環烷基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c4)烷基)氨基或((c1-c4)烷基)((c1-c4)烷基)氨基取代。在一個特定實施方案中,r3和r5與它們連接的碳原子一起代表呋喃基、二氫呋喃基、噻吩基、吡咯基、吡咯啉基、咪唑基、咪唑啉基、吡唑基、吡唑啉基、三唑基、噁唑基、噻唑基、異噁唑基、異噻唑基、噁二唑基或噻二唑基。在另一個特定實施方案中,r3和r5與它們連接的碳原子一起代表呋喃基、二氫呋喃基或吡唑基。在另一個特定實施方案中,r3和r5與它們連接的碳原子一起代表環戊烯基。
在另一個實施方案中,每個r6獨立地選自鹵素、(c1-c4)烷基、鹵代(c1-c4)烷基、(c3-c6)環烷基、氰基、羥基、(c1-c4)烷氧基、鹵代(c1-c4)烷氧基、(c3-c6)環烷氧基、氨基、((c1-c4)烷基)氨基-和((c1-c4)烷基)((c1-c6)烷基)氨基-。在一個特定實施方案中,每個r6獨立地選自氟、氯、甲基、乙基、二氟甲基、環丙基、甲氧基、異丙氧基和二甲基氨基-。在一個進一步的特定實施方案中,r6為氟。在另一個進一步的特定實施方案中,r6為甲基。
在另一個實施方案中,r8和r9各自獨立地選自氫、(c1-c4)烷基、鹵代(c1-c4)烷基、氨基(c1-c4)烷基-、((c1-c4)烷基)氨基(c1-c4)烷基和((c1-c4)烷基)((c1-c4)烷基)氨基(c1-c4)烷基。在另一個實施方案中,r8和r9與它們連接的氮結合在一起表示5-或6-元飽和的環,任選地含有選自氧、氮和硫的另外的雜原子,其中所述環任選地被鹵素、(c1-c4)烷基、鹵代(c1-c4)烷基或羥基(c1-c4)烷基取代。
在另一個實施方案中,r8和r9各自獨立地選自氫、(c1-c4)烷基和鹵代(c1-c4)烷基;或r8和r9與它們連接的氮結合在一起表示5-或6-元飽和的環,任選地含有選自氧、氮和硫的另外的雜原子,其中所述環任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代。在另一個實施方案中,r8和r9各自獨立地選自氫、(c1-c4)烷基和鹵代(c1-c4)烷基。在另一個實施方案中,r8和r9與它們連接的氮結合在一起表示5-或6-元飽和的環,任選地含有選自氧、氮和硫的另外的雜原子,其中所述環任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代。
在另一個實施方案中,a為cr13,且r13為氫、鹵素、鹵代(c1-c4)烷基、呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噁唑基、噻唑基、異噁唑基、異噻唑基、噁二唑基、噻二唑基、吡啶基、噠嗪基、吡嗪基、嘧啶基或三嗪基,其中所述呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噁唑基、噻唑基、異噁唑基、異噻唑基、噁二唑基、噻二唑基、吡啶基、噠嗪基、吡嗪基、嘧啶基或三嗪基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代。在另一個實施方案中,a為cr13,且r13為氫、氟、氯或三氟甲基。在一個特定實施方案中,a為ch。在另一個特定實施方案中,a為n。
在另一個實施方案中,r10為氫或鹵素。在一個特定實施方案中,r10為氫或氟。在一個更進一步的實施方案中,r10為氫。
在另一個實施方案中,r11為氫、氟、氯、(c1-c6)烷基、鹵代(c1-c4)烷基、氰基、(c1-c4)烷氧基、羥基(c2-c4)烷氧基-、(c1-c4)烷氧基(c2-c4)烷氧基-、氨基(c2-c4)烷氧基-、((c1-c4)烷基)氨基(c2-c4)烷氧基-、((c1-c4)烷基)((c1-c4)烷基)氨基(c2-c4)烷氧基-、(3-甲基氧雜環丁烷-3-基)氧基-或-conh2;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、氨基、((c1-c4)烷基)氨基或((c1-c4)烷基)((c1-c4)烷基)氨基取代。在另一個實施方案中,r11為氫、(c1-c4)烷氧基或(c1-c6)烷基;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、氨基、((c1-c4)烷基)氨基或((c1-c4)烷基)((c1-c4)烷基)氨基取代。在另一個實施方案中,r11為(c1-c4)烷基,其任選地被氰基、羥基、(c1-c4)烷氧基、氨基、((c1-c4)烷基)氨基或((c1-c4)烷基)((c1-c4)烷基)氨基取代。
在另一個實施方案中,r12為鹵代(c1-c4)烷基。在一個特定實施方案中,r12為三氟甲基。
在另一個實施方案中,a1為ch,a2為o,且a3為n;或a1為ch,a2為n,且a3為o;或a1為ch,a2為n,且a3為nr15。在另一個實施方案中,a1為ch,a2為o,且a3為n。在另一個實施方案中,a1為ch,a2為n,且a3為o。在另一個實施方案中,a1為ch,a2為n,且a3為nr15。
在另一個實施方案中,r14為氫、鹵素、(c1-c4)烷基、鹵代(c1-c4)烷基或(c3-c6)環烷基。在另一個實施方案中,r14為(c1-c4)烷基或鹵代(c1-c4)烷基。在另一個實施方案中,r14為鹵代(c1-c4)烷基。
在另一個實施方案中,r15為氫、(c1-c4)烷基、鹵代(c1-c4)烷基、(c3-c6)環烷基或苯基。在一個特定實施方案中,r15為氫、甲基、乙基或苯基。
在一個特定實施方案中,本發明涉及式(i)的化合物或其藥學上可接受鹽,其中:
x為cr5;
y為鍵;
z1、z2、z3和z4各自獨立地為n、ch或cr6,其中z1、z2、z3和z4中0、1或2個為n且z1、z2、z3和z4中0、1或2個為cr6;
r1為氫;
r2為氫、(c1-c4)烷基或(c1-c4)烷氧基;
r3為氫、羥基、(c1-c4)烷氧基或(c3-c6)環烷氧基;
r4為苯基,其任選地被一個、兩個或三個獨立地選自下述的取代基取代:氟、氯、(c1-c6)烷基、鹵代(c1-c4)烷基、氰基、(c1-c4)烷氧基、羥基(c2-c4)烷氧基-、(c1-c4)烷氧基(c2-c4)烷氧基-、氨基(c2-c4)烷氧基-、((c1-c4)烷基)氨基(c2-c4)烷氧基-、((c1-c4)烷基)((c1-c4)烷基)氨基(c2-c4)烷氧基-、(3-甲基氧雜環丁烷-3-基)氧基-和-conh2;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、氨基、((c1-c4)烷基)氨基-或((c1-c4)烷基)((c1-c4)烷基)氨基-取代;
r5為氫、羥基、(c1-c4)烷氧基或(c3-c6)環烷氧基;和
每個r6獨立地選自氟、氯、甲基、乙基、二氟甲基、環丙基、甲氧基、異丙氧基和二甲基氨基-。
在另一個特定實施方案中,本發明涉及式(i)的化合物或其藥學上可接受鹽,其中:
x為cr5;
y為鍵;
z1、z2、z3和z4各自獨立地為n、ch或cr6,其中z1、z2、z3和z4中0、1或2個為n且z1、z2、z3和z4中0、1或2個為cr6;
r1為氫;
r2為氫、(c1-c4)烷基或(c1-c4)烷氧基;
r3為氫、羥基、(c1-c4)烷氧基或(c3-c6)環烷氧基;
r4為呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噁唑基、噻唑基、異噁唑基、異噻唑基、噁二唑基、噻二唑基、吡啶基、噠嗪基、吡嗪基、嘧啶基或三嗪基,其各自任選地被一個或兩個獨立地選自(c1-c4)烷基和鹵代(c1-c4)烷基的取代基取代;
r5為氫、羥基、(c1-c4)烷氧基或(c3-c6)環烷氧基;和
每個r6獨立地選自氟、氯、甲基、乙基、二氟甲基、環丙基、甲氧基、異丙氧基和二甲基氨基-。
在另一個特定實施方案中,本發明涉及式(xii)的化合物或其藥學上可接受鹽,其中:
z1、z2、z3和z4各自獨立地為n、ch或cr6,其中z1、z2、z3和z4中0、1或2個為n,且z1、z2、z3和z4中0、1或2個為cr6;
r2為氫、(c1-c4)烷基或(c1-c4)烷氧基;
r3為氫、羥基、(c1-c4)烷氧基或(c3-c6)環烷氧基;
r5為氫、羥基、(c1-c4)烷氧基或(c3-c6)環烷氧基;
a為n或cr13;
r10為氫或鹵素;
r11為氫、氟、氯、(c1-c6)烷基、鹵代(c1-c4)烷基、氰基、(c1-c4)烷氧基、羥基(c2-c4)烷氧基-、(c1-c4)烷氧基(c2-c4)烷氧基-、氨基(c2-c4)烷氧基-、((c1-c4)烷基)氨基(c2-c4)烷氧基-、((c1-c4)烷基)((c1-c4)烷基)氨基(c2-c4)烷氧基-、(3-甲基氧雜環丁烷-3-基)氧基-或-conh2;其中所述(c1-c6)烷基任選地被氰基、羥基、(c1-c4)烷氧基、氨基、((c1-c4)烷基)氨基或((c1-c4)烷基)((c1-c4)烷基)氨基取代;
r12為鹵代(c1-c4)烷基;和
r13為氫、鹵素、鹵代(c1-c4)烷基、呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噁唑基、噻唑基、異噁唑基、異噻唑基、噁二唑基、噻二唑基、吡啶基、噠嗪基、吡嗪基、嘧啶基或三嗪基,其中所述呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噁唑基、噻唑基、異噁唑基、異噻唑基、噁二唑基、噻二唑基、吡啶基、噠嗪基、吡嗪基、嘧啶基或三嗪基任選地被鹵素、(c1-c4)烷基或鹵代(c1-c4)烷基取代。
在另一個特定實施方案中,本發明涉及式(xix)的化合物或其藥學上可接受鹽,其中:
z1、z2、z3和z4各自獨立地為n、ch或cr6,其中z1、z2、z3和z4中0、1或2個為n,且z1、z2、z3和z4中0、1或2個為cr6;
r2為氫、(c1-c4)烷基或(c1-c4)烷氧基;
r3為氫、羥基、(c1-c4)烷氧基或(c3-c6)環烷氧基;
r5為氫、羥基、(c1-c4)烷氧基或(c3-c6)環烷氧基;
a1為ch,a2為o和a3為n;或a1為ch,a2為n,且a3為o;或a1為ch,a2為n,且a3為nr15;
r14為(c1-c4)烷基或鹵代(c1-c4)烷基;和
r15為氫、甲基、乙基或苯基。
本發明還涉及在試驗部分示例的化合物。
本發明的特定化合物包括:
1-(2-氟-4-(7-氧代-6,7-二氫呋喃并[2,3-c]吡啶-4-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲;
1-(4-乙氧基-3-(三氟甲基)苯基)-3-(2-氟-4-(1-氧代-2,5,6,7-四氫-1h-環戊二烯并[c]吡啶-4-基)苯基)脲;
1-(2-氟-4-(4-氧代-4,5-二氫-1h-吡唑并[4,3-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(5'-乙氧基-6-甲基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲;
1-(3-(二氟甲基)-4-異丙氧基苯基)-3-(5'-乙氧基-6-甲基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)脲;
1-(2-氟-4-(5-甲基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(5'-乙氧基-2-甲基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲;
1-(5'-乙氧基-5-甲基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(1-羥基乙基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲;
1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲;
1-(4-(2-氰基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲;
1-(5-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-3-甲基吡嗪-2-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲;
1-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-(哌嗪-1-基甲基)-3-(三氟甲基)苯基)脲;
1-(4-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(2-氟-4-(4-氧代-4,5-二氫呋喃并[3,2-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-環丙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-甲氧基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(2-氟-4-(4-氧代-2,3,4,5-四氫呋喃[3,2-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(5'-乙氧基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲;
1-(2-(二氟甲基)-4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲;
1-(4-((5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲;
1-(4-(4-乙氧基-2-氧代-1,2-二氫嘧啶-5-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(2-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(2-氟-4-(5-氟-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(2-氟-4-(4-氟-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(三氟甲基)苯基)脲;
1-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)-3-(4-甲基-2-(7-氧代-6,7-二氫呋喃并[2,3-c]吡啶-4-基)嘧啶-5-基)脲;
1-(2-氟-4-(2-甲基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(5-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-3-甲基吡嗪-2-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(三氟甲基)苯基)脲;
1-(4-氰基-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(4-氰基-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(嗎啉代甲基)-3-(三氟甲基)苯基)脲;
1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲;
1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲;
1-(4-((5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(5'-乙氧基-6-甲基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-羥基丙烷-2-基)-3-(三氟甲基)苯基)脲;
1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲;
1-(4-氯-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-乙基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲;
1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-基)脲;
1-(4-氯-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
2-(4-(3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙酰胺;
1-(5'-乙氧基-4-甲基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
2-(4-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙酰胺;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲;
1-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)-3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(1-(羥基甲基)環丙基)-3-(三氟甲基)苯基)脲;
1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(5-甲基-1,3,4-噁二唑-2-基)-5-(三氟甲基)苯基)脲;
1-(3-(叔丁基)-1-苯基-1h-吡唑-5-基)-3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲;
1-(4-(1-氨基-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-羥基丙烷-2-基)-3-(三氟甲基)苯基)脲;
1-(3-(1h-1,2,4-三唑-1-基)-5-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(4-(1-(二甲基氨基)-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(2-氟-4-(1-氧代-1,2-二氫異喹啉-4-基)苯基)-3-(4-(2-羥基丙烷-2-基)-3-(三氟甲基)苯基)脲;
1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(1-(羥基甲基)環丙基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(2-氟-5-(三氟甲基)苯基)脲;
1-(4-(叔-丁氧基)-3-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)苯基)脲;
1-(4-乙氧基-3-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(4-(2-氰基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲;
1-(4-((2-氰基丙烷-2-基)氧基)-3-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(3-羥基-1-甲基環丁氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((1-異丙基-3-甲基吡咯烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-((5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(2-氟-5-(三氟甲基)苯基)脲;
1-(6-氯-5'-乙氧基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(1-(羥基甲基)環丙基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2,6-二氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(6-異丙氧基-5-(三氟甲基)吡啶-3-基)脲;
1-(3-(二氟甲基)-4-((3-甲基氧雜環丁烷-3-基)氧基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(2-氟-4-(5-羥基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(2-氟-4-(5-(甲基氨基)-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(5'-乙氧基-4-甲基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-乙氧基-3-(三氟甲基)苯基)-3-(2-氟-4-(4-氧代-4,5-二氫呋喃并[3,2-c]吡啶-7-基)苯基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(2-嗎啉代乙氧基)-5-(三氟甲基)苯基)脲;
1-(5'-甲氧基-6-甲基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(6-((5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)氧基)吡啶-3-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(5'-乙氧基-6-乙基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(5'-乙氧基-5-氟-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(6-環丙基-5'-乙氧基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(5'-乙氧基-5-甲基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(5'-乙氧基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-氟-3-(三氟甲基)苯基)-3-(2-氟-4-(5-(3-氟丙氧基)-6-氧代-1,6-二氫吡啶-3-基)苯基)脲;
1-(5-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-3-甲基吡嗪-2-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(氮雜環丁烷-1-基甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(5'-乙氧基-6-甲氧基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(吡咯烷-1-基甲基)-3-(三氟甲基)苯基)脲;
1-(6-(二甲基氨基)-5'-乙氧基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-乙氧基-3-(三氟甲基)苯基)-3-(4-(1-乙基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(5-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-3-甲基吡嗪-2-基)脲;
1-(5'-乙氧基-6-異丙氧基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(1-羥基乙基)-3-(三氟甲基)苯基)脲;
1-(4-((1,3-二甲基氮雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((1-羥基-2-甲基丙烷-2-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2,3-二氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(1-羥基-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)脲;
1-(2-氟-4-(5-(3-氟丙氧基)-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((1-羥基丙烷-2-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(1-(羥基甲基)環丙氧基)-3-(三氟甲基)苯基)脲;
1-(3-(二氟甲基)-4-((3-甲基氧雜環丁烷-3-基)氧基)苯基)-3-(4-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(4-(2,2-二氟-3-羥基丙基)-3-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(4-(4-(二氟甲氧基)-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(4-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(2-氟-5-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(2-羥基丙烷-2-基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)-3-(4-(6-氧代-5-丙氧基-1,6-二氫吡啶-3-基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(羥基甲基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-3-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(1-(羥基甲基)環丁氧基)-3-(三氟甲基)苯基)脲;
1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(2-氟-4-(5-異丙氧基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(2-甲基-4-(6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(2-氟-4-(6-氧代-5-丙氧基-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((1-氟-2-甲基丙烷-2-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(2-羥基-5-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(2-羥基乙氧基)-3-(三氟甲基)苯基)脲;
1-(4-((1,3-二甲基吡咯烷-3-基)氧基)-3-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(2-羥基丙氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((1-甲基-1h-吡唑-4-基)甲基)-3-(三氟甲基)苯基)脲;
1-(2-氟-4-(6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(6-((3-甲基氧雜環丁烷-3-基)氧基)-5-(三氟甲基)吡啶-3-基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(1-甲基環丁氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基-1,1-二氧化硫雜環丁烷(dioxidothietan)-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(乙氧基甲基)-3-(三氟甲基)苯基)脲;
1-(4-氯-3-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(2-乙氧基-4-氟-5-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
(s)-1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-氟吡咯烷-1-基)甲基)-3-(三氟甲基)苯基)脲;
1-(2-氟-4-(7-氧代-6,7-二氫呋喃并[2,3-c]吡啶-4-基)苯基)-3-(2-氟-5-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-氟-3-(三氟甲基)苯基)脲;
1-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)-3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲;
1-(4-氰基-3-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((1-甲氧基-2-甲基丙烷-2-基)氧基)-3-(三氟甲基)苯基)脲;
1-(3-(二氟甲基)-4-異丙氧基苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-3-氟苯基)脲;
1-(4-(3,3-二氟環丁氧基)-3-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
4-(3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲基)-2-(三氟甲基)苯甲酰胺;
1-(4-異丙氧基-3-(三氟甲基)苯基)-3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲;
1-(4-(5-(二氟甲氧基)-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(2-羥基乙氧基)-3-(三氟甲基)苯基)脲;
1-(4-(2-(二甲基氨基)乙基)-3-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(2-氟-4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基四氫呋喃-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(2-氟-4-(4-甲基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲;
1-(3-(二氟甲基)-4-((3-甲基氧雜環丁烷-3-基)氧基)苯基)-3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲;
1-(3,4-二氯苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)脲;
1-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-(2-羥基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)-3-(2-(5-(2-羥基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯磺酰胺;
1-(4-(1-氨基乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(4-(1-(二甲基氨基)乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-(吡咯烷-1-基)乙基)-3-(三氟甲基)苯基)脲;
1-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)脲;
1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)脲;
1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲;
1-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(4-(2-甲氧基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲;
1-(2-氟-4-((4-甲基哌嗪-1-基)甲基)-5-(三氟甲基)-苯基)-3-(2-(5-(2-甲氧基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(4-(2-氨基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
1-(4-(2-氨基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;
n-(2-(二甲基氨基)乙基)-3-(3-(2-(4-(2-甲氧基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺;
1-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)脲;
n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺;
1-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲;和
1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲;
或其藥學上可接受鹽。
本領域技術人員認識到,當使用不同命名軟件時,本發明化合物可具有不同的名稱。
本發明還涉及式(i)-(xix)的化合物或任一種示例的化合物其藥學上可接受鹽,用于治療,特別地用于其中受試者為人類的治療。特別地,用于治療下述ret介導的疾病∶腸易激綜合征(ibs),包括腹瀉主導型、便秘主導型或交替排便模式、功能性胃氣脹、功能性便秘、功能性腹瀉、非特異性功能性腸病、功能性腹痛綜合征、慢性特發性便秘、功能性食管病、功能性胃十二指腸病、功能性肛門直腸疼痛、炎性腸病,增殖性疾病例如非小細胞肺癌、肝細胞癌、結腸直腸癌、髓樣甲狀腺癌、濾泡性甲狀腺癌、未分化甲狀腺癌、乳頭狀甲狀腺癌、腦瘤、腹膜腔癌、實體瘤、其它肺癌、頭頸癌、神經膠質瘤、神經母細胞瘤、vonhipple-lindau綜合征和腎腫瘤、乳腺癌、輸卵管癌、卵巢癌、過渡型細胞癌、前列腺癌、食道和食管胃連接處的癌癥、膽道癌和腺癌。特別地,本發明涉及式(i)-(xix)的化合物或任一種示例的化合物或其藥學上可接受鹽,用于治療下述疾病∶腸易激綜合征(ibs),包括腹瀉主導型、便秘主導型或交替排便模式、功能性胃氣脹、功能性便秘、功能性腹瀉、非特異性功能性腸病、功能性腹痛綜合征、慢性特發性便秘、功能性食管病、功能性胃十二指腸病、功能性肛門直腸疼痛、炎性腸病,非小細胞肺癌、肝細胞癌、結腸直腸癌、髓樣甲狀腺癌、濾泡性甲狀腺癌、未分化甲狀腺癌、乳頭狀甲狀腺癌、腦瘤、腹膜腔癌、實體瘤、其它肺癌、頭頸癌、神經膠質瘤、神經母細胞瘤、vonhipple-lindau綜合征和腎腫瘤、乳腺癌、輸卵管癌、卵巢癌、過渡型細胞癌、前列腺癌、食道和食管胃連接處的癌癥、膽道癌和腺癌。
本發明還涉及用作藥物的式(i)-(xix)的化合物或任一種示例的化合物其藥學上可接受鹽。在另一個實施方案中,本發明涉及本發明的化合物在制備用于治療ret介導的疾病的藥物中的用途。本發明還涉及式(i)-(xix)的化合物或任一種示例的化合物或其藥學上可接受鹽,制備用于治療腸易激綜合征的藥物。本發明還涉及式(i)-(xix)的化合物或任一種示例的化合物其藥學上可接受鹽,制備用于治療癌癥的藥物。
本發明還涉及式(i)-(xix)的化合物或任一種示例的化合物在治療中的用途。本發明進一步包括本發明的化合物作為活性治療物質的用途,特別地在治療ret介導的疾病中的用途。本發明還涉及式(i)-(xix)的化合物或任一種示例的化合物用于治療腸易激綜合征的用途。本發明還涉及式(i)-(xix)的化合物或任一種示例的化合物用于治療癌癥的用途。
由于它們在醫學中的潛在用途,式(i)-(xix)化合物的鹽優選地是藥學上可接受的。合適的藥學上可接受鹽包括由berge,bighley,andmonkhouse,j.pharm.sci.(1977)66,pp1-19描述的那些。涵蓋在術語“藥學上可接受鹽”之內的鹽指本發明的化合物的無毒鹽。含有堿性胺或其它堿性官能團的所公開化合物的鹽可以通過本領域已知的任何合適的方法制備,包括用無機酸或有機酸處理游離堿,所述無機酸比如鹽酸、氫溴酸、硫酸、硝酸、磷酸等,所述有機酸比如乙酸、三氟乙酸、馬來酸、琥珀酸、扁桃酸、富馬酸、丙二酸、丙酮酸、草酸、乙醇酸、水楊酸、吡喃糖基酸(pyranosidylacid)(比如葡糖醛酸或半乳糖醛酸)、α-羥酸(比如檸檬酸或酒石酸)、氨基酸(比如天冬氨酸或谷氨酸)、芳香酸(比如苯甲酸或肉桂酸)、磺酸(比如對甲苯磺酸、甲磺酸、乙磺酸)等。藥學上可接受鹽的實例包括硫酸鹽、焦硫酸鹽、硫酸氫鹽、亞硫酸鹽、亞硫酸氫鹽、磷酸鹽、氯化物、溴化物、碘化物、乙酸鹽、丙酸鹽、癸酸鹽、辛酸鹽、丙烯酸鹽、甲酸鹽、異丁酸鹽、己酸鹽、庚酸鹽、丙炔酸鹽、草酸鹽、丙二酸鹽、琥珀酸鹽、辛二酸鹽、癸二酸鹽、富馬酸鹽、馬來酸鹽、丁炔-1,4-二酸鹽、己炔-1,6-二酸鹽、苯甲酸鹽、氯苯甲酸鹽、甲基苯甲酸鹽、二硝基苯甲酸鹽、羥基苯甲酸鹽、甲氧基苯甲酸鹽、鄰苯二甲酸鹽、苯基乙酸鹽、苯基丙酸鹽、苯基丁酸鹽(phenylbutrate)、檸檬酸鹽、乳酸鹽、γ-羥基丁酸鹽、乙醇酸鹽、酒石酸鹽、扁桃酸鹽和磺酸鹽,比如二甲苯磺酸鹽、甲磺酸鹽、丙磺酸鹽、萘-1-磺酸鹽和萘-2-磺酸鹽。
含有羧酸或其它酸性官能團的所公開化合物的鹽也可以用合適的堿來制備。這樣的藥學上可接受鹽可以用提供藥學上可接受陽離子的堿制備,其包括堿金屬鹽(特別是鈉和鉀)、堿土金屬鹽(特別是鈣和鎂)、鋁鹽和銨鹽、以及由生理學可接受的有機堿制成的鹽,所述有機堿比如三甲胺、三乙胺、嗎啉、吡啶、哌啶、甲基吡啶、二環己胺、n,n'-二芐基乙二胺、2-羥基乙胺、雙-(2-羥乙基)胺、三-(2-羥乙基)胺、普魯卡因、二芐基哌啶、脫氫樅胺、n,n'-雙脫氫樅胺、葡萄糖胺、n-甲基葡萄糖胺、可力丁(collidine)、膽堿、奎寧、喹啉和堿性氨基酸(比如賴氨酸和精氨酸)。
不是藥學上可接受的其他鹽可用于制備本發明化合物,并且這些應視為形成本發明的一個進一步的方面。這些鹽,比如三氟乙酸鹽,雖然其本身不是藥學上可接受的,但可用于制備用作獲得本發明化合物及其藥學上可接受鹽的中間體的鹽。
如果本發明的含有堿性胺或其它堿性官能團的化合物以鹽的形式被分離,則該化合物的相應游離堿形式可以通過本領域已知的任何合適的方法制備,包括用無機堿或有機堿處理該鹽,合適地是具有比該化合物的游離堿形式更高pka的無機堿或有機堿。類似地,如果本發明的含有羧酸或其它酸性官能團的化合物以鹽的形式被分離,則該化合物的相應游離酸形式可以通過本領域已知的任何合適的方法制備,包括用無機酸或有機酸處理該鹽,合適地是具有比該化合物的游離酸形式更低pka的無機酸或有機酸。
如本文使用的術語“式(i)-(xix)的化合物”或“所述式(i)-(xix)的化合物”指一個或多個根據式(i)-(xix)中任一個的化合物。式(i)-(xix)的化合物可以以固體或液體形式存在。在固體形式中,其可以以結晶或非結晶形式或其混合物存在。本領域技術人員應當理解,藥學上可接受溶劑合物可形成結晶或非結晶化合物。在結晶溶劑合物中,溶劑分子在結晶過程中被結合到晶格中。溶劑化物可包括非水溶劑,比如但不限于乙醇、異丙醇、dmso、乙酸、乙醇胺或乙酸乙酯,或者它們可包括水作為結合到晶格中的溶劑。其中水為結合到晶格中的溶劑的溶劑化物通常被稱為“水合物”。水合物包括化學計量的水合物以及含有可變量水的組合物。本發明包括所有這樣的溶劑化物。
本領域技術人員應當進一步理解,以結晶形式存在的本發明的某些化合物(包括其各種溶劑化物)可顯示多晶型現象(即,能夠以不同的晶體結構存在)。這些不同的晶型通常被稱為“多晶型物(polymorph)”。本發明包括所有這樣的多晶型物。多晶型物具有相同的化學組成,但是在堆積(packing)、幾何排布和結晶固態的其他表征性質方面不同。因此,多晶型物可以具有不同的物理性質,比如形狀、密度、硬度、變形性、穩定性和溶出性。多晶型物通常顯示出不同的熔點、紅外光譜和x射線粉末衍射圖,其可用于鑒定。本領域技術人員應當理解,不同的多晶型物可通過例如改變或調整制備該化合物所用的反應條件或試劑進產生。例如,溫度、壓力或溶劑的改變可能導致多晶型物。另外,一種多晶型物可以在一定的條件下自發地轉化成另一種多晶型物。
本發明進一步涉及1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿和各種鹽的一些晶型。特定的鹽形式包括鹽酸鹽、乙磺酸鹽和硫酸鹽。
在某些實施方案中,1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的無水游離堿(化合物a游離堿無水物)的晶型的特征在于,當使用cukα射線測量時,x射線粉末衍射(xrpd)圖案包含選自下述的至少九個衍射角:約2.2、4.9、5.5、5.7、11.8、11.9、12.8、12.9、13.1、14.3、16.1、16.6、17.1、17.2、21.2、21.3、21.9、22.0、22.7、22.8、23.1、25.3和25.4度2θ。在另一個實施方案中,化合物a游離堿無水物的特征在于,當使用cukα射線測量時,x射線粉末衍射(xrpd)圖案包含選自下述的至少八個衍射角或至少七個衍射角或至少六個衍射角或至少五個衍射角或至少四個衍射角:約2.2、4.9、5.5、5.7、11.8、11.9、12.8、12.9、13.1、14.3、16.1、16.6、17.1、17.2、21.2、21.3、21.9、22.0、22.7、22.8、23.1、25.3和25.4度2θ。在另一個實施方案中,化合物a游離堿無水物的特征在于,當使用cukα射線測量時,x射線粉末衍射(xrpd)圖案包含至少選自下述的三個衍射角:約2.2、4.9、5.5、5.7、11.8、11.9、12.8、12.9、13.1、14.3、16.1、16.6、17.1、17.2、21.2、21.3、21.9、22.0、22.7、22.8、23.1、25.3和25.4度2θ。
在仍然另一個實施方案中,化合物a游離堿無水物的特征在于,當使用cukα射線測量時,x射線粉末衍射(xrpd)圖案包含約5.7、11.9、12.9、14.3、16.1和23.1度2θ的衍射角。在仍然另一個實施方案中,化合物a游離堿無水物的特征在于具有與圖1實質上一致的x射線粉末衍射(xrpd)圖案。
在其它實施方案中,化合物a游離堿無水物的特征在于拉曼光譜包含選自如下峰位置的至少九個峰:約409、442、467、585、708、743、773、790、851、904、950、1005、1247、1314、1330、1397、1435、1469、1492、1530、1577、1623、1653、1710、2940cm-1。在另一個實施方案中,化合物a游離堿無水物的特征在于拉曼光譜包含選自如下峰位置的至少八個峰或至少七個峰或至少六個峰或至少五個峰或至少四個、三個峰:約409、442、467、585、708、743、773、790、851、904、950、1005、1247、1314、1330、1397、1435、1469、1492、1530、1577、1623、1653、1710、2940cm-1。在另一個實施方案中,化合物a游離堿無水物的特征在于拉曼光譜包含選自如下峰位置的至少三個峰:約409、442、467、585、708、743、773、790、851、904、950、1005、1247、1314、1330、1397、1435、1469、1492、1530、1577、1623、1653、1710、2940cm-1。
在仍然另一個實施方案中,化合物a游離堿無水物的特征在于拉曼光譜包含位于約1247、1314、1330、1435、1469、1492、1530、1577、1623、1653、1710、2940cm-1的峰。在仍然另一個實施方案中,化合物a游離堿無水物的特征在于具有與圖2實質上一致的拉曼光譜。
在進一步的實施方案中,化合物a游離堿無水物的特征在于具有與圖3實質上一致的差示掃描量熱法跡線和/或與圖4實質上一致的熱重量分析跡線。
在仍然進一步的實施方案中,本領域普通技術人員應當理解,化合物a游離堿無水物的特征在于具有表征前述實施方案的分析數據的任意組合。例如,在一個實施方案中,化合物a游離堿無水物的特征在于具有與圖1實質上一致的x射線粉末衍射(xrpd)圖案和與圖2實質上一致的拉曼光譜和與圖3實質上一致的差示掃描量熱法跡線及與圖4實質上一致的熱重量分析跡線。在另一個實施方案中,化合物a游離堿無水物的特征在于具有與圖1實質上一致的x射線粉末衍射(xrpd)圖案和與圖2實質上一致的拉曼光譜。在另一個實施方案中,化合物a游離堿無水物的特征在于具有與圖1實質上一致的x射線粉末衍射(xrpd)圖案和與圖3實質上一致的差示掃描量熱法跡線。在另一個實施方案中,化合物a游離堿無水物的特征在于具有與圖1實質上一致的x射線粉末衍射(xrpd)圖案和與圖4實質上一致的熱重量分析跡線。在另一個實施方案中,化合物a游離堿無水物的特征在于具有包含使用cukα射線測量的約5.7、11.9、12.9、14.3、16.1和23.1度2θ衍射角的x-射線粉末衍射(xrpd)圖案,和包含位于約1247、1314、1330、1435、1469、1492、1530、1577、1623、1653、1710、2940cm-1的峰的拉曼光譜。在另一個實施方案中,化合物a游離堿無水物的特征在于具有包含使用cukα射線測量的約5.7、11.9、12.9、14.3、16.1和23.1度2θ衍射角的x射線粉末衍射(xrpd)圖案和與圖3實質上一致的差示掃描量熱法跡線。在另一個實施方案中,化合物a游離堿無水物的特征在于具有包含使用cukα射線測量的約5.7、11.9、12.9、14.3、16.1和23.1度2θ衍射角x射線粉末衍射(xrpd)圖案和與圖4實質上一致的熱重量分析跡線。
應當理解,當xrpd圖案包含的衍射角(以度2θ表示)在指定值的±0.3度2θ之內時,則該xrpd圖案包括本文所指定“約”值的衍射角。進一步,本領域技術人員熟知且理解,所用的裝置、濕度、溫度、粉末晶體的取向及涉及獲得x射線粉末衍射(xrpd)圖案的其它參數可以造成衍射圖譜的外觀、強度和直線位置的某些變化。本領域技術人員應理解,本文提供的與圖1、5、9、13、17、21、25、29、33或37“實質上一致”的x射線粉末衍射圖案為表示具有與提供圖1、5、9、13、17、21、25、29、33或37的xrpd圖案的化合物相同晶形的化合物的xrpd圖案。即,該xrpd圖案可能與圖1、5、9、13、17、21、25、29、33或37的相同,或者更可能其可能有些差異。這樣的xrpd圖案可能并不一定顯示本文所示的衍射圖中任一個的各個線條,和/或可能顯示由于涉及獲得數據的條件不同導致的在外觀、強度或所述線的位移上的稍微變化。本領域技術人員能夠通過比較它們的xrpd圖案確定,結晶化合物的樣品是否具有與本文公開形式相同的形式或不同的形式。例如,本領域技術人員可以將1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲游離堿的樣品的xrpd圖案與圖1重疊,并且使用本領域的專門技術和知識容易地確定樣品的xrpd圖案是否與本文公開的化合物a游離堿無水物的xrpd圖案實質上一致。如果該xrpd圖案與圖1實質上一致,則該樣品形式可以容易及精確地確定為與本文公開的化合物a游離堿無水物具有相同的形式。應當理解,當拉曼光譜包括的峰(以cm-1表示)在指定值的±5.0cm-1之內時,則該拉曼光譜包括本文所指定“約”值的峰。進一步,本領域技術人員還熟知且理解,所用的裝置、濕度、溫度、粉末晶體的取向及涉及獲得拉曼光譜的其它參數可以造成該光譜的外觀、強度和峰位置的某些變化。本領域技術人員應理解,與本文提供的圖2、6、10、14、18、22、26、30、34或38“實質上一致”的拉曼光譜為表示具有與提供圖2、6、10、14、18、22、26、30、34或38的拉曼光譜的化合物相同晶形的化合物的拉曼光譜。即,該拉曼光譜可能與圖2、6、10、14、18、22、26、30、34或38的相同,或者更可能其可能有些差異。這樣的拉曼光譜可能并不一定顯示本文所示的光譜中任一個的各個峰,和/或可能顯示由于涉及獲得數據的條件不同導致在外觀、強度或所述峰的位移上的稍微變化。本領域技術人員能夠通過比較它們的拉曼光譜確定,結晶化合物的樣品是否具有與本文公開的形式相同的形式或不同的形式。例如,本領域技術人員可以將1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲游離堿的樣品的拉曼光譜與圖2重疊,并且使用本領域的專門技術和知識容易地確定樣品的拉曼光譜是否與本文公開的化合物a游離堿無水物的拉曼光譜實質上一致。
式(i)-(xix)的化合物或其鹽可以以立體異構形式存在(例如,其含有一個或多個不對稱的碳原子)。所述單獨的立體異構體(對映異構體和非對映異構體)和這些混合物包括在本發明范圍內。本發明的范圍包括立體異構體混合物以及純化的對映異構體或對映異構體/非對映異構體富集的混合物。
同樣地,應當理解式(i)-(xix)化合物或其鹽可以以不同于化學式中所顯示的互變異構形式存在,這些也包括在本發明的范圍之內。例如,當式(i)-(xix)的化合物描述為含有吡啶-2-酮部分時,則該相應的2-羥基吡啶互變異構體也包括在本發明的范圍之內。應當理解本發明包括所有上文定義的特定基團的所有組合和子集。
本領域技術人員應理解,式(i)-(xix)的化合物的某些保護的衍生物,其可以在之前或最后脫保護階段之后制備,因而可以不具有藥理學活性,但是在某些情況下,可以以口服或腸胃外給藥,且之后在體內代謝以形成具有藥理學活性的本發明的化合物。因此,這樣的衍生物可以描述為“前藥”。進一步,本發明的某些化合物可以充當本發明的其它化合物的前藥。所有本發明的化合物的保護的衍生物和前藥都包括在本發明的范圍之內。
本發明化合物的合適的前藥的實例描述在drugsoftoday,volume19,number9,1983,pp499-538和topicsinchemistry,chapter31,pp306-316andin“designofprodrugs”byh.bundgaard,elsevier,1985,chapter1中。本領域技術人員還應當理解,當合適的官能團存在于本發明的化合物之內時,可以將本領域技術人員已知為"前體部分(pro-moieties)"的一些部分(例如h.bundgaard在"designofprodrugs"中描述的)置于合適的的官能團上。本發明的化合物的優選的"前體部分"包括:式(i)-(xix)化合物的酯、碳酸酯、半酯、磷酸酯、硝基酯、硫酸酯、亞砜、酰胺、氨基甲酸酯、偶氮(azo-)、磷酰胺、糖苷、醚、縮醛和縮酮衍生物。
給藥呈前藥的本發明的化合物可以使本領域技術人員進行以下中的一或多項:(a)修飾該化合物在體內的起始作用;(b)修飾該化合物在體內的作用持續時間;(c)修飾該化合物在體內的運輸或分布;(d)修飾該化合物在體內的溶解性;和(e)克服該化合物所遭遇的副作用或其他困難。
本發明還包括同位素標記的化合物,其與式(i)-(xix)中列舉的那些化合物相同,除了這個事實,即但是一個或多個原子被具有不同于自然界通常發現的該原子的原子質量或質量數的原子所替代。可摻入本發明的化合物及其藥學上可接受鹽的同位素的實例包括氫、碳、氮、氧、磷、硫、氟、碘和氯的同位素,比如2h、3h、11c、13c、14c、15n、17o、18o、31p、32p、35s、18f、36cl、123i和125i。
含有前述同位素和/或其他原子的其它同位素的本發明的化合物和所述化合物的藥學上可接受鹽都在本發明的范圍之內。同位素標記的本發明的化合物,例如將放射性同位素(比如3h或14c)摻入其中的那些化合物,用于藥物和/或底物組織分布測定。氚代的(即,3h)和碳-14(即,14c)同位素由于它們易于制備和檢測,因此是特別優選的。11c和18f同位素尤其用于pet(正電子發射斷層顯像),以及125i同位素尤其用于spect(單光子發射計算機化斷層顯像),它們全部用于腦成像。進一步,用較重同位素(比如氘,即,2h)的取代,因其更大的代謝穩定性,可提供一些治療優勢,例如增加的體內半衰期或降低的劑量需求,因此,在一些情況可能是優選的。同位素標記的式(i)的化合物和按照本發明的化合物通常可以通過下述進行制備:實施下述方案和/或實施例中公開的操作、用容易獲得的同位素標記試劑代替非同位素標記試劑。
定義
術語在其可接受的含義內使用。下述定義旨在闡明而非限定所定義的術語。
如本文使用的術語“烷基”代表飽和的、直鏈或支鏈烴部分。術語“(c1-c6)烷基”指含有1到6個碳原子的烷基部分。示例性的烷基包括,但不限于甲基、乙基、正-丙基、異丙基、正丁基、異丁基、仲丁基、叔丁基、戊基和己基。當術語“烷基”與其它取代基團組合比如“鹵代(c1-c4)烷基”或“羥基(c1-c4)烷基”使用時,該術語“烷基”旨在涵蓋二價直鏈或支鏈烴基,其中連接點是經由烷基部分。術語“鹵代(c1-c4)烷基”旨在指在含有1至4個碳原子的烷基部分(其為直鏈或支鏈碳基團)的一個或多個碳原子具有一個或多個可以相同或不同的鹵素原子的基團。用于本發明中的“鹵代(c1-c4)烷基”基團的實例包括,但不限于-chf2(二氟甲基)、-cf3(三氟甲基)、-ccl3(三氯甲基)、1,1-二氟乙基、2,2,2-三氟乙基、和六氟異丙基。用于本發明中的“羥基(c1-c4)烷基”基團的實例包括但不限于羥基甲基、羥基乙基和羥基異丙基。
“烷氧基”指含有由氧連接原子連接的上文定義的烷基的基團。術語“(c1-c4)烷氧基”指具有由氧連接原子連接的至少1個和至多4個碳原子的直鏈或支鏈烴基。用于本發明中的示例性的“(c1-c4)烷氧基”基團包括,但不限于甲氧基、乙氧基、正丙氧基、異丙氧基、正丁氧基、仲丁氧基、異丁氧基和叔丁氧基。
當術語“烷氧基”與其它取代基團組合使用時,比如“鹵代(c1-c6)烷氧基”、“羥基(c2-c4)烷氧基”或“(c1-c4)烷氧基(c2-c4)烷氧基”,術語“烷氧基”旨在涵蓋二價直鏈或支鏈烴基,其中連接點是經由氧連接原子的烷基部分。術語“鹵代(c1-c6)烷氧基”指具有至少1個且至多6個碳原子的與一個或多個碳原子連接的一個或多個鹵素原子(其可以相同或不同)的直鏈或支鏈烴基,其中該基團是經由氧連接原子連接。用于本發明的示例性的“鹵代(c1-c6)烷氧基”基團包括,但不限于-ochf2(二氟甲氧基)、-ocf3(三氟甲氧基)和-och(cf3)2(六氟異丙氧基)。用于本發明的“羥基(c2-c4)烷氧基”基團的實例包括,但不限于2-羥基乙氧基和2-羥基異丙氧基。用于本發明的“(c1-c4)烷氧基(c2-c4)烷氧基”基團的實例包括,但不限于2-甲氧基乙氧基、2-乙氧基乙氧基、2-異丙氧基乙氧基、2-甲氧基異丙氧基和2-乙氧基異丙氧基。
如本文使用的術語“環烷基”指含有指定碳原子數的非芳族、飽和、環狀的烴環。術語“(c3-c6)環烷基”指具有三至六個環碳原子的非芳族環烴環。用于本發明的示例性的"(c3-c6)環烷基"基團包括環丙基、環丁基、環戊基和環己基。
如本文使用的術語“環烷氧基-”指經由氧連接原子連接的含有上文定義的環烷基基團的基團。用于本發明的示例性的“(c3-c8)環烷氧基”基團包括環丙氧基、環丁氧基、環戊氧基、環己氧基、環庚氧基和環辛氧基。
如本文使用的“4-至6-元雜環烷基”代表包含非芳族、一價單環基團的基團或部分,其是飽和的或部分不飽和的,含有4、5或6個環原子,其包括一個或兩個獨立地選自氧、硫和氮的雜原子。用于本發明的4-至6-元雜環烷基基團的示例性的實例包括,但不限于氮雜環丁烷基、氧雜環丁烷基、吡咯烷基、吡唑烷基、吡唑啉基、咪唑烷基、咪唑啉基、噁唑啉基、噻唑啉基、四氫呋喃基、二氫呋喃基、1,3-二氧戊環基、哌啶基、哌嗪基、嗎啉基、硫代嗎啉基、四氫吡喃基、二氫吡喃基、1,3-二噁烷基、1,4-二噁烷基、1,3-氧硫雜環戊基、1,3-氧硫雜環己基(oxathianyl)、1,3-二噻烷基、1,4-氧硫雜環戊基、1,4-氧硫雜環己基和1,4-二噻烷基。
如本文使用的“5-或6-元雜芳基”代表包含芳族一價單環基團的基團或部分,含有5或6個環原子,包括至少一個碳原子和1至4個獨立地選自氮、氧和硫的雜原子。所選擇的5-元雜芳基基團含有一個氮、氧或硫環雜原子,且任選地含有1、2或3個另外的氮環原子。所選擇的6-元基團含有1、2或3個氮環雜原子。用于本發明的5-或6-元雜芳基基團的示例性的實例包括,但不限于呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噁唑基、噻唑基、異噁唑基、異噻唑基、噁二唑基、噻二唑基、吡啶基、噠嗪基、吡嗪基、嘧啶基和三嗪基。
術語“鹵素”和“鹵代”代表氯、氟、溴或碘取代基。“羥基(hydroxy)”或“羥基(hydroxyl)”旨在指基團-oh。如本文使用的術語“氰基”指基團-cn。
如本文使用的術語“任選取代的”指基團比如烷基、環烷基、苯基或雜芳基可以是未取代的或所述基團可以被一個或多個如定義的取代基取代。在其中基團可選自大量可替代基團的情況下,所選擇的基團可以相同或不同。
術語“獨立地”指其中多于一個取代基選自大量可能的取代基,那些取代基可以相同或不同。在整個說明書中用于提供的式(i)-(xix)的各種基團和取代基團的可替代的定義旨在分別地特別地描述本文公開的各個化合物種類,以及一種或多種化合物種類的基團。本發明的范圍包括這些基團和取代基團定義的任意組合。.
“藥學上可接受的(藥學可接受的)”指其在合理的醫學判斷范圍內,適于接觸人類和動物的組織而沒有過度毒性、刺激或其它問題或并發癥,與合理的益處/風險比相稱的那些化合物、物質、組合物和劑型。
如本文使用的術語“藥學上可接受鹽”指保留所述主題化合物期望的生物活性,并顯示出最小的不希望的毒理效應的鹽。這些藥學上可接受鹽可以在化合物的最后分離和純化過程中原位制備,或通過單獨地將其游離酸或游離堿形式的純化化合物分別與合適的堿或酸反應來制備。
藥物組合物
本發明進一步提供藥物組合物(也稱為藥物制劑),其包含式(i)-(xix)的化合物或其藥學上可接受鹽和一種或多種賦形劑(在藥學領域也稱為載體和/或稀釋劑)。從與制劑的其他成分相容以及對接受者(即患者)無害的意義上說,賦形劑是藥學上可接受的。
合適的藥學上可接受賦形劑包括下述類型的賦形劑:稀釋劑、填充劑、粘合劑、崩解劑、潤滑劑、助流劑、造粒劑、包衣劑、潤濕劑、溶劑、共溶劑、助懸劑、乳化劑、增甜劑、矯味劑、掩味劑、著色劑、抗結塊劑、保濕劑、螯合劑、增塑劑、增粘劑、抗氧劑、防腐劑、穩定劑、表面活性劑和緩沖劑。本領域技術人員應當理解一些藥學上可接受賦形劑可以提供一種以上的功能,且其可提供其他的功能,這取決于該賦形劑存在于制劑中的多少以及還有什么其他成分存在于該制劑中。.
本領域技術人員擁有本領域知識和技術,從而能夠選擇合適的量的合適的藥學上可接受賦形劑用于本發明。此外,本領域技術人員可獲得描述藥學上可接受賦形劑并可用于選擇合適的藥學上可接受的賦形劑的大量資源。實例包括remington'spharmaceuticalsciences(mackpublishingcompany),thehandbookofpharmaceuticaladditives(gowerpublishinglimited),andthehandbookofpharmaceuticalexcipients(theamericanpharmaceuticalassociationandthepharmaceuticalpress)。
使用本領域技術人員已知的技術和方法制備本發明藥物組合物。常用于本領域的一些方法描述在remington'spharmaceuticalsciences(mackpublishingcompany)中。
根據本發明的另一個方面,提供一種制備藥物組合物的方法,包括將式(i)-(xix)的化合物或其藥學上可接受鹽與至少一種賦形劑混合(或摻和)。
藥物組合物可以為每個單位劑量含有預定量的活性成分的單位劑量形式。這樣的單位可以含有治療有效劑量的式(i)-(xix)的化合物或其藥學上可接受鹽,或一定比例的治療有效劑量的式(i)-(xix)的化合物或其藥學上可接受鹽,從而在給定的時間可給藥多個單位劑量形式以達到期望的治療有效劑量。優選的單位劑量制劑是本文上述列舉的含有活性成分的每日劑量或亞劑量或其適當的比例的那些。此外,這樣的藥物組合物可以通過藥學領域熟知的任何方法制備。
藥物組合物可以適于通過任何合適的途徑給藥,例如,經口服(包括頰內或舌下)、直腸、鼻、局部(包括頰內、舌下或透皮)、陰道或胃腸外(包括皮下、肌內、靜脈內或皮內)途徑給藥。這樣的組合物可通過本領域已知的任何方法制備,例如,通過使活性成分與一種或多種賦形劑結合。
當適于口服給藥時,藥物組合物可以為離散單位比如片劑或膠囊劑、粉末或顆粒、在水性或非水性液體中的溶液或懸浮液、可食用泡沫或攪打劑(whip),或水包油型液體乳劑或油包水型液體乳劑。本發明的化合物或其鹽或本發明的藥物組合物也可被摻入到糖果、威化餅(wafer)和/或舌帶型(tonguetape)制劑中,用于作為“快速溶解”的藥物給藥。
例如,以片劑或膠囊劑形式的口服給藥,可以將活性藥物組分與口服的、無毒的藥學上可接受惰性載體比如乙醇、甘油、水等混合。粉末劑或顆粒劑是如下制備的:將化合物研磨至合適的微細尺寸,然后與經類似研磨的藥物載體比如可食用的碳水化合物(如例如淀粉或甘露醇)混合。矯味劑、防腐劑、分散劑和著色劑也可存在。
膠囊劑是如下制備的:如上所述制備粉末混合物,然后填充到成形的明膠或非明膠殼中。可以將助流劑和潤滑劑比如膠體二氧化硅、滑石、硬脂酸鎂、硬脂酸鈣、固體聚乙二醇加入到粉末混合物中,之后進行填充操作。也可以加入崩解劑或增溶劑比如瓊脂、碳酸鈣或碳酸鈉以改善膠囊劑被攝入時的藥物利用度。
而且,當期望或需要時,也可以將合適的粘合劑、潤滑劑、崩解劑和著色劑摻入到混合物中。合適的粘合劑包括淀粉、明膠、天然糖(比如葡萄糖或β-乳糖)、玉米甜味劑、天然膠和合成膠比如阿拉伯膠、西黃蓍膠、海藻酸鈉、羧甲基纖維素、聚乙二醇、蠟等。在這些劑型中使用的潤滑劑包括油酸鈉、硬脂酸鈉、硬脂酸鎂、苯甲酸鈉、乙酸鈉、氯化鈉等。崩解劑包括,但不限于淀粉、甲基纖維素、瓊脂、膨潤土、黃原膠等。
片劑是如下配制的:例如制備粉末混合物,制粒或預壓片,加入潤滑劑和崩解劑,然后壓制成片劑。粉末混合物是如下制備的:將經合適粉碎的化合物與如上所述稀釋劑或基質混合,以及與任選的粘合劑(比如羧甲基纖維素和海藻酸鹽、凝膠或聚乙烯吡咯烷酮)、溶液阻滯劑(比如石蠟)、吸收促進劑(比如季胺鹽)和/或吸收劑(比如膨潤土、高嶺土或磷酸二鈣)混合。粉末混合物可以如下制粒:潤濕粘合劑比如糖漿、淀粉糊、阿拉伯膠液、纖維素溶液或聚合物溶液,然后擠壓過篩。作為可選擇的制粒方法,粉末混合物可以通過壓片機來處理,導致不完全成形的預壓片破裂成顆粒。可以通過加入硬脂酸、硬脂酸鹽、滑石或礦物油的方式來對顆粒進行潤滑,以防止與片劑成形模粘連。然后,將潤滑的混合物壓制成片劑。本發明的化合物或鹽也可以與自由流動的惰性載體組合,并且在不經歷制粒或預壓片步驟的情況下直接壓制成片劑。可以提供由下述組成的透明的或不透明的保護性包衣:由蟲膠形成的隔離包衣層、由糖或聚合物形成的包衣層和由蠟形成的光亮包衣層。可以將染料加入到這些包衣中以區分不同的劑量。
口服流體比如溶液劑、糖漿劑和酏劑可以按劑量單位形式來制備,從而使給定的量含有預定量的活性成分。糖漿劑可以通過將本發明的化合物或其鹽溶于經合適矯味的水溶液中來制備,而酏劑通過使用無毒的含醇媒介物來制備。懸浮劑可以通過將本發明的化合物或其鹽分散在無毒的媒介物中來制備。也可以加入增溶劑和乳化劑(比如乙氧基化的異硬脂醇和聚氧乙烯山梨醇醚)、防腐劑、矯味添加劑(比如薄荷油、天然甜味劑、糖精或其它人造甜味劑)等。
當合適時,可以對用于口服給藥的劑量單位制劑進行微囊化。也可以例如通過將顆粒物質包衣或包埋到聚合物、蠟等中來制備制劑,以延長或維持釋放。
在本發明中,對于遞送藥物組合物而言,片劑和膠囊劑是優選的。
在一些實施方案中,本發明涉及包含1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿的藥物組合物。在另一個實施方案中,本發明涉及包含1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿的藥物組合物,其中至少10%重量的1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿以本文所述的化合物a游離堿無水物存在。在另一個實施方案中,本發明涉及包含1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿的藥物組合物,其中至少20%重量、或至少30%重量、或至少40%重量、或至少50%重量、或至少60%重量、或至少70%重量、或至少80%重量、或至少90%重量的1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿以本文所述化合物a游離堿無水物存在。在另一個實施方案中,本發明涉及包含1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿的藥物組合物,其中至少95%重量、或至少96%重量、或至少97%重量、或至少98%重量、或至少99%重量、或至少99.5%重量、或至少99.8%重量、或至少99.9%重量的1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿以本文所述化合物a游離堿無水物存在。
在另一個實施方案中,本發明涉及包含1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿的藥物組合物,其中不超過90%重量的所述游離堿是非晶形的。在另一個實施方案中,本發明涉及包含1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿的藥物組合物,其中不超過80%重量、或不超過70%重量、或不超過60%重量、或不超過50%重量、或不超過40%重量、或不超過30%重量、或不超過20%重量、或不超過10%重量的游離堿為非晶形的。在另一個實施方案中,本發明涉及包含1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿的藥物組合物,其中不超過5%重量、或不超過4%重量、或不超過3%重量、或不超過2%重量、或不超過1%重量、或不超過0.5%重量、或不超過0.2%重量、或不超過0.1%重量的所述游離堿為非晶形的。
在另一個實施方案中,本發明涉及包含1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿的藥物組合物,其中不超過90%重量的1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿以不同于本文所述化合物a游離堿無水物的形式存在。在另一個實施方案中,本發明涉及包含1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿的藥物組合物,其中不超過80%重量、或不超過70%重量、或不超過60%重量、或不超過50%重量、或不超過40%重量、或不超過30%重量、或不超過20%重量、或不超過10%重量的的1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿以不同于本文所述的化合物a游離堿無水物的形式存在。在另一個實施方案中,本發明涉及包含1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿的藥物組合物,其中不超過5%重量、或不超過4%重量、或不超過3%重量、或不超過2%重量、或不超過1%重量、或不超過0.5%重量、或不超過0.2%重量、或不超過0.1%重量的的1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的游離堿以不同于本文所述的化合物a游離堿無水物的形式存在。
如本文使用的術語“治療”指在先前患有或被診斷的患者或受試者中減輕具體的病癥,消除或減少所述病癥的一種或多種癥狀,減慢或消除所述病癥的進展以及預防或延遲所述病癥的復發。
本發明提供一種治療患有下述病癥的哺乳動物(特別是人類)的方法:腸易激綜合征(ibs),包括腹瀉主導型、便秘主導型或交替排便模式、功能性胃氣脹、功能性便秘、功能性腹瀉、非特異性功能性腸病、功能性腹痛綜合征、慢性特發性便秘、功能性食管病、功能性胃十二指腸病、功能性肛門直腸疼痛、炎性腸病、增殖性疾病例如非小細胞肺癌、肝細胞癌、結直腸癌、甲狀腺髓樣癌、濾泡性甲狀腺癌、未分化甲狀腺癌、乳頭狀甲狀腺癌、腦瘤、腹膜腔癌、實體瘤、其它肺癌、頭頸癌、神經膠質瘤、神經母細胞瘤、vonhipple-lindau綜合征和腎腫瘤、乳腺癌、輸卵管癌、卵巢癌、過渡型細胞癌、前列腺癌、食道和食管胃連接處的癌癥、膽道癌和腺癌、或其組合。這樣的治療包括向所述哺乳動物(例如人類)給藥治療有效量的式(i)-(xix)的化合物或其藥學上可接受鹽的步驟。治療還包括以下步驟:向所述哺乳動物(特別是人類)給藥治療有效量的含有式(i)-(xix)的化合物或其藥學上可接受鹽的藥物組合物。
如本文使用的術語"有效量"指引發例如研究人員或臨床醫師尋求的組織、系統、動物或人的生物學或醫學響應的藥物或藥劑的量。
術語“治療有效量”指與未接受所述量的相應受試者相比,使疾病、病癥或副反應得到改善的治療、治愈、預防或緩解,或降低疾病或病癥的進展速度的任何量。該術語還在其范圍內包括有效增強正常生理功能的量。對于治療中使用,治療有效量的式(i)-(xix)的化合物以及其鹽可以作為化學原料(rawchemical)的形式給藥。另外,活性成分可以作為藥物組合物存在。對于治療中使用,盡管治療有效量的式(i)-(xix)化合物或其藥學上可接受鹽可以作為化學原料的形式給藥是可能的,但其通常作為藥物組合物或制劑的活性成分存在。
本發明的化合物或其鹽的精確的治療有效量將取決于多種因素,包括但不限于,待治療的受試者(患者)的年齡和體重、需要治療的精確病癥及其嚴重性、藥物制劑/組合物的性質,以及給藥途徑,并且最終將由主治醫師或獸醫判斷決定。通常,給予治療的式(i)-(xix)的化合物或其藥學上可接受鹽的范圍為每天約0.1至100mg/kg接受者(患者,哺乳動物)的體重,更通常地范圍為每天0.1至10mg/kg體重。可接受的日劑量可以為約0.1至約1000mg/天,以及優選地約1至約100mg/天。該量可以以每天的單次劑量給予或以每天數次(比如2、3、4、5或更多)亞劑量給予,從而使得總日劑量是相同的。鹽的有效量可以按照式(i)-(xix)的化合物本身有效量的一定比例來確定。用于治療的類似的劑量對于治療本文提及的其他病癥而言應當是適合的。通常,適合劑量的確定可以容易地由醫學或藥學領域的技術人員獲得。
本發明的化合物可以單獨使用或與一種或多種其他治療劑組合使用。因此,本發明提供一種組合,其包含式(i)-(xix)的化合物或其藥學上可接受鹽以及一或多種其他治療劑。這樣的組合可單獨存在(其中各活性物質在單獨的組合物中)或該活性物質以組合的組合物存在。
本發明的化合物可以與其他治療劑,特別是可提高該化合物活性或處置時間(timeofdisposition)的藥劑組合或共同給藥。根據本發明的組合療法包括施用至少一種本發明化合物以及使用至少一種其他治療方法。在一個實施方案中,根據本發明的組合療法包括施用至少一種本發明的化合物和外科手術療法。在一個實施方案中,根據本發明的組合療法包括施用至少一種本發明的化合物和放射療法。在一個實施方案中,根據本發明的組合療法包括施用至少一種本發明化合物和至少一種支持療法試劑(例如,至少一種鎮吐藥)。在一個實施方案中,根據本發明的組合療法包括施用至少一種本發明的化合物以及至少一種其他化療劑。在一個具體的實施方案中,本發明包括施用至少一種本發明的化合物和至少一種抗腫瘤劑。在仍然另一個實施方案中,本發明包括一種治療方案,其中本公開的ret抑制劑本身并不是有活性的或活性不顯著,但當其與其他療法(作為單獨療法可能有活性也可能沒有活性)組合時,該組合提供有用的治療結果。
如本文使用的術語“共同給藥”及其衍生詞指同時給藥或以任意單獨依次的方式給藥如本文所述的ret抑制化合物和其他的活性成分,特別是已知用于治療癌癥(包括化療和放療治療)的那些組分。如本文使用的術語其他活性成分包括已知或證實當給藥至需要治療癌癥的患者時展示出有益的性質的任意化合物或治療劑。優選地,如果該給藥不是同時的,則該化合物是在彼此接近的時間進行給藥的。此外,無論該化合物是否以同一劑型給藥都不重要,例如一種化合物可以局部給藥而另一種化合物可以口服給藥。
通常,對治療的敏感性(susceptible)腫瘤具有活性的任何抗腫瘤劑都可以在本發明具體癌癥治療中共同給藥。這樣的試劑的實例可以在cancerprinciplesandpracticeofoncologybyv.t.devitaands.hellman(editors),6thedition(february15,2001),lippincottwilliams&wilkinspublishers中找到。本領域技術人員能夠根據藥物與所涉及癌癥的具體特征鑒別有用的藥劑組合。用于本發明的典型抗腫瘤藥物包括,但不限于:抗微管劑,比如二萜類化合物和長春花生物堿;鉑配位絡合物;烷化劑,比如氮芥(nitrogenmustard)、氧氮磷環類(oxazaphosphorine)、烷基磺酸鹽、亞硝基脲和三氮烯;抗生素試劑,比如蒽環類抗生素(anthracyclin)、放線菌素和博來霉素;拓撲異構酶ii抑制劑,比如表鬼臼毒素;抗代謝劑,比如嘌呤和嘧啶類似物和抗葉酸化合物;拓撲異構酶i抑制劑,比如喜樹堿;激素和激素類似物;dna甲基轉移酶抑制劑,比如阿扎胞苷和地西他濱;信號轉導途徑抑制劑;非受體酪氨酸激酶血管生成抑制劑;免疫治療劑;促凋亡劑;和細胞周期信號抑制劑。
通常,對所治療的敏感性瘤具有活性的任意化療劑都可以與本發明的化合物組合使用,條件是該具體試劑與采用本發明的化合物的療法在臨床上相容。用于本發明的典型抗腫瘤劑包括,但不限于:烷化劑、抗代謝藥、抗腫瘤抗生素、抗有絲分裂劑、核苷類似物、拓撲異構酶i和ii抑制劑、激素和激素類似物;類視黃醇,組蛋白脫乙酰基酶抑制劑;信號轉導通路抑制劑,包括細胞生長或生長因子功能的抑制劑、血管生成抑制劑和絲氨酸/蘇氨酸或其他激酶抑制劑;細胞周期蛋白依賴性激酶抑制劑;反義療法和免疫治療劑,包括單克隆抗體、疫苗或其他生物制劑。
核苷類似物是轉化成三磷酸脫氧核苷酸并代替胞嘧啶并入到復制的dna中的那些化合物。dna甲基轉移酶共價結合至該修飾的堿基上,導致酶失活以及降低的dna甲基化。核苷類似物的實例包括阿扎胞苷和地西他濱,其都用于治療骨髓增生異常疾病。組蛋白脫乙酰基酶(hdac)抑制劑包括伏立諾他,用于治療皮膚t細胞淋巴瘤。hdac通過組蛋白脫乙酰基作用來修飾染色質。另外,它們具有各種作用底物,包括各種轉錄因子和信號分子。其他hdac抑制劑正在研發中。
信號轉導通路抑制劑是阻斷或抑制化學過程的那些抑制劑,所述化學過程引起細胞內變化。如本文使用的,所述變化是細胞增殖或分化或存活。用于本發明的信號轉導通路抑制劑包括,但不限于,受體酪氨酸激酶、非受體酪氨酸激酶、sh2/sh3結構域阻斷劑、絲氨酸/蘇氨酸激酶、磷脂酰肌醇-3-oh激酶、肌醇信號傳導和ras癌基因的抑制劑。信號轉導通路抑制劑可以與上述組合物和方法中的本發明的化合物組合使用。
受體激酶血管生成抑制劑也可以用于本發明中。涉及vegfr和tie-2的血管生成抑制劑在上述針對信號傳導抑制劑(兩者都是受體酪氨酸激酶)中進行了討論。其它抑制劑可以與本發明的化合物組合使用。例如,抗vegf抗體,其不識別vegfr(受體酪氨酸激酶),但結合配體;整聯蛋白(αvβ3)的小分子抑制劑,其抑制血管生成;內皮他丁和血管他丁(非-rtk)也被證明可用于與本發明的化合物組合。vegfr抗體的一個實例是貝伐單抗
生長因子受體的多種抑制劑正在研發中,且包括配體拮抗劑、抗體、酪氨酸激酶抑制劑、反義寡核苷酸和適體。任意這些生長因子受體抑制劑都可以與本發明的化合物組合用于本文所述的任意組合物和方法/用途中。曲妥珠單抗
抗微管或抗有絲分裂劑是時相特異性試劑(phasespecificagent),其在細胞周期中的m期或有絲分裂期對腫瘤細胞的微管具有活性。抗微管劑的實例包括,但不限于二萜類化合物(diterpenoid)和長春花生物堿(vincaalkaloid)。
天然來源的二萜類化合物是時相特異性的抗癌劑,其在細胞周期中的g2/m期起作用。據信二萜類化合物通過與該蛋白結合,使微管的β-微管蛋白亞基穩定。然后使蛋白的分解受到抑制,有絲分裂停止,接著發生細胞死亡。二萜類化合物的實例包括,但不限于紫杉醇(paclitaxel)及其類似物多西他賽。
紫杉醇,5β,20-環氧-1,2α,4,7β,10β,13α-六羥基紫杉-11-烯-9-酮4,10-二乙酸酯2-苯甲酸酯13-(2r,3s)-n-苯甲酰基-3-苯基異絲氨酸酯;是一種從太平洋紫杉樹短葉紫杉(taxusbrevifolia)中分離出來的天然二萜產物,且作為可注射的溶液
在美國,已經批準了紫杉醇的臨床用途,用于治療難治性卵巢癌(markmanetal.,yalejournalofbiologyandmedicine,64:583,1991;mcguireetal.,ann.int.med.,111:273,1989)和用于治療乳腺癌(holmesetal.,j.nat.cancerinst.,83:1797,1991.)。其為一種用于治療皮膚癌(einziget.al.,proc.am.soc.clin.oncol.,20:46)和頭頸癌(forastireet.al.,sem.oncol.,20:56,1990)的可能的候選藥物。該化合物還具有治療多囊性腎病(wooet.al.,nature,368:750,1994)、肺癌和瘧疾的潛力。采用紫杉醇治療患者,導致骨髓抑制(多重細胞譜系(multiplecelllineage),ignoff,r.j.et.al,cancerchemotherapypocketguide,1998),這與高于閾濃度(50nm)的給藥的持續時間有關(kearns,c.m.et.al.,seminarsinoncology,3(6)p.16-23,1995)。
多西他賽,(2r,3s)-n-羧基-3-苯基異絲氨酸n-叔丁基酯,13-酯與5β-20-環氧-1,2α,4,7β,10β,13α-六羥基紫杉-11-烯-9-酮4-乙酸酯2-苯甲酸酯,三水合物;以
長春花生物堿(vincaalkaloids)是來源于長春花屬植物的時相特異性的抗腫瘤劑。長春花生物堿通過特異性地結合微管蛋白而在細胞周期的m期(有絲分裂)起作用。因此,被結合的微管蛋白分子不能聚合成微管。有絲分裂被認為在中期被停止,隨后細胞死亡。長春花生物堿的實例包括,但不限于長春堿、長春新堿和長春瑞濱。.
長春堿(vinblastine),長春堿硫酸鹽,以
長春新堿(vincristine),長春堿22-氧代-硫酸鹽,以
長春瑞濱,3',4'-二脫氫-4'-脫氧-c'-去甲長春堿(norvincaleukoblastine)[r-(r*,r*)-2,3-二羥基丁二酸二酯(1:2)(鹽)],以長春瑞濱酒石酸鹽注射溶液
鉑配位絡合物是非時相特異性的抗癌劑,其與dna相互作用。鉑絡合物進入腫瘤細胞,進行水合作用,并與dna形成鏈內和鏈之間的交聯,導致對腫瘤不利的生物學作用。鉑配位絡合物的實例包括但不限于順鉑和卡鉑。
順鉑,順式-二氨二氯合鉑,以
卡鉑,二氨[1,1-環丁烷-二羧酸根(2-)-o,o']合鉑,以
烷化劑是非時相特異性抗癌藥劑和強親電試劑。通常,烷化劑借助于烷基化作用,通過dna分子的親核部分比如磷酸基(phosphate)、氨基、巰基、羥基、羧基和咪唑基,與dna形成共價鍵。這樣的烷基化作用破壞核酸功能,導致細胞死亡。烷化劑的實例包括,但不限于氮芥,比如環磷酰胺、美法侖和苯丁酸氮芥;磺酸烷基酯,比如白消安;亞硝基脲,比如卡莫司汀;以及三氮烯,比如達卡巴嗪。
環磷酰胺,2-[雙(2-氯乙基)氨基]四氫-2h-1,3,2-氧氮磷雜環己二烯(oxazaphosphorine)2-氧化物一水合物,以
美法侖,4-[雙(2-氯乙基)氨基]-l-苯基丙氨酸,以
苯丁酸氮芥,4-[雙(2-氯乙基)氨基]苯丁酸,以
白消安,1,4-丁二醇二甲磺酸酯,以
卡莫司汀,1,3-[雙(2-氯乙基)-1-亞硝基脲,以
達卡巴嗪,5-(3,3-二甲基-1-三氮烯基)-咪唑-4-甲酰胺,以
抗生素類抗腫瘤劑(antibioticanti-neoplastics)是非時相特異性的藥劑,其結合或嵌入dna中。通常,這種作用導致穩定的dna復合物或鏈斷裂,破壞核酸的正常功能,導致細胞死亡。抗生素類抗腫瘤劑的實例包括但不限于放線菌素(比如更生霉素),蒽環類(anthrocyclins)(比如柔紅霉素和多柔比星);以及博來霉素。
更生霉素,也稱為放線菌素d,以
柔紅霉素,(8s-順式-)-8-乙酰基-10-[(3-氨基-2,3,6-三脫氧基α-l-來蘇-己吡喃糖基)-氧基]-7,8,9,10-四氫-6,8,11-三羥基-1-甲氧基-5,12-并四苯二酮鹽酸鹽,以
多柔比星,(8s,10s)-10-[(3-氨基-2,3,6-三脫氧-α-l-來蘇-己吡喃糖基)氧基]-8-乙醇酰基-7,8,9,10-四氫-6,8,11-三羥基-1-甲氧基-5,12-并四苯二酮鹽酸鹽,以
博來霉素,是從輪絲鏈霉菌(streptomycesverticilus)菌株中分離出來的細胞毒素糖肽類抗生素的混合物,以
拓撲異構酶ii抑制劑包括但不限于表鬼臼脂毒素。
表鬼臼脂毒素是來源于曼德拉草(mandrake)植物的時相特異性的抗腫瘤藥物。表鬼臼脂毒素通常通過與拓撲異構酶ii和dna形成三元復合物,來影響處于細胞周期的s和g2期的細胞,導致dna鏈斷裂來。鏈斷裂積聚,接著細胞死亡。表鬼臼脂毒素的實例包括但不限于依托泊苷和替尼泊苷。
依托泊苷,4'-去甲基-表鬼臼脂毒素9[4,6-0-(r)-亞乙基-β-d-吡喃葡萄糖苷],以
替尼泊苷,4'-去甲基-表鬼臼脂毒素9[4,6-0-(r)-噻吩亞甲基-β-d-吡喃葡萄糖苷],以
抗代謝腫瘤藥劑是時相特異性的抗腫瘤藥劑,其作用于細胞周期的s期(dna合成),通過抑制dna的合成,或者通過抑制嘌呤或嘧啶堿基的合成從而限制dna的合成。因此,s期不能繼續下去,接著細胞死亡。抗代謝類抗腫瘤藥劑的實例包括,但不限于氟尿嘧啶、甲氨蝶呤、阿糖胞苷、巰基嘌呤、硫鳥嘌呤和吉西他濱。
5-氟尿嘧啶,5-氟-2,4-(1h,3h)嘧啶二酮,以氟尿嘧啶市售可獲得。5-氟尿嘧啶的給藥導致胸苷酸合成的抑制,并且還結合到rna和dna中。結果通常是細胞死亡。5-氟尿嘧啶指定作為單獨的藥劑或與其它化療劑組合,用于治療乳腺癌、結腸癌、直腸癌、胃癌和胰腺癌。骨髓抑制和粘膜炎是5-氟尿嘧啶的劑量限制性副作用。其它的氟嘧啶類似物包括5-氟脫氧尿嘧啶核苷(氟尿苷)和5-氟脫氧尿嘧啶核苷單磷酸鹽。
阿糖胞苷,4-氨基-1-β-d-阿拉伯呋喃糖基-2(1h)-嘧啶酮,以
巰基嘌呤,1,7-二氫-6h-嘌呤-6-硫酮一水合物,以
硫鳥嘌呤,2-氨基-1,7-二氫-6h-嘌呤-6-硫酮,以
吉西他濱,2'-脫氧-2',2'-二氟胞苷一鹽酸鹽(β-異構體),以
甲氨蝶呤,n-[4[[(2,4-二氨基-6-蝶啶基)甲基]甲基氨基]苯甲酰基]-l-谷氨酸,以甲氨蝶呤鈉市售可獲得。甲氨蝶呤在s-期顯示出細胞時相特異性作用,其通過抑制合成嘌呤核苷酸和胸苷酸所需的脫氫葉酸還原酶來抑制dna的合成、修復和/或復制。甲氨蝶呤指定作為單獨的藥劑或與其它化療劑組合,用于治療絨毛膜癌、腦膜白血病、非霍奇金淋巴瘤,以及乳腺癌、頭癌、頸癌、卵巢癌和膀胱癌。預期骨髓抑制(白細胞減少癥、血小板減少癥和貧血)和粘膜炎是給藥甲氨蝶呤的副作用。
喜樹堿(camptothecins),包括喜樹堿和喜樹堿衍生物,作為拓撲異構酶i抑制劑來使用或在開發中。喜樹堿細胞毒素活性被認為與其拓撲異構酶i抑制活性相關。喜樹堿的實例包括,但不限于伊立替康、托泊替康,以及如下所述7-(4-甲基哌嗪基-亞甲基)-10,11-亞乙二氧基-20-喜樹堿的各種光學形式。
鹽酸伊立替康(irinotecanhcl),(4s)-4,11-二乙基-4-羥基-9-[(4-哌啶基哌啶基)羰基氧基]-1h-吡喃并[3',4',6,7]中氮茚并[1,2-b]喹啉-3,14(4h,12h)-二酮鹽酸鹽,以
伊立替康是喜樹堿的衍生物,其與其活性代謝物sn-38一起結合拓撲異構酶i-dna復合物。據信由于雙鏈不可修復的(irreparable)斷裂,導致出現細胞毒性,所述斷裂是由拓撲異構酶i:dna:伊立替康或sn-38三元復合物與復制酶之間的相互作用引起的。伊立替康指定用于治療結腸或直腸的轉移癌。鹽酸伊立替康的劑量限制性副作用是骨髓抑制,包括嗜中性白細胞減少癥,以及包括腹瀉的gi效應。
鹽酸托泊替康(topotecanhcl),(s)-10-[(二甲基氨基)甲基]-4-乙基-4,9-二羥基-1h-吡喃并[3',4',6,7]中氮茚并[1,2-b]喹啉-3,14-(4h,12h)-二酮一鹽酸鹽,以
化合物的制備
通用合成方案
本發明的化合物可以通過多種方法制備,包括熟知的標準合成方法。下述列出了示例性的通用合成方法,然后在實施例中制備了本發明的特定化合物。本領域技術人員應當理解,如果本文所述取代基與本文所述合成方法不相容,則可以用對于反應條件穩定的的合適的保護基保護該取代基。可以在反應順序中合適的點去除保護基,得到期望的中間體或目標化合物。在如下所述的所有方案中,當根據合成化學的一般原則必需時,采用用于敏感基團或反應性基團的保護基(t.w.greenandp.g.m.wuts,(1991)protectinggroupsinorganicsynthesis,johnwiley&sons,通過引用并入其中關于保護基的內容)。在化合物合成的方便階段,使用對于本領域那些技術人員容易顯而易見的方法去除這些基團。工藝以及反應條件和它們的實施順序的選擇應當與本發明的化合物的制備相一致。
通式(i)的化合物及其藥學上可接受衍生物和鹽的合成可以由本領域技術人員按照如下方案1-5中所列的實現。在下述說明書中,除非另有說明,否則各基團為如上對于式(i)的化合物定義的。起始材料為市售可獲得的,或使用本領域技術人員已知的方法由市售可獲得的起始材料制備。
式(ii)的化合物可以如方案1所示制備。在鈀偶合條件下,比如采用pdcl2(dppf)和cs2co3,合適取代的芳基溴脲中間體a可以與硼酸酯中間體b偶合,得到中間體c。對甲氧基芐基(pmb)或芐基(bn)部分的脫保護可以在h2氣氛下或在酸性條件下(比如采用tfa或hcl)在鈀碳的存在下實現,得到式(ii)的化合物。
方案1
中間體c也可以如方案2示例制備。在鈀偶合條件下,比如采用pdcl2(dppf)和cs2co3,合適取代的吡啶基(或嘧啶基)溴化物中間體d可以與硼酸(或硼酸酯)脲中間體e偶合,得到中間體c。類似于方案1中的條件,可以將中間體c進一步轉化成式(ii)的化合物。可選地,按照方案2的方法,通過使用未保護的中間體d的變體,可以直接制備式(ii)的化合物。
方案2
中間體c也可以如方案3示例制備。在合適的條件下,比如采用pdcl2(dppf)和cs2co3,芳基溴f可以與硼酸酯中間體b偶合,得到中間體g,然后其可以與合適取代的異氰酸酯偶合,得到脲中間體c。可選地,采用合適的試劑比如三光氣,可以將中間體g轉化成異氰酸酯,然后與合適取代的胺偶合,得到脲中間體c。類似于方案1中的條件,可以將中間體c進一步轉化成式(ii)的化合物。
方案3
也可以如方案4示例制備中間體c。采用合適的試劑比如dppa,可以將合適取代的酸h轉化成異氰酸酯,然后與合適取代的胺偶合,得到脲中間體c。類似于方案1中的條件,可以將中間體c進一步轉化成式(ii)的化合物。
方案4
可以如方案5示例制備式(iii)的化合物。合適取代的羥基吡啶i可以與硝基化合物j偶合,得到醚,然后在合適的條件下,比如采用在甲醇中的鋅,其可以被還原,得到苯胺中間體k。中間體k可以與合適取代的異氰酸酯偶合,或者用合適的試劑比如三光氣轉化成異氰酸酯,然后與合適取代的胺偶合,得到脲中間體l。對甲氧基芐基(pmb)或芐基(bn)部分的脫保護可以在h2氣氛下或在酸性條件下(比如采用tfa或hcl)在鈀碳的存在下實現,得到式(iii)的化合物。
方案5
試驗例
下述實施例說明本發明。這些實施例并非旨在限制本發明的范圍,而是為本領域技術人員提供關于制備和使用本發明的化合物、組合物和方法的指導。雖然描述了本發明的特定的實施方案,但是本領域技術人員應當理解,在不背離本發明的精神和范圍的情況下,可以作出各種變化和修飾。除非另有說明,否則試劑是市售可獲得的或根據文獻中的方法制備的。在描述方法、方案和實施例時使用的符號和慣例與當代科學文獻例如thejournaloftheamericanchemicalsociety或thejournalofbiologicalchemistry中使用的那些一致。
在實施例中∶
化學位移是以百萬分率(ppm)單位表示。偶合常數(j)的單位是赫茲(hz)。分裂模式描述了表觀多重性(apparentmultiplicities),且被稱為s(單峰)、d(雙峰)、t(三重峰)、q(四重峰)、dd(雙二重峰)、dt(雙三重峰)、dq(雙四重峰)、m(多重峰)、br(寬峰)。
快速柱色譜在硅膠上進行。
所使用的命名程序是acdlabs11.0namebatch,acdiupac,or
縮寫
ac2o乙酸酐
acoh乙酸
bh3·dms硼烷二甲基硫復合物
bh3·thf硼烷四氫呋喃復合物
bn芐基
boc2o二-叔丁基二碳酸酯
cdcl3氯仿-d
cd3od甲醇-d4
cs2co3碳酸銫
dast二乙氨基三氟化硫
dcm二氯甲烷
dibal-h二異丁基氫化鋁
diea二異丙基乙胺
dmap4-二甲基氨基吡啶
dmfn,n-二甲基甲酰胺
dmso-d6二甲亞砜-d6
dppa二苯基磷酰基疊氮化物
ea乙酸乙酯
edc1-乙基-3-(3-二甲基氨基丙基)碳二亞胺
es-lcms電噴霧液相色譜-質譜
eti碘乙烷
et3n三乙胺
etoh乙醇
g克
h小時
h2氫氣
hatuo-(7-氮雜苯并三唑-1-基)-n,n,n′,n′-四甲基脲鎓六氟磷酸酯
hbr溴化氫
hcl鹽酸
h2o水
h2o2過氧化氫
hobt羥基苯并三唑
hplc高效液相色譜
h3po2次膦酸
h2so4硫酸
invacuo在真空下
k2co3碳酸鉀
koac乙酸鉀
koh氫氧化鉀
lah氫化鋁鋰
lcms液相色譜-質譜
lioh氫氧化鋰
lioh·h2o氫氧化鋰水合物
m-cpba間-氯過氧苯甲酸
mecn乙腈
mei碘代甲烷
memgbr溴化甲基鎂
meoh甲醇
mg毫克
mgso4硫酸鎂
min分鐘
ml毫升
mmol毫摩爾
n2氮氣
nabh4硼氫化鈉
nabh(oac)3三乙酰氧基硼氫化鈉
na2co3碳酸鈉
nah氫化鈉
nahco3碳酸氫鈉
nai碘化鈉
naio4高碘酸鈉
nano2亞硝酸鈉
naoet乙醇鈉
naoh氫氧化鈉
na2so4硫酸鈉
nbsn-溴代琥珀酰亞胺
n-buli正丁基鋰
nh4cl氯化銨
(nh4)hco3碳酸氫銨
nh4oac乙酸銨
nh4oh氫氧化銨
nisn-碘琥珀酰亞胺
nmr核磁共振
pd/c鈀碳
pdcl2(dppf)1,1'-雙(二苯膦基)二茂鐵]二氯鈀(ii)
pdcl2(pph3)2雙(三苯基膦)二茂鐵]二氯鈀(ii)
pd2(dba)3三(雙亞芐基丙酮)雙鈀(0)
pe石油醚
pmb對-甲氧基芐基
pocl3三氯氧磷
rt室溫
sncl2·h2o氯化錫(ii)水合物
socl2亞硫酰氯
tbme叔丁基甲基醚
tbs叔丁基二甲基甲硅烷基
tbscl叔丁基二甲基甲硅烷基氯
tfa三氟乙酸
tfaa三氟乙酸酐
thf四氫呋喃
tlc薄層色譜
中間體的制備
中間體1:3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷(dioxaborolan)-2-基)吡啶
步驟1:3-溴-5-乙氧基吡啶
在25℃下,攪拌5-溴吡啶-3-醇(70g,402mmol)、k2co3(111g,805mmol)和eti(69.0g,443mmol)在dmf(700ml)中的溶液16小時。然后,濃縮該混合物,用水稀釋,用dcm(2×200ml)萃取,經na2so4干燥并濃縮,得到3-溴-5-乙氧基吡(53g,218mmol,產率54.2%):1hnmr(400mhz,cd3od)δ8.19-8.17(m,2h),7.60-7.59(m,1h),4.13-4.07(m,2h),1.40(t,j=7.0hz,3h);es-lcmsm/z202(m+h)。
步驟2:3-溴-5-乙氧基吡啶1-氧化物
經30分鐘,向在0℃下3-溴-5-乙氧基吡啶(53g,262mmol)在dcm(200ml)中的溶液中慢慢地加入m-cpba(67.9g,393mmol)。在攪拌得到的溶液15小時之后,將該混合物用nas2o3溶液洗滌,并用dcm(2×300ml)萃取,經na2so4干燥,并濃縮有機相,得到3-溴-5-乙氧基吡啶1-氧化物(40g,165mmol,62.9%yield):1hnmr(400mhz,cd3od)δ8.19-8.18(m,1h),8.08-8.07(m,1h),7.50-7.49(m,1h),4.17-4.15(d,j=8.8hz,2h),1.43(t,j=7.0hz,3h);es-lcmsm/z217(m+h)。
步驟3:5-溴-2-氯-3-乙氧基吡啶
經30分鐘,向在0℃下3-溴-5-乙氧基吡啶1-氧化物(40g,183mmol)在dcm(200ml)中的溶液中慢慢地加入pocl3(159ml,1701mmol)。然后,使得到的溶液升溫至45℃15小時。濃縮該混合物,并用dcm(2×200ml)萃取,經na2so4干燥并濃縮,得到5-溴-2-氯-3-乙氧基吡啶(30g,60.9mmol,產率33.2%):1hnmr(400mhz,cd3od)δ8.00-7.99(d,j=2.0hz,1h),7.65-7.64(d,j=2.0hz,1h),4.17-4.12(m,2h),1.44(t,j=7.0hz,2h);es-lcmsm/z235(m+h)。
步驟4:5-溴-3-乙氧基-2-((4-甲氧基芐基)氧基)吡啶
在0℃下,向(4-甲氧基苯基)甲醇(16.71g,121mmol)在dmf(200ml)中的混合物中加入nah(3.96g,165mmol)。在攪拌該混合物30分鐘之后,向上述混合物中加入5-溴-2-氯-3-乙氧基吡啶(26g,110mmol),并在80-90℃下,攪拌該混合物12小時。用h2o(20ml)淬滅該混合物,用dcm(2×200ml)萃取,經na2so4干燥,過濾,濃縮,并經由柱色譜(10%ea/90%pe,360g硅膠柱)純化。合并通過tlc(ea/pe=5:1,rf=0.5)發現包含產物的所有級分,并濃縮,得到白色固體的5-溴-3-乙氧基-2-((4-甲氧基芐基)氧基)吡啶(36g,74.5mmol,產率67.8%):1hnmr(400mhz,cd3od)δ7.71(d,j=2.0hz,1h),7.36-7.31(m,3h),6.89-6.87(m,2h),5.27(s,2h),4.05-4.00(m,2h)3.77(s,3h),2.37(d,j=7.0hz,3h);es-lcmsm/z338(m+h)。
步驟5:3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶
在20℃下,在n2下,向攪拌的5-溴-3-乙氧基-2-((4-甲氧基芐基)氧基)吡啶(10g,29.6mmol),4,4,4',4',5,5,5',5'-八甲基-2,2'-雙(1,3,2-二氧雜硼雜環戊烷)(8.26g,32.5mmol)和koac(7.25g,73.9mmol)在1,4-二噁烷(250ml)中的溶液中一次性加入pdcl2(dppf)(1.082g,1.478mmol)。在100℃下,攪拌反應混合物3小時。過濾該混合物,并在真空中濃縮濾液,然后通過硅膠柱色譜(pe/ea=10:1)純化。合并通過tlc(pe/ea=10:1,rf=0.6)發現包含產物的所有級分,并濃縮,得到白色固體的3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(9.2g,23.88mmol,產率81.0%):1hnmr(400mhz,cdcl3)δ8.10(s,1h),7.42(d,j=8.8hz,2h),7.33(s,1h),6.88-6.85(m,2h),5.45(s,2h),4.11-4.06(m,2h),3.78(s,3h),1.43(t,j=7.0hz,3h),1.33(s,12h);es-lcmsm/z386.0(m+h)。
中間體2:4-(4-乙基-哌嗪-1-基甲基)-3-三氟甲基-苯胺
步驟1:(4-氨基-2-三氟甲基-苯基)-(4-乙基-哌嗪-1-基)-甲酮
在25℃下,攪拌4-氨基-2-三氟甲基-苯甲酸(15g,73.1mmol)、hobt(14.56g,95mmol)、edc(16.82g,88mmol)、et3n(20.38ml,146mmol)、1-乙基-哌嗪(8.35g,73.1mmol)在dcm(200ml)中的混合物2小時。向該混合物中加入dcm(200ml),然后用h2o、2mol/lnaoh(2×150ml)和鹽水洗滌。經na2so4干燥有機層并濃縮,得到黃白色固體的(4-氨基-2-三氟甲基-苯基)-(4-乙基-哌嗪-1-基)-甲酮(20g,65.2mmol,產率89.0%):1hnmr(400mhz,cdcl3)δ7.07(d,j=8.0hz,1h),6.92(d,j=2.4hz,1h),6.79(dd,j=2.0,8.0hz,1h),3.99(s,2h),3.84-3.76(m,2h),3.25-3.23(m,2h),2.50-2.39(m,4h),2.33-2.31(m,2h),1.08(t,j=7.2hz,3h);es-lcmsm/z302(m+h)。
步驟2:4-(4-乙基-哌嗪-1-基甲基)-3-三氟甲基-苯胺
向(4-氨基-2-三氟甲基-苯基)-(4-乙基-哌嗪-1-基)-甲酮(20g,66.4mmol)在thf(500ml)中的混合物中滴加bh3·dms(19.91ml,199mmol)。然后,在80℃下攪拌該混合物4小時。通過加入meoh淬滅該混合物,然后濃縮。通過在硅膠上的硅膠柱色譜(pe:ea=2:1,rf=0.35)純化殘余物,得到白色固體的4-(4-乙基-哌嗪-1-基甲基)-3-三氟甲基-苯胺(14g,46.0mmol,產率69.4%):1hnmr(400mhz,cdcl3)δ7.48(d,j=8.4hz,1h),6.91(d,j=2.8hz,1h),6.79(dd,j=2.4,8.4hz,1h),3.76(s,2h),3.53(s,2h),2.45-2.39(m,8h),1.08(t,j=7.2hz,3h);es-lcmsm/z288(m+h)。
中間體3:4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯胺
步驟1:3-甲基氧雜環丁烷-3-醇
向冷卻至0℃的氧雜環丁烷-3-酮(8g,111mmol)在thf(300ml)中的混合物中滴加memgbr(74.0ml,222mmol)。在25℃下,攪拌該混合物2小時。用nh4cl(aq.)淬滅該混合物。過濾沉淀物,并用dcm洗滌。濃縮濾液,得到淺黃色油狀物的3-甲基氧雜環丁烷-3-醇(7.5g,85mmol,產率77%):1hnmr(400mhz,cdcl3)δ4.61(d,j=6.4hz,2h),4.46(d,j=7.2hz,2h),2.31(s,1h),1.56(s,3h)。
步驟2:3-甲基-3-(4-硝基-2-(三氟甲基)苯氧基)氧雜環丁烷
向1-氟-4-硝基-2-(三氟甲基)苯(10g,47.8mmol)和3-甲基氧雜環丁烷-3-醇(3.51ml,47.8mmol)在mecn(100ml)中的混合物中加入cs2co3(46.7g,143mmol)。在80℃下,攪拌該混合物10小時。過濾該混合物。濃縮濾液,并通過硅膠柱色譜(pe/ea=20:1)純化殘余物。將通過tlc(pe/ea=5:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的3-甲基-3-(4-硝基-2-(三氟甲基)苯氧基)氧雜環丁烷(10g,35.8mmol,產率74.8%):1hnmr(400mhz,cdcl3)δ8.54(d,j=2.8hz,1h),8.36(dd,j=2.8,9.2hz,1h),6.50(d,j=9.2hz,1h),4.98(d,j=6.8hz,2h),4.67(d,j=7.6hz,2h),1.84(s,3h);es-lcmsm/z278(m+h)。
步驟3:4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯胺
在40℃下,在h2氣氛(50psi)下,氫化3-甲基-3-(4-硝基-2-(三氟甲基)苯氧基)氧雜環丁烷(10g,36.1mmol)和pd/c(0.384g,3.61mmol;10%)在meoh(50ml)中的反應混合物20小時。濃縮該混合物,得到褐色油狀物的4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯胺(8.5g,34.1mmol,產率95%):1hnmr(400mhz,cdcl3)δ6.92(d,j=2.8hz,1h),6.72(dd,j=2.8,8.8hz,1h),6.35(d,j=8.4hz,1h),4.95(d,j=6.4hz,2h),4.52(d,j=7.2hz,2h),3.60(s,2h),1.68(s,3h);es-lcmsm/z248(m+h)。
中間體4:1-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯胺
向在20℃下攪拌的4-溴-2-氟苯胺(40g,211mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-雙(1,3,2-二氧雜硼雜環戊烷)(64.1g,253mmol)和koac(41.3g,421mmol)在1,4-二噁烷(500ml)中的溶液中一次性加入pdcl2(dppf)(7.70g,10.53mmol)。在100℃下攪拌反應混合物3小時。在真空下濃縮溶液,得到2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯胺(44g,158mmol,產率74.9%):1hnmr(400mhz,cdcl3)δ7.46-7.40(m,2h),6.75-6.71(m,1h),1.30(s,j=3.6hz,12h);es-lcmsm/z238.1(m+h)。
步驟2:2-(3-氟-4-異氰酰基(isocyanato)苯基)-4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷(dioxaborolane)
向2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯胺(500mg,2.109mmol)在thf(10ml)中的混合物中加入三光氣(250mg,0.844mmol)。在60℃下,攪拌該混合物30分鐘。蒸發殘余物,得到2-(3-氟-4-異氰酰基苯基)-4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷(500mg,1.616mmol,產率77%);es-lcmsm/z296.1(m+meoh+h)。
步驟3:1-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向2-(3-氟-4-異氰酰基苯基)-4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷(500mg,1.901mmol)在thf(10ml)中的混合物中加入4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯胺(517mg,2.091mmol)和et3n(0.530ml,3.80mmol)。在60℃下,攪拌該混合物1小時。將該混合物濃縮,并通過制備tlc(pe/ea=3:1,rf=0.6)純化,得到淺黃色固體的1-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(500mg,0.980mmol,產率51.6%):1hnmr(400mhz,cdcl3)δ8.15(t,j=8.0hz,1h),7.77-7.76(dj=2.8hz,1h),7.55-7.52(m,1h),7.49-7.47(m,1h),7.42-7.38(m,1h),6.62-6.60(d,j=8.8hz,1h),4.91-4.89(d,j=6.0hz,2h),4.63-4.61(d,j=7.6hz,2h),1.71(s,3h),1.33(s,12h);es-lcmsm/z511.2(m+h)。
中間體5:2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸
步驟1:6-甲基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯
攪拌脲(50g,833mmol)、3-氧代丁酸乙酯(119g,916mmol)在三乙氧基甲烷(136g,916mmol)中的溶液28小時,同時在n2氣氛下,在80℃下蒸餾出etoh。接著,將該混合物冷卻至20℃,并加入etoh(800ml),向上述混合物中加入在etoh(500ml)中的naoet(85g,1249mmol),并在80℃下攪拌該混合物2小時,將該混合物冷卻至20℃,接著加入水(400ml),在20-30℃下加入acoh(60ml),然后過濾該混合物,用水(200ml)洗滌固體,之后干燥,得到6-甲基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯(70g,384mmol,產率46.2%)。1hnmr(400mhz,dmso-d6)δ8.81(s,1h),4.31(q,j=7.2hz,2h),2.64(s,3h),1.35(t,j=7.2hz,3h);lcmsm/z183.2(m+h).
步驟2:2-氯-4-甲基嘧啶-5-羧酸乙酯
向在20℃下,在n2下攪拌的6-甲基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯(62g,340mmol)的溶液中慢慢地加入pocl3(496g,3233mmol)。在80℃下,攪拌反應混合物12小時。然后,濃縮該溶液,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=10:1)純化殘余物。將通過tlc(pe/ea=10:1,rf=0.7)發現包含產物的所有級分都合并,并濃縮,得到黃色固體的2-氯-4-甲基嘧啶-5-羧酸乙酯(9g,44.9mmol,產率13.18%):1hnmr(400mhz,cdcl3)δ9.01(s,1h),4.41(q,j=7.2hz,2h),2.82(s,3h),1.41(t,j=7.2hz,3h)。
步驟3:2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸乙酯
向在20℃下,在n2氣氛下攪拌的3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(6.34g,16.45mmol)、2-氯-4-甲基嘧啶-5-羧酸乙酯(3g,14.95mmol)和cs2co3(9.74g,29.9mmol)在1,4-二噁烷(20ml)和水(6.67ml)中的溶液中一次性加入pdcl2(dppf)(0.547g,0.748mmol)。在110℃下,加熱反應容器2小時。然后,濃縮該溶液,并分配在ea和水之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=10:1,5:1)純化殘余物。將通過tlc(pe/ea=5:1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸乙酯(6g,14.17mmol,產率95%):1hnmr(400mhz,cdcl3)δ9.15(s,1h),8.90(s,1h),8.10(m,1h),7.45(d,j=8.8hz,2h),6.89(d,j=8.8hz,2h),5.50(s,2h),4.45-4.37(m,2h),4.20-4.15(m,2h),3.80(s,3h),2.90-2.81(m,3h),1.48(t,j=6.8hz,3h),1.42(t,j=7.2hz,3h);lcmsm/z424.1(m+h)。
步驟4:2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸
向在20℃下,在n2下攪拌的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸乙酯(6g,14.17mmol)在thf(20ml)中的溶液中一次性加入lioh·h2o(11.34ml,28.3mmol)。在60℃下,攪拌該反應混合物12小時。然后,將該溶液濃縮,并用濃hcl中和至ph=7.0,同時攪拌。接著,過濾溶液,并用水(10ml)洗滌濾餅。在真空中干燥濾餅,得到黃白色固體的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(4g,10.12mmol,產率71.4%):1hnmr(400mhz,cd3od)δ8.89(s,1h),8.73(s,1h),8.12(d,j=1.6hz,1h),7.40(d,j=8.8hz,2h),6.91(d,j=8.8hz,2h),5.39(s,2h),4.16(q,j=6.8hz,2h),3.78(s,3h),2.76(s,3h),1.43(t,j=6.8hz,3h);lcmsm/z396.1(m+h)。
中間體6:2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸
步驟1:2-氯-4-乙氧基吡啶
在0℃下,向2-氯-4-硝基吡啶(170g,1070mmol)在thf(2l)中的混合物中慢慢地加入naoet(109.45g,1610mmol)。在25℃下,攪拌該混合物12小時。lcms和tlc(pe/ea=5:1,rf=0.6)顯示反應完成。過濾該混合物,并在真空中除去大部分濾液的溶劑。用ea(800ml×3)萃取殘余物,并用飽和的nacl溶液(1l)洗滌有機層,經na2so4干燥并濃縮,得到呈固體的2-氯-4-乙氧基吡啶(157g,1.0mol,產率92%):1hnmr(400mhz,cd3od)δ8.15(d,j=6.0hz,1h),6.99(d,j=2.0hz,1h),6.91-6.89(m,1h),4.16-4.14(m,2h),1.41-1.38(m,3h);es-lcmsm/z158(m+h)。
步驟2:5-溴-2-氯-4-乙氧基吡啶
將固體2-氯-4-乙氧基吡啶(100g,0.63mol)慢慢地加入到h2so4(500ml)中。然后,在室溫下,將1-溴吡咯烷-2,5-二酮(124.2g,0.70mol)加入到上述混合物中。在80℃下,攪拌該混合物3小時。tlc(pe/ea=10:1,rf=0.5)顯示反應完成。將反應混合物傾倒入冰-水(2l)中,并用ea(1l×3)萃取。將有機層用飽和的na2co3溶液(1l×2)洗滌,經na2so4干燥并濃縮。在硅膠柱色譜(pe/ea=60:1-30:1)純化殘余物。將通過tlc(pe/ea=10:1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到5-溴-2-氯-4-乙氧基吡啶(60.9g,0.26mol,產率40%):1hnmr(400mhz,cd3od)δ8.31(s,1h),7.14(s,1h),4.32-4.10(m,2h),1.58-1.35(m,3h);es-lcmsm/z237(m+2)。
步驟3:5-溴-4-乙氧基-2-((4-甲氧基芐基)氧基)吡啶
在室溫下,向5-溴-2-氯-4-乙氧基吡啶(75g,317.1mmol)在甲苯(500ml)中的混合物中加入(4-甲氧基苯基)甲醇(52.6g,380.6mmol)、koh(35.6g,634.3mmol)和18-冠-6(8.4g,31.2mmol)。在120℃下,攪拌該反應混合物2小時。將該混合物分配在2-甲氧基-2-甲基丙烷(500ml)和鹽水(800ml)之間。濃縮有機層。通過柱(pe/ea=10:1,rf=0.5)純化殘余物,得到5-溴-4-乙氧基-2-((4-甲氧基芐基)氧基)吡啶(72.2g,221mmol,產率70%):1hnmr(400mhz,cd3od)δ8.05(s,1h),7.33(d,j=8.8hz,2h),6.90-6.84(m,2h),6.38(s,1h),5.20(s,2h),4.16-4.05(m,2h),3.77(s,3h),1.43(q,j=6.8hz,3h);es-lcmsm/z338(m+2h)。
步驟4:6-甲基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯
攪拌脲(50g,833mmol)、3-氧代丁酸乙酯(119g,916mmol)在三乙氧基甲烷(136g,916mmol)中的溶液28小時,同時在80℃下,在n2氣氛下蒸餾出etoh。然后,將該混合物冷卻至20℃,并加入etoh(800ml),向上述混合物中加入在etoh(500ml)中的naoet(85g,1249mmol),并在80℃下攪拌該混合物2小時,將該混合物冷卻至20℃,接著加入水(1l),在20℃-30℃下加入acoh(60ml),然后過濾該混合物,用水(200ml)洗滌固體,干燥,得到6-甲基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯(70g,384mmol,產率46.2%):1hnmr(400mhz,dmso-d6)δ8.81(s,1h),4.31(q,j=7.2hz,2h),2.64(s,3h),1.35(t,j=7.1hz,3h);lcmsm/z183.1(m+h)。
步驟5:2-氯-4-甲基嘧啶-5-羧酸乙酯
向在20℃下,在n2下攪拌的6-甲基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯(62g,340mmol)的溶液中慢慢地加入pocl3(496g,3233mmol)。在80℃下,攪拌反應混合物12小時。然后,濃縮該溶液,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=10:1)純化殘余物。將通過tlc(pe/ea=10:1,rf=0.7)發現包含產物的所有級分都合并,并濃縮,得到黃色固體的2-氯-4-甲基嘧啶-5-羧酸乙酯(9g,44.9mmol,產率13.18%):1hnmr(400mhz,cdcl3)δ9.01(s,1h),4.41(q,j=7.1hz,2h),2.82(s,3h),1.41(t,j=7.1hz,3h);es-lcmsm/z201.1(m+h).
步驟6:4-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶
向在-70℃下,在n2下攪拌的5-溴-4-乙氧基-2-((4-甲氧基芐基)氧基)吡啶(5g,14.78mmol)在thf(25ml)中的溶液中,在1分鐘期間,分批加入n-buli(6.51ml,16.26mmol)。在-70℃下,攪拌該反應混合物1小時。然后,在-70℃下,向溶液中加入在thf(1ml)中的2-異丙氧基-4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷(3.03g,16.26mmol),同時攪拌。在-70℃下,攪拌該溶液1小時。向所述混合物中加入飽和的nh4cl溶液。然后,濃縮該溶液,并分配在ea和水之間。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮。得到4-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(4g,10.38mmol,產率70.2%)。tlc(pe/ea=10:1,rf=0.2):1hnmr(400mhz,cdcl3)δ8.29(s,1h),7.37(d,j=8.6hz,2h),6.89(d,j=8.6hz,2h),6.13(s,1h),5.30(s,2h),4.00-3.97(m,2h),3.80(s,3h),1.40(t,j=6.9hz,3h),1.33(s,12h);es-lcmsm/z386.1(m+h)。
步驟7:2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸乙酯
向在20℃下,在n2下攪拌的4-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(4.99g,12.96mmol)、2-氯-4-甲基嘧啶-5-羧酸乙酯(2g,9.97mmol)和cs2co3(6.50g,19.94mmol)在1,4-二噁烷(15ml)和水(5.00ml)中的溶液中一次性加入pdcl2(dppf)(0.365g,0.498mmol)。在110℃,加熱反應容器2小時。然后,將溶液濃縮,并分配在ea和水之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(20%ea:80%pe,60g硅膠柱)純化殘余物。將通過tlc(pe/ea=2:1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸乙酯(3.5g,8.27mmol,產率83%):1hnmr(400mhz,cdcl3)δ9.20(s,1h),8.59(s,1h),7.40(d,j=8.4hz,2h),6.90(d,j=8.4hz,2h),6.32(s,1h),5.36(s,2h),4.45-4.39(m,2h),4.13-4.05(m,2h),3.81(s,3h),2.87(s,3h),1.44-1.36(m,6h);es-lcmsm/z424.0(m+h)。
步驟8:2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸
向在20℃下,在n2下攪拌的2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸乙酯(3.5g,8.27mmol)在thf(10ml)中的溶液中一次性加入在h2o(6.61ml16.53mmol)中的lioh。將反應混合物加熱至50℃12小時。然后,濃縮該溶液,并用濃hcl中和至ph=7.0,同時攪拌。然后,在真空中濃縮該溶液,得到2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸:1hnmr(400mhz,cd3od)δ8.86(s,1h),8.27(s,1h),7.38(d,j=8.6hz,2h),6.91(d,j=8.6hz,2h),5.31(s,2h),4.15-4.08(m,2h),3.79(s,3h),2.75(s,3h),1.33(t,j=6.9hz,3h);lcmsm/z:396.1(m+h)。
中間體7:3-(4-氨基-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯
步驟1:2,2-二甲基-3-(2-(三氟甲基)苯基)丙酸乙酯
向冷卻至0℃的二異丙胺(8.00ml,57.1mmol)在thf(300ml)中的混合物中滴加n-buli(24.60ml,61.5mmol)。在0℃下,攪拌該混合物1小時。然后,向冷卻至-30℃的該混合物中加入異丁酸乙酯(6.12g,52.7mmol)在thf(2ml)中的溶液。在-30℃下,攪拌該混合物1小時。在-30℃下,向該混合物中加入1-(溴乙基)-2-(三氟甲基)苯(10.5g,43.9mmol)在thf(5ml)中的溶液。在-30℃下,攪拌該整個混合物3小時,然后在25℃下攪拌12小時。用nh4cl(aq)淬滅該混合物,并用ea萃取。將有機層用鹽水洗滌,經mgso4干燥,過濾并濃縮。在硅膠柱色譜(pe/ea=200:1)上純化殘余物。將通過tlc(pe/ea=10:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的2,2-二甲基-3-(2-(三氟甲基)苯基)丙酸乙酯(10g,35.3mmol,產率80.0%):1hnmr(400mhz,cdcl3)δ:7.62(d,j=8.0hz,1h),7.41(t,j=7.6hz,1h),7.29(t,j=7.6hz,1h),7.22(d,j=8.0hz,1h),4.17(q,j=7.2hz,2h),3.14(s,3h),1.25(t,j=7.2hz,3h),1.18(s,6h);es-lcmsm/z275(m+h)。
步驟2:2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酸乙酯
向冷卻至0℃下的2,2-二甲基-3-(2-(三氟甲基)苯基)丙酸乙酯(10g,36.5mmol)在h2so4(5ml,94mmol)中的溶液中分批加入硝基過酸鉀(potassiumnitroperoxousacid)(4.05g,40.1mmol)。在0℃下,攪拌該混合物30分鐘。將該混合物傾倒入冰-水中,并用dcm萃取。將有機層用鹽水洗滌,經na2so4干燥并濃縮,得到黃色固體的2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酸乙酯(8.5g,24.54mmol,產率67.3%):1hnmr(400mhz,cdcl3)δ:8.59(d,j=2.4hz,1h),8.47(dd,j=2.4,8.8hz,1h),7.82(d,j=8.4hz,1h),5.97-5.83(m,2h);es-lcmsm/z320(m+h)。
步驟3:3-(4-氨基-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯
使用h-cube(設定:50℃,50psi,24h)氫化2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酸乙酯(8.5g,26.6mmol)和pd/c(0.283g,2.66mmol)在meoh(50ml)中的反應混合物。過濾混合物,并濃縮濾液。在硅膠柱色譜(pe/ea=10:1)上純化殘余物。將通過tlc(pe/ea=5:1,rf=0.4)發現包含產物的所有級分合并并濃縮,得到黃白色固體的3-(4-氨基-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯(7g,22.42mmol,產率84.0%):1hnmr(400mhz,cdcl3)δ:6.98(d,j=8.4hz,1h),6.91(d,j=2.4hz,1h),6.71(dd,j=2.4,8.4hz,1h),4.15(q,j=6.8hz,2h),3.00(s,2h),1.25(t,j=7.2hz,3h),1.14(s,6h);es-lcmsm/z290(m+h)。
中間體8:2-(芐氧基)-4-乙氧基-5-碘吡啶
步驟1:4-乙氧基吡啶1-氧化物
向4-硝基吡啶1-氧化物(50g,357mmol)在thf(500ml)中的混合物中加入naoet(48.6g,714mmol)。在25下,攪拌該混合物16小時。濃縮反應殘余物。通過硅膠柱色譜(dcm/meoh=25:1)純化殘余物。將通過tlc(dcm/meoh=25:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到暗紅色固體的4-乙氧基吡啶1-氧化物(25g,162mmol,產率45.3%):1hnmr(400mhz,cd3od)δ8.20-8.18(m,2h),7.11-7.10(m,2h),4.21-4.15(m,2h),1.42(t,j=7.2hz,3h);es-lcmsm/z140.0(m+h)。
步驟2:4-乙氧基吡啶-2-醇
將4-乙氧基吡啶1-氧化物(5g,35.9mmol)在ac2o(36.7g,359mmol)中的混合物加熱回流4小時。然后,在真空下除去溶劑,將殘余物溶于meoh(25ml)和h2o(25ml)中,并在25℃下攪拌16小時。濃縮該混合物。通過硅膠柱色譜(dcm/meoh=10:1)上純化殘余物。將通過tlc(dcm/meoh=10:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到暗黃色固體的4-乙氧基吡啶-2-醇(2.5g,16.17mmol,產率45.0%):1hnmr(400mhz,cd3od)δ7.28(d,j=7.6hz,1h),6.07(d,j=3.2,7.2hz,1h),5.86-7.85(d,j=2.4hz,1h),4.06-4.01(m,2h),1.38(t,j=7.2hz,3h);es-lcmsm/z140.0(m+h)。
步驟3:4-乙氧基-5-碘吡啶-2-醇
向4-乙氧基吡啶-2-醇(2.5g,17.97mmol)在dmf(30ml)中的混合物中加入nis(4.04g,17.97mmol)。在80℃下,攪拌該混合物16小時。濃縮該混合物,并通過制備hplc(mecn/h2o作為洗脫液,酸性條件)純化,得到黃色固體的4-乙氧基-5-碘吡啶-2-醇(1.2g,4.30mmol,產率23.9%):1hnmr(400mhz,cd3od)δ7.70(s,1h),5.92(s,1h),4.15-4.10(m,2h),1.48(t,j=6.8hz,3h);es-lcmsm/z265.8(m+h)。
步驟4:2-(芐氧基)-4-乙氧基-5-碘吡啶
向4-乙氧基-5-碘吡啶-2-醇(800mg,3.02mmol)在thf(10ml)中的混合物中加入(溴甲基)苯(619mg,3.62mmol)和碳酸銀(1665mg,6.04mmol)。在70℃下,攪拌該混合物16小時。過濾反應殘余物,并濃縮濾液。將該混合物用h2o稀釋,并用dcm萃取。用鹽水洗滌合并的有機萃取物,經mgso4干燥,過濾并濃縮。得到2-(芐氧基)-4-乙氧基-5-碘吡啶(800mg,1.915mmol,產率63.4%):1hnmr(400mhz,cdcl3)δ8.28(s,1h),7.45-7.43(m,2h),7.38-7.36(m,3h),6.22(s,1h),5.33(s,2h),4.12-4.07(m,2h),1.48(t,j=6.8hz,3h);es-lcmsm/z355.9(m+h)。
中間體9:5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-胺
步驟1:5,5,5-三氟-4,4-二甲基-3-氧代戊腈
向冷卻至-78℃的mecn(3.32ml,97mmol)在thf(300ml)中的混合物中加入n-buli(56.4ml,141mmol)。在-30℃下,攪拌該混合物30分鐘。然后,向該混合物中滴加3,3,3-三氟-2,2-二甲基丙酸甲酯(15g,88mmol)。在25℃下,攪拌該混合物10小時。用nh4cl水溶液淬滅該混合物,并用dcm/meoh(10:1)萃取。經na2so4干燥有機層,過濾并濃縮。通過硅膠柱色譜(pe/ea=10:1)純化殘余物。將通過tlc(pe/ea=5:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的5,5,5-三氟-4,4-二甲基-3-氧代戊腈(5g,27.9mmol,產率31.7%):1hnmr(400mhz,cdcl3)δ:3.75(s,2h),1.41(s,6h)。
步驟2:5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-胺
向冷卻至0℃的鹽酸羥胺(3.10g,44.7mmol)在h2o(25ml)中的混合物中加入nahco3(3.94g,46.9mmol)以調節ph=7.5。然后,向該混合物中加入5,5,5-三氟-4,4-二甲基-3-氧代戊腈(4g,22.33mmol)在meoh(25ml)中的溶液。在65℃下,攪拌該混合物15小時。在冷卻之后,用濃hcl酸化該混合物至ph=1.0,然后回流2小時。在冷卻之后,用4mnaoh中和該混合物至ph=8.0。用dcm/meoh(10:1)萃取該混合物。經na2so4干燥有機層,過濾并濃縮,得到白色固體的5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-胺(2g,9.06mmol,產率40.6%):1hnmr(400mhz,cdcl3)δ5.78(s,1h),3.93(s.,2h),1.51(s,6h);es-lcmsm/z195(m+1)。
中間體10:3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯胺
步驟1:4-甲基-1-(3-硝基-5-(三氟甲基)苯基)-1h-咪唑
將4-甲基-1h-咪唑(1.178g,14.35mmol)在dmf(15ml)中的懸浮液加入到1-氟-3-硝基-5-(三氟甲基)(2g,9.56mmol)在dmf(15ml)中的溶液中。加入cs2co3(6.23g,19.13mmol),并在80℃下,攪拌該混合物8小時。將該混合物冷卻至室溫,然后濃縮溶液,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=5:1)純化殘余物。將通過tlc(pe/ea=1:1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的4-甲基-1-(3-硝基-5-(三氟甲基)苯基)-1h-咪唑(800mg,2.95mmol,產率30.8%):1hnmr(400mhz,cd3od)δ8.61-8.78(m,1h),8.44-8.51(m,1h),8.31-8.39(m,2h),7.55(s,1h),2.27(s,3h);es-lcmsm/z272.0(m+h)。
步驟2:3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯胺
將4-甲基-1-(3-硝基-5-(三氟甲基)苯基)-1h-咪唑(800mg,2.95mmol)在meoh(15ml)中的懸浮液加入到pd/c(5.02μl,0.078mmol)在meoh(15ml)中的懸浮液中。在h2氣氛下,將該混合物置于25℃下5小時。然后,將溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過制備hplc(mecn/h2o作為洗脫液,堿性條件)純化殘余物,得到白色固體的3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯胺(321.83mg,1.334mmol,產率86.0%)。tlc(pe/ea=1:1,rf=0.3):1hnmr(400mhz,cd3od)δ7.98(s,1h),7.24(s,1h),7.02–6.76(m,3h),2.31-2.17(m,3h);es-lcmsm/z242.1(m+h)。
中間體11:4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯胺
步驟1:2-甲基-2-(2-(三氟甲基)芐基)丙二酸二乙酯
向冷卻至0℃的2-甲基丙二酸二乙酯(4.37g,25.1mmol)在thf(100ml)中的溶液中加入nah(1.506g,37.7mmol)。在0℃下,攪拌該混合物0.5小時。向該混合物中加入1-(溴甲基)-2-(三氟甲基)苯(5g,20.92mmol),并在25℃下,攪拌該混合物10小時。tlc(pe/ea=10:1,rf=0.6)顯示起始物質消失。用h2o(50ml)淬滅該混合物,并用ea(100ml×2)萃取。將有機層用鹽水(100ml)洗滌,經na2so4干燥并濃縮。通過硅膠柱色譜(pe/ea=50:1)純化殘余物。將通過tlc(pe/ea=10:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到2-甲基-2-(2-(三氟甲基)芐基)丙二酸二乙酯(4g,8.02mmol,產率38.3%):1hnmr(400mhz,cdcl3)δ=7.62(d,j=7.6hz,1h),7.41(t,j=7.6hz,1h),7.34-7.27(m,1h),7.27-7.21(m,1h),4.26-4.14(m,4h),3.53(s,2h),1.30-1.21(m,9h);es-lcmsm/z:333.2(m+h)。
步驟2:2-甲基-2-(4-硝基-2-(三氟甲基)芐基)丙二酸二乙酯
向冷卻至0℃的2-甲基-2-(2-(三氟甲基)芐基)丙二酸二乙酯(4g,12.04mmol)在h2so4(15ml,281mmol)中的溶液中分批加入硝基過酸鉀(potassiumnitroperoxousacid)(1.339g,13.24mmol)。在0℃下,攪拌該混合物5分鐘。將該混合物傾倒入冰-水(100ml)中,用ea(100ml×2)萃取。將有機層用飽和的na2co3(100ml×2)洗滌,經na2so4干燥并濃縮,得到黃色固體的2-甲基-2-(4-硝基-2-(三氟甲基)芐基)丙二酸二乙酯(4.5g,10.00mmol,產率83%):1hnmr(400mhz,cdcl3)δ=8.50(s,1h),8.27(s,1h),7.57(s,1h),4.19(s,4h),3.58(s,2h),1.31(s,3h),1.22(d,j=3.2hz,6h);es-lcmsm/z:378.1(m+h)。
步驟3:2-(4-氨基-2-(三氟甲基)芐基)-2-甲基丙二酸二乙酯
在25℃下,在h2氣氛下,攪拌2-甲基-2-(4-硝基-2-(三氟甲基)芐基)丙二酸酯(4.5g,11.93mmol)和pd/c(0.127g,1.193mmol)在meoh(200ml)中的反應混合物5小時。過濾該混合物,并濃縮濾液,得到褐色油狀物的2-(4-氨基-2-(三氟甲基)芐基)-2-甲基丙二酸二乙酯(4.1g,9.67mmol,產率81%):1hnmr(400mhz,cd3od)δ=7.03-6.93(m,2h),6.79(d,j=8.4hz,1h),4.21(q,j=6.8hz,4h),3.36(s,2h),1.26(t,j=7.2hz,6h),1.20(s,3h);es-lcmsm/z:348.1(m+h)。
步驟4:2-(4-(雙(4-甲氧基芐基)氨基)-2-(三氟甲基)芐基)-2-甲基丙二酸二乙酯
在110℃下,攪拌2-(4-氨基-2-(三氟甲基)芐基)-2-甲基丙二酸二乙酯(4.1g,11.80mmol)、1-(氯甲基)-4-甲氧基苯(5.55g,35.4mmol)和cs2co3(26.9g,83mmol)在dmf(50ml)中的混合物12小時。濃縮該混合物。將殘余物加入到dcm(150ml)中并過濾。將濾液用鹽水(100ml)洗滌,經na2so4干燥并濃縮,得到黃色油狀物的2-(4-(雙(4-甲氧基芐基)氨基)-2-(三氟甲基)芐基)-2-甲基丙二酸二乙酯(3g,3.83mmol,產率32.4%):1hnmr(400mhz,cd3od)δ=7.45-7.30(m,4h),7.25(d,j=1.6hz,1h),6.36(s,1h),4.12(q,j=6.8hz,2h),3.82(s,2h),1.52(s,6h),1.46(t,j=6.8hz,3h);es-lcmsm/z:588.1(m+h)。
步驟5:2-(4-((4-甲氧基芐基)氨基)-2-(三氟甲基)芐基)-2-甲基丙烷-1,3-二醇
向冷卻至0℃的2-(4-(雙(4-甲氧基芐基)氨基)-2-(三氟甲基)芐基)-2-甲基丙二酸二乙酯(4.3g,7.32mmol)在thf(100ml)中的混合物中分批加入lah(1.111g,29.3mmol)。在25℃下,攪拌該混合物10小時。用15%naoh(aq,40ml)淬滅該混合物。經na2so4干燥該混合物。在過濾之后,濃縮濾液。在硅膠柱色譜(pe/ea=5:1)上純化殘余物。將通過tlc(pe/ea=2:1,rf=0.35)發現包含產物的所有級分合并,并濃縮,得到黃色油狀物的2-(4-((4-甲氧基芐基)氨基)-2-(三氟甲基)芐基)-2-甲基丙烷-1,3-二醇(3g,6.45mmol,產率88%):1hnmr(400mhz,cd3od)δ=7.27(d,j=8.4hz,2h),7.20(d,j=8.4hz,1h),6.89-6.83(m,3h),6.73(dd,j=2.4,8.4hz,1h),4.23(s,2h),3.80-3.72(m,4h),3.34(s,1h),2.67(s,2h),0.63(s,3h);es-lcmsm/z:406.1(m+na)。
步驟6:n-(4-甲氧基芐基)-4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯胺
向冷卻至0℃的2-(4-((4-甲氧基芐基)氨基)-2-(三氟甲基)芐基)-2-甲基丙烷-1,3-二醇(3g,7.82mmol)在thf(50ml)中的混合物中加入n-buli(4.69ml,11.74mmol),并攪拌0.5小時。然后,向該混合物中加入4-甲基苯-1-磺酰氯(2.238g,11.74mmol),并在25℃下攪拌1小時。然后,向該混合物中加入另外的n-buli(4.69ml,11.74mmol),并在60℃下攪拌2小時,接著在25℃下攪拌10小時。用nh4cl(aq.,50ml)淬滅該混合物,并用ea(100ml×2)萃取。將有機層濃縮。在.硅膠柱色譜(pe/ea=5:1)上純化殘余物。將通過tlc(pe/ea=2:1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到黃白色固體的n-(4-甲氧基芐基)-4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯胺(1g,1.888mmol,產率24.13%):1hnmr(400mhz,cdcl3)δ=7.30-7.22(m,2h),6.94-6.80(m,4h),6.68(d,j=8.4hz,1h),4.65(d,j=5.6hz,2h),4.29(d,j=5.2hz,2h),4.24(s,2h),3.85-3.76(m,3h),2.92(s,2h),1.33(s,3h);es-lcmsm/z388.0(m+na)。
步驟7:4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯胺
在n2下,向n-(4-甲氧基芐基)-4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯胺(1g,2.74mmol)在meoh(50ml)中的混合物中加入pd/c(0.291g,2.74mmol)。在h2氣氛下(50psi,50℃,2h),攪拌該混合物。過濾該混合物,并濃縮濾液,產率淺黃色油狀物的4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯胺(500mg,1.788mmol,產率65.3%):1hnmr(400mhz,cdcl3)δ:6.97(s,1h),6.90(d,j=8.4hz,1h),6.79(d,j=7.6hz,1h),4.65(d,j=5.2hz,2h),4.29(d,j=5.2hz,2h),2.93(s,2h),1.59(s,2h),1.32(s,3h);es-lcmsm/z246.1(m+h)。
中間體12:1-(5-氨基-3-(三氟甲基)吡啶-2-基)乙酮
步驟1:5-硝基-3-(三氟甲基)吡啶-2-醇
在0℃下,向3-(三氟甲基)吡啶-2-醇(2g,12.26mmol)的混合物中加入硝酸(1.644ml,36.8mmol)和h2so4(12.03g,123mmol)。然后,在25℃下,攪拌該混合物16小時。然后,使該混合物升溫至60℃5小時,冷卻,并加入150g的冰。用ea(2×100ml)萃取該混合物,并用h2o(100ml)洗滌,得到有機層。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,濃縮得到褐色固體的5-硝基-3-(三氟甲基)吡啶-2-醇(2.2g,8.99mmol,產率73.3%):1hnmr(400mhz,cd3od)δ8.91(d,j=2.43hz,1h),9.42(d,j=2.43hz,1h);es-lcmsm/z209.0(m+h)。
步驟2:2-氯-5-硝基-3-(三氟甲基)吡啶
向5-硝基-3-(三氟甲基)吡啶-2-醇(2g,9.61mmol)的混合物中加入socl2(21.04ml,288mmol)和dmf(0.074ml,0.961mmol)。然后,在80℃下攪拌該混合物16小時。濃縮該混合物,用ea(2×100ml)萃取,并用h2o(100ml)洗滌,得到有機層。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,濃縮,得到褐色固體的2-氯-5-硝基-3-(三氟甲基)吡啶(2g,5.30mmol,產率55.1%):1hnmr(400mhz,cd3od)δ8.91(d,j=2.43hz,1h),9.42(d,j=2.43hz,1h)。
步驟3:6-氯-5-(三氟甲基)吡啶-3-胺
向2-氯-5-硝基-3-(三氟甲基)吡啶(2g,8.83mmol)在acoh(10ml)中的混合物中一次性加入鐵(2.465g,44.1mmol)。在80℃下,攪拌該混合物15分鐘。將該混合物過濾并濃縮,然后用naoh水溶液洗滌并用ea萃取。通過硅膠柱色譜(pe/ea=5:1)純化殘余物。將通過tlc(pe/ea=8:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到黃色固體的6-氯-5-(三氟甲基)吡啶-3-胺(1g,4.58mmol,產率51.9%):1hnmr(400mhz,cd3od)δ8.06(s,1h),7.86(d,j=8.60hz,1h),7.53(d,j=8.60hz,1h),7.46-7.26(m,5h),4.16-4.11(m,2h),3.81(s,2h),1.47(t,j=6.62hz,3h);es-lcmsm/z197.0(m+h)。
步驟4:1-(5-氨基-3-(三氟甲基)吡啶-2-基)乙酮
向6-氯-5-(三氟甲基)吡啶-3-胺(200mg,1.018mmol)在meoh(3ml)中的混合物中加入6-氯-5-(三氟甲基)吡啶-3-胺(200mg,1.018mmol)nahco3(171mg,2.035mmol)和pdcl2(dppf)(74.5mg,0.102mmol)。在微波下,在110℃下,在n2氣氛下攪拌該混合物30分鐘。然后,過濾該反應殘余物,并通過meoh洗滌固體。接著,將6mhcl加入到該溶液中,在室溫下攪拌1小時,然后濃縮。通過制備tlc(pe/ea=1:1,rf=0.6)純化殘余物,得到淺黃色固體的1-(5-氨基-3-(三氟甲基)吡啶-2-基)乙酮(120mg,0.500mmol,產率49.1%):1hnmr(400mhz,cd3od)δ8.10(d,j=2.43hz,1h),7.30(d,j=2.43hz,1h),2.56(s,3h);es-lcmsm/z205.0(m+h)。
中間體13:4-((二甲基氨基)甲基)-3-(三氟甲基)苯胺
步驟1:n,n-二甲基-4-硝基-2-(三氟甲基)苯甲酰胺
向在20℃下,在n2下攪拌的4-硝基-2-(三氟甲基)苯甲酸(10g,42.5mmol)、二甲胺鹽酸鹽(4.51g,55.3mmol)和et3n(17.78ml,128mmol)在dcm(150ml)中的溶液中一次性加入hatu(19.41g,51.0mmol)。在20℃下,攪拌反應混合物2小時。然后,將溶液分配在dcm和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮,得到n,n-二甲基-4-硝基-2-(三氟甲基)苯甲酰胺(10g,25.2mmol,產率59.2%)。tlc(pe/ea=5:1,rf0.6):1hnmr(400mhz,cdcl3)δ8.57(d,j=1.8hz,1h),8.46(dd,j=2.0,8.4hz,1h),7.58(d,j=8.4hz,1h),2.79(s,6h);es-lcmsm/z263.0(m+h)。
步驟2:4-氨基-n,n-二甲基-2-(三氟甲基)苯甲酰胺
向在20℃下,在n2下攪拌的n,n-二甲基-4-硝基-2-(三氟甲基)苯甲酰胺(10g,25.2mmol)在meoh(100ml)中的溶液中一次性加入pd/c(1g,9.40mmol)。在20℃下,在h2氣氛下,攪拌反應混合物12小時。過濾該混合物,并在真空中濃縮濾液,得到4-氨基-n,n-二甲基-2-(三氟甲基)苯甲酰胺(8.3g,23.59mmol,產率94.0%)。tlc(dcm/meoh=10:1,rf=0.4):1hnmr(400mhz,cdcl3)δ7.07(d,j=8.2hz,1h),6.90(s,1h),6.79(d,j=8.2hz,1h),3.95(br.s.,2h),3.08(s,3h),2.80(s,3h);es-lcmsm/z233.0(m+h)。
步驟3:4-((二甲基氨基)甲基)-3-(三氟甲基)苯胺
向在20℃下,在n2氣氛下攪拌的4-氨基-n,n-二甲基-2-(三氟甲基)苯甲酰胺(8.3g,23.59mmol)在thf(100ml)中的溶液中滴加bh3·dms(11.20ml,118mmol)。在80℃下,攪拌該反應混合物2小時。向該溶液中加入meoh,然后在真空中濃縮。通過硅膠柱色譜(dcm/meoh=30:1)純化殘余物。將通過tlc(dcm/meoh=10:1,rf=0.4)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的4-((二甲基氨基)甲基)-3-(三氟甲基)苯胺(4g,18.33mmol,產率78.0%):1hnmr(400mhz,cd3od)δ7.99(d,j=8.0hz,1h),7.73(s,1h),7.67(d,8.0hz,1h),4.57(s,2h),2.96(s,6h);es-lcmsm/z219.2(m+h)。
中間體14:2-(4-(4-氨基-5-氟-2-(三氟甲基)芐基)哌嗪-1-基)乙基乙酸酯
步驟1:4-溴-2-氟-5-(三氟甲基)苯胺
向2-氟-5-(三氟甲基)苯胺(4g,22.33mmol)在dmf(60ml)中的混合物中加入nbs(4.77g,26.8mmol),將其在20℃下攪拌2小時。將該混合物濃縮,得到粗產物,并分配在乙酸乙酯(50ml×3)和飽和的nahco3(30ml×3)溶液之間。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮,沒有純化,得到呈褐色固體的4-溴-2-氟-5-(三氟甲基)苯胺(4.8g,17.80mmol,產率80.0%):1hnmr(400mhz,methanol-d4)δ7.35(d,j=10.6hz,1h),7.20(d,j=8.8hz,1h);es-lcmsm/z259.0,260.0(m+h)。
步驟2:(4-溴-2-氟-5-(三氟甲基)苯基)氨基甲酸叔丁酯
向4-溴-2-氟-5-(三氟甲基)苯胺(3g,11.13mmol)在thf(30ml)中的混合物中加入boc2o(3.88ml,16.69mmol)和dmap(2.039g,16.69mmol)。在20℃下,攪拌該混合物12小時。濃縮該混合物,得到粗產物,通過柱(pe/etoac=10:1,rf=0.5)純化,得到呈無色油狀物的(4-溴-2-氟-5-(三氟甲基)苯基)氨基甲酸叔丁酯(3.1g,7.53mmol,產率67.7%):1hnmr(400mhz,methanol-d4)δ7.82(dd,j=8.60,4.63hz,2h),1.42(s,9h)。
步驟3:4-((叔丁氧基羰基)氨基)-5-氟-2-(三氟甲基)苯甲酸甲酯
在n2氣氛下,向(4-溴-2-氟-5-(三氟甲基)苯基)氨基甲酸叔丁酯(4g,9.72mmol)在meoh(15ml)中的混合物中加入pdcl2(dppf)(0.711g,0.972mmol)和et3n(2.71ml,19.43mmol)。在60℃下,在50psi的co氣氛下,攪拌該混合物12小時。tlc(pe/etoac=10:1,rf=0.3)顯示反應完成。濃縮該混合物,得到粗產物,通過柱(pe/etoac=10:1,rf=0.3)純化,得到呈無色油狀物的4-((叔-丁氧基羰基)氨基)-5-氟-2-(三氟甲基)苯甲酸甲酯(2.8g,7.71mmol,產率79.0%):1hnmr(400mhz,chloroform-d)δ7.58(d,j=11.0hz,1h),6.90(br.s.,1h),3.90(s,3h),1.53(s,9h)。
步驟4:(2-氟-4-(羥基甲基)-5-(三氟甲基)苯基)氨基甲酸叔丁酯
在-78℃下,在n2氣氛下,向4-((叔-丁氧基羰基)氨基)-5-氟-2-(三氟甲基)苯甲酸甲酯(2.8g,7.71mmol)在dcm(50ml)中的混合物加入dibal-h(23.14ml,23.14mmol)。在-78℃下,攪拌該混合物1小時。用水(20ml)淬滅該反應。將該混合物分配在dcm(50ml×3)之間,用飽和的鹽水(30ml×3)溶液洗滌。將合并的有機萃取物經na2so4干燥,過濾并濃縮,得到呈無色油狀物的(2-氟-4-(羥基甲基)-5-(三氟甲基)苯基)氨基甲酸叔丁酯(2.4g,6.05mmol,產率78.0%):1hnmr(400mhz,methanol-d4)δ8.36-8.16(m,1h),7.49(d,j=11.9hz,1h),4.72(s,2h),1.53(s,9h)。
步驟5:4-((叔-丁氧基羰基)氨基)-5-氟-2-(三氟甲基)芐基甲磺酸酯
在-78℃下,向(2-氟-4-(羥基甲基)-5-(三氟甲基)苯基)氨基甲酸叔丁酯(2.4g,6.05mmol)在dcm(30ml)中的混合物中加入三乙胺(1.225g,12.11mmol)和甲磺酰氯(1.040g,9.08mmol)。在-78℃下,攪拌該混合物0.5小時。將該混合物用dcm(40ml×3)萃取,用飽和的鹽水(30ml×3)溶液洗滌。將合并的有機萃取物經na2so4干燥,過濾并濃縮,得到呈褐色固體的粗4-((叔-丁氧基羰基)氨基)-5-氟-2-(三氟甲基)芐基甲磺酸酯(2.5g,4.84mmol,產率80.0%):1hnmr(methanol-d4,400mhz)δ8.69(d,j=7.5hz,1h),7.49(d,j=11.9hz,1h),4.62(s,2h),3.42(s,3h),1.55ppm(s,9h)。
步驟6:(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-三氟甲基)苯基)氨基甲酸叔丁酯
向4-((叔-丁氧基羰基)氨基)-5-氟-2-(三氟甲基)芐基甲磺酸酯(2.5g,4.84mmol)在mecn(50ml)中的混合物加入k2co3(2.007g,14.52mmol)和2-(哌嗪-1-基)乙醇(0.756g,5.81mmol),將其在50℃下攪拌2小時。lcms顯示反應完成。濃縮該混合物,得到粗產物,并分配在乙酸乙酯(50ml×3)和飽和的nahco3(30ml×3)之間。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮,得到呈褐色油狀物的(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)氨基甲酸叔丁酯(2.4g,4.56mmol,產率94.0%):1hnmr(400mhz,methanol-d4)δ8.30-8.20(m,1h),7.53(s,1h),3.68(t,j=6.2hz,2h),3.60(s,2h),2.70-2.44(m,10h),1.53(s,9h);es-lcmsm/z422.3(m+h)。
步驟7:
2-(4-(4-((叔-丁氧基羰基)氨基)-5-氟-2-(三氟甲基)芐基)哌嗪-1-基)乙基乙酸酯
向(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)氨基甲酸叔丁酯(2.4g,4.56mmol)在dcm(50ml)中的混合物中加入吡啶(1.802g,22.78mmol)、dmap(0.557g,4.56mmol)和乙酸酐(2.326g,22.78mmol)。在20℃下,攪拌該混合物12小時。lcms顯示反應完成。濃縮該混合物,得到粗產物,并分配在乙酸乙酯(30ml×3)和飽和的nahco3(20ml×3)溶液之間。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮,通過柱(dcm∶meoh=20:1,rf=0.5)純化,得到呈褐色油狀物的2-(4-(4-((叔-丁氧基羰基)氨基)-5-氟-2-(三氟甲基)芐基)-哌嗪-1-基)乙基乙酸酯(2.4g,4.14mmol,產率91.0%):1hnmr(400mhz,methanol-d4)δ8.31-8.19(m,1h),7.55(d,j=11.9hz,1h),4.24(t,j=5.5hz,2h),3.62(s,2h),2.78-2.67(m,6h),2.56(br.s.,4h),2.05(s,3h),1.53(s,9h);es-lcmsm/z464.3(m+h)。
步驟8:2-(4-(4-氨基-5-氟-2-(三氟甲基)芐基)哌嗪-1-基)乙基乙酸酯
向2-(4-(4-((叔-丁氧基羰基)氨基)-5-氟-2-(三氟甲基)芐基)哌嗪-1-基)乙基乙酸酯(2.4g,4.30mmol)在二氯甲烷(dcm)(20ml)中的混合物中加入氯化氫、甲醇(溶劑合物)(10.75ml,4n,43.0mmol),在20℃下攪拌1小時。lcms顯示反應完成。濃縮該混合物,得到呈黃色的固體粗產物2-(4-(4-氨基-5-氟-2-(三氟甲基)-芐基)哌嗪-1-基)乙基乙酸酯(1.8g,3.72mmol,產率86.0%):1hnmr(400mhz,methanol-d4)δ8.90(d,j=5.3hz,1h),8.16-8.12(m,1h),4.48-4.44(m,2h),4.43-4.31(m,2h),3.85-3.67(m,4h),3.67-3.57(m,4h),3.46(br.s.,2h),2.12(d,j=1.3hz,3h);es-lcmsm/z364.2(m+h)。
中間體15:2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸
步驟1:3-(2-(芐氧基)乙氧基)-5-溴-2-氯吡啶
向((2-溴乙氧基)甲基)苯(4.54g,21.11mmol)在dmf(40ml)中的混合物中加入5-溴-2-氯吡啶-3-醇(4g,19.19mmol),將其在60℃下攪拌12小時。用水(50ml)稀釋該混合物。將該混合物用etoac(50ml×3)萃取并濃縮,得到粗產物,通過柱(pe/etoac=10:1,rf=0.5)純化,得到呈黃色固體的3-(2-(芐氧基)乙氧基)-5-溴-2-氯吡啶(6.5g,17.36mmol,產率90%):1hnmr(400mhz,methanol-d4)δ8.01(s,1h),7.73(s,1h),7.43-7.15(m,5h),4.61(s,2h),4.30-4.27(m,2h),3.91-3.82(m,2h);es-lcmsm/z342.0,344.0(m+h)。
步驟2:3-(2-(芐氧基)乙氧基)-5-溴-2-((4-甲氧基芐基)氧基)吡啶
向3-(2-(芐氧基)乙氧基)-5-溴-2-氯吡啶(6g,17.5mmol)在甲苯(60ml)中的混合物中加入氫氧化鉀(1.965g,35.0mmol)、(4-甲氧基苯基)甲醇(2.90g,21.01mmol)和18-冠-6(0.463g,1.751mmol)。在120℃下,攪拌該混合物2小時。過濾該混合物,并濃縮濾液,得到粗產物,通過柱(pe/etoac=5:1,rf=0.4)純化,得到呈黃色固體的3-(2-(芐氧基)乙氧基)-5-溴-2-((4-甲氧基芐基)氧基)吡啶(6.8g,14.16mmol,產率81%):1hnmr(400mhz,chloroform-d)δ7.78(d,j=1.8hz,1h),7.39(d,j=8.4hz,2h),7.33-7.25(m,5h),7.21(d,j=1.8hz,1h),6.85(d,j=8.8hz,2h),5.34(s,2h),4.60(s,2h),4.19-4.14(m,2h),3.84-3.80(m,2h),3.79(s,3h);es-lcmsm/z324.0,326.0(m-pmb+h)。
步驟3:3-(2-(芐氧基)乙氧基)-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶
在n2氣氛下,向3-(2-(芐氧基)乙氧基)-5-溴-2-((4-甲氧基芐基)氧基)吡啶(4g,9.00mmol)在1,4-二噁烷(60ml)中的混合物中加入4,4,4',4',5,5,5',5'-八甲基-2,2'-雙(1,3,2-二氧雜硼雜環戊烷)(2.286g,9.00mmol)、pdcl2(dppf)(0.329g,0.450mmol)和乙酸鉀(2.65g,27.0mmol),在110℃下攪拌3小時。過濾該混合物,并濃縮濾液,得到粗產物,通過柱(pe/etoac=10:1,rf=0.4)純化,得到呈黃色固體的3-(2-(芐氧基)乙氧基)-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(4.5g,8.21mmol,產率91%):1hnmr(400mhz,chloroform-d)δ8.13(s,1h),7.46-7.35(m,3h),7.32-7.25(m,5h),6.84(d,j=8.8hz,2h),5.41(s,2h),4.62(s,2h),4.20(t,j=4.9hz,2h),3.83(t,j=4.9hz,2h),3.77(s,3h),1.32(s,12h);es-lcmsm/z492.2(m+h)。
步驟4:2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸乙酯
在n2氣氛下,向3-(2-(芐氧基)乙氧基)-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(4.2g,8.55mmol)在1,4-二噁烷(60ml)和水(20ml)中的混合物中加入2-氯-4-甲基嘧啶-5-羧酸乙酯(1.715g,8.55mmol)、pdcl2(dppf)(0.625g,0.855mmol)和cs2co3(5.57g,17.09mmol)。在120℃下,攪拌該混合物2小時,過濾,并濃縮濾液,得到粗產物,通過柱(pe/etoac=3:1,rf=0.4)純化,得到呈褐色固體的2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)-氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸乙酯(4.1g,6.77mmol,產率79%):1hnmr(400mhz,chloroform-d)δ9.09(s,1h),8.86(s,1h),8.11(d,j=1.3hz,1h),7.39(d,j=8.8hz,2h),7.23(d,j=16.3hz,5h),6.81(d,j=8.4hz,2h),5.42(s,2h),4.59(s,2h),4.39-4.32(m,2h),4.26(t,j=4.9hz,2h),3.83(t,j=4.6hz,2h),3.73(s,3h),2.79(s,3h),1.36(t,j=7.1hz,3h);es-lcmsm/z530.2(m+h)。
步驟5:2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸
向2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸乙酯(4g,7.55mmol)在thf(20ml)和水(20ml)中的混合物中加入lioh(0.543g,22.66mmol)。在50℃下,攪拌該混合物12小時,然后用飽和的hcl(2n)處理,直到得到ph=7。過濾該混合物,并干燥濾液,得到呈黃色固體的2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(2.6g,4.44mmol,產率58.8%):1hnmr(400mhz,methanol-d4)δ8.89(s,1h),8.77(d,j=1.8hz,1h),8.20(d,j=1.8hz,1h),7.42(d,j=8.8hz,2h),7.35-7.12(m,5h),6.88(d,j=8.8hz,2h),5.41(s,2h),4.61(s,2h),4.34-4.25(m,2h),3.90-3.82(m,2h),3.77(s,3h),2.77(s,3h):es-lcmsm/z502.2(m+h)。
中間體16:3-氨基-n-(2-(二甲基氨基)乙基)-5-(三氟甲基)苯磺酰胺
步驟1:3-硝基-5-(三氟甲基)苯-1-磺酰氯
經15分鐘,向在-10℃下于n2氣氛下攪拌的3-硝基-5-(三氟甲基)苯胺(4.6g,22.32mmol)在濃hcl(20ml)和乙酸(6ml)中的溶液中滴加在h2o(3ml)中的亞硝酸鈉(1.694g,24.55mmol)。攪拌該反應混合物45分鐘,同時將溫度保持在-10℃至-5℃之間。當重氮化完成時,將冰醋酸(60ml)置于100ml燒杯中,并進行磁力攪拌。由具有浸入乙酸表面以下的燒結端的氣泡管引入二氧化硫,直到明顯飽和。向該溶液中加入氯化銅(i)(0.552g,5.58mmol)。繼續引入二氧化硫直到黃-綠色懸浮液變成青綠色。在此期間(15-20min),大部分的固體溶解。然后,將該混合物置于冰浴中,冷卻,同時攪拌。當溫度接近10℃時,經10分鐘期間向該二氧化硫溶液中分批加入重氮化反應混合物。在每次加入之后出現相當多的泡沫,并且在加入期間溫度上升,但是不會超過30℃。在加入所有的重氮鹽混合物之后,將該混合物傾倒入冰水中。然后,將該溶液分配在etoac(60ml)和飽和的nahco3(30ml)溶液之間。將合并的有機層用鹽水(20ml)洗滌,經na2so4干燥,過濾并濃縮,得到呈黃色油狀物的粗產物3-硝基-5-(三氟甲基)苯-1-磺酰氯(4.42g,9.16mmol,產率41.0%)。通過tlc(pe/etoac=10:1,rf=0.5)檢測粗產物:1hnmr(400mhz,cdcl3)δ9.07(s,1h),8.85(s,1h),8.61(s,1h)。
步驟2:n-(2-(二甲基氨基)乙基)-3-硝基-5-(三氟甲基)苯磺酰胺
向在25℃下攪拌的3-硝基-5-(三氟甲基)苯-1-磺酰氯(2g,6.91mmol)在dcm(15ml)中的溶液中一次性加入n,n-二甲基乙烷-1,2-二胺(0.913g,10.36mmol)。在25℃下,在n2氣氛下,攪拌反應混合物1小時。lcms分析顯示起始物質消失,將溶液分配在dcm(60ml)和飽和的nahco3(30ml)溶液之間。將合并的有機萃取物用鹽水(20ml)洗滌,經na2so4干燥,過濾并濃縮。通過硅膠柱色譜(dcm/meoh=20:1至10:1)純化粗物質。將通過tlc(dcm/meoh=10:1,rf=0.4)發現包含產物的所有級分合并,并濃縮,得到黃色油狀物的n-(2-(二甲基氨基)乙基)-3-硝基-5-(三氟甲基)苯磺酰胺(1.200g,3.41mmol,產率49.4%):1hnmr(400mhz,cdcl3)δ8.90(s,1h),8.67(s,1h),8.46(s,1h),3.14-3.07(m,2h),2.97(s,1h),2.45-2.39(m,2h),2.15(s,6h);es-lcmsm/z:342.1(m+h)。
步驟3:3-氨基-n-(2-(二甲基氨基)乙基)-5-(三氟甲基)苯磺酰胺
向在n2氣氛下攪拌的n-(2-(二甲基氨基)乙基)-3-硝基-5-(三氟甲基)苯磺酰胺(1.2g,3.52mmol)在甲醇(20ml)中的溶液中一次性加入pd/c(10%,0.374g,0.352mmol)。然后,在真空下,使該懸浮液脫氣,并用h2吹掃三次。在25℃下,在15psi的h2氣氛下,攪拌該混合物12小時。lcms分析顯示起始物質消失。經由硅藻土墊過濾反應混合物,并用dcm(30ml)洗滌濾餅。將合并的濾液濃縮至無水,得到黃色油狀物的粗產物3-氨基-n-(2-(二甲基氨基)乙基)-5-(三氟甲基)苯磺酰胺(1g,3.08mmol,產率88.0%):1hnmr(400mhz,cdcl3)δ7.43(s,1h),7.32(s,1h),7.04(s,1h),4.19(br.s.,2h),3.00(t,j=5.8hz,2h),2.34(t,j=5.8hz,2h),2.10(s,6h);es-lcmsm/z:312.1(m+h)。
中間體17:(1-(4-氨基-2-(三氟甲基)苯基)乙基)氨基甲酸叔丁酯
步驟1:2-(4-氨基-2-(三氟甲基)苯基)丙酰胺
在60℃下,攪拌2-(4-氨基-2-(三氟甲基)苯基)丙腈(800mg,3.74mmol)在硫酸(8ml,150mmol)中的混合物2小時。將該反應混合物慢慢地加入到冰水(20ml)中,并通過50%naoh的過量溶液堿化。用etoac(50ml×2)萃取該混合物。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮,得到2-(4-氨基-2-(三氟甲基)苯基)丙酰胺(700mg,2.86mmol,產率77.0%)。tlc(pe/etoac=1:1,rf=0.5).1hnmr(400mhz,cd3od)δ7.39(d,j=8.0hz,1h),6.99(d,j=2.0hz,1h),6.89(dd,j=2.4,8.4hz,1h),3.90(q,j=7.2hz,1h),1.44(d,j=7.2hz,3h);es-lcmsm/z233.0(m+h)。
步驟2:2-(4-(1,3-二氧代異吲哚啉-2-基)-2-(三氟甲基)苯基)丙酰胺
向2-(4-氨基-2-(三氟甲基)苯基)丙酰胺(700mg,3.01mmol)在乙酸(10ml)中的混合物中加入異苯并呋喃-1,3-二酮(670mg,4.52mmol)。在120℃下,攪拌該混合物16小時。將該混合物濃縮,加入飽和的nahco3溶液(10ml),并用etoac(50ml×2)萃取。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮。通過硅膠柱色譜(pe/etoac=5:1~2:1)純化粗產物。將通過tlc(pe/etoac=2:1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到黃白色固體的2-(4-(1,3-二氧代異吲哚啉-2-基)-2-(三氟甲基)苯基)丙酰胺(900mg,2.434mmol,產率81.0%):1hnmr(400mhz,cd3od)δ8.03-7.96(m,2h),7.95-7.88(m,3h),7.86(d,j=2.0hz,1h),7.78(dd,j=1.6,8.4hz,1h),4.16(q,j=6.8hz,1h),1.58(d,j=7.2hz,3h);es-lcmsm/z363.0(m+h)。
步驟3:(1-(4-(1,3-二氧代異吲哚啉-2-基)-2-(三氟甲基)苯基)乙基)氨基甲酸叔丁酯
向2-(4-(1,3-二氧代異吲哚啉-2-基)-2-(三氟甲基)-苯基)-丙酰胺(900mg,2.484mmol)在叔丁醇(15ml)中的混合物中分批加入[雙(三氟乙酰氧基)碘]苯(1602mg,3.73mmol)。在85℃下,攪拌該混合物30分鐘。向上述混合物中加入吡啶(0.603ml,7.45mmol)。在85℃下,攪拌該反應混合物2小時,然后濃縮,得到粗產物。通過硅膠柱色譜(pe/etoac=5:1~2:1)純化粗物質。將通過tlc(pe/etoac=2:1,rf=0.6)發現包含產物的所有級分合并并濃縮,得到淺黃色固體的(1-(4-(1,3-二氧代異吲哚啉-2-基)-2-(三氟甲基)苯基)乙基)氨基甲酸叔丁酯(660mg,1.291mmol,產率52.0%):1hnmr(400mhz,cd3od)δ7.97(dd,j=3.2,5.6hz,2h),7.88(dd,j=3.2,5.6hz,2h),7.80-7.78(m,2h),7.76-7.72(m,1h),5.15-5.08(m,1h),1.40(s,12h);es-lcmsm/z457.0(m+na)。
步驟4:(1-(4-氨基-2-(三氟甲基)苯基)乙基)氨基甲酸叔丁酯
向(1-(4-(1,3-二氧代異吲哚啉-2-基)-2-(三氟甲基)苯基)乙基)氨基甲酸叔丁酯(660mg,1.519mmol)在乙醇(10ml)中的混合物中加入肼(0.281ml,7.60mmol)。在80℃下,攪拌該混合物3小時。然后,將該混合物過濾并濃縮。通過制備tlc(pe/etoac=1:1,rf=0.6)純化粗物質,得到黃白色固體的(1-(4-氨基-2-(三氟甲基)苯基)-乙基)氨基甲酸叔丁酯(400mg,1.052mmol,產率69.2%):1hnmr(400mhz,cd3od)δ7.31(d,j=8.4hz,1h),6.93-6.92(m,1h),6.88-6.86(m,1h),5.00-4.99(m,1h),1.39-1.29(m,12h)es-lcmsm/z327.1(m+na)。
中間體18:4-(2-(吡咯烷-1-基)乙基)-3-(三氟甲基)苯胺
步驟1:2-(4-硝基-2-(三氟甲基)苯基)乙酸
向在冰浴中于0℃下攪拌的2-(2-(三氟甲基)苯基)乙腈(3g,16.20mmol)在h2so4(15ml)中的溶液中慢慢地加入硝基過酸鉀(potassiumnitroperoxousacid)(1.638g,16.20mmol)。然后,在0℃下,攪拌該混合物1小時。tlc(pe/ea=2:1,rf=0.35)分析顯示起始物質消失,加入15g的冰,并將該混合物加熱至110℃15小時。tlc(pe/ea=1:1,rf=0.25)分析顯示起始物質消失,并且觀察到想要的產物。將該反應混合物冷卻至20℃,滴加加入20ml20ml的冰水,并攪拌30分鐘。將懸浮液過濾通過硅藻土墊,用水(10ml×3)洗滌濾餅,在真空中干燥,得到純產物2-(4-硝基-2-(三氟甲基)苯基)乙酸(3.5g,13.35mmol,產率82.0%):1hnmr(400mhz,cd3od)δ8.52(d,j=2.0hz,1h),8.47-8.44(m,1h),7.78(d,j=8.4hz,1h),3.98(s,2h)。
步驟2:2-(4-硝基-2-(三氟甲基)苯基)-1-(吡咯烷-1-基)乙酮
向2-(4-硝基-2-(三氟甲基)苯基)乙酸(2.5g,10.03mmol)在吡啶(20ml)中的溶液中一次性加入吡咯烷(1.070g,15.05mmol),然后滴加2,4,6-三丙基-1,3,5,2,4,6-三氧雜三膦烷(trioxatriphosphinane)2,4,6-三氧化物(13ml,10.03mmol)。在20℃下,攪拌該混合物3小時。lcms分析顯示起始物質消失。加入40ml的冰水,并用etoac(50ml×2)萃取該混合物。將合并的有機層物用鹽水(30ml)洗滌,蒸干,得到粗產物,通過硅膠柱色譜(dcm/meoh=20:1至15:1)純化,得到呈褐色固體的純產物2-(4-硝基-2-(三氟甲基)苯基)-1-(吡咯烷-1-基)乙酮(2.189g,5.36mmol,產率53.4%):1hnmr(400mhz,cd3od)δ8.51(d,j=2.2hz,1h),8.45-8.43(m,1h),7.69(d,j=8.4hz,1h),4.03(s,2h),3.60(t,j=6.8hz,2h),3.45(t,j=7.0hz,2h),2.09-2.00(m,2h),1.96-1.89(m,2h);es-lcms:m/z303.1(m+h)。
步驟3:2-(4-氨基-2-(三氟甲基)苯基)-1-(吡咯烷-1-基)乙酮
向在n2氣氛下攪拌的2-(4-硝基-2-(三氟甲基)苯基)-1-(吡咯烷-1-基)乙酮(2.19g,7.25mmol)在甲醇(15ml)中的溶液中一次性加入pd/c(10%,0.077g,0.725mmol)。在真空下使懸浮液脫氣,并用h2吹掃三次。lcms分析顯示起始物質消失,將反應混合物過濾通過硅藻土墊,并用meoh洗滌濾餅。將合并的濾液濃縮至無水,得到粗產物,通過硅膠柱色譜(pe/ea=3:1至1:1)純化,得到呈黃色固體的純產物2-(4-氨基-2-(三氟甲基)苯基)-1-(吡咯烷-1-基)乙酮(1.44g,4.97mmol,產率68.6%):1hnmr(400mhz,cdcl3)δ7.17(d,j=8.4hz,1h),6.94(d,j=2.4hz,1h),6.80-6.77(m,1h),3.80(br.s.,2h),3.69(s,2h),3.51(t,j=6.8hz,2h),3.41(t,j=6.8hz,2h),1.99-1.91(m,2h),1.90-1.81(m,2h);es-lcms:m/z273.1(m+h)。
步驟4:4-(2-(吡咯烷-1-基)乙基)-3-(三氟甲基)苯胺
向2-(4-氨基-2-(三氟甲基)苯基)-1-(吡咯烷-1-基)乙酮(1.44g,5.29mmol)在四氫呋喃(thf)(15ml)中的溶液中分批加入bh3.dms(3.01ml,31.7mmol)。然后,在18℃下,攪拌該混合物12小時。在lcms分析顯示起始物質消失之后,在冰浴中將該混合物冷卻至0℃。然后,滴加2ml的meoh淬滅該混合物。在真空下除去溶劑。將殘余物溶于dcm(60ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。經na2so4干燥有機層,過濾并濃縮,得到黃色固體的4-(2-(吡咯烷-1-基)乙基)-3-(三氟甲基)苯胺(1.2g,4.04mmol,產率76.0%):1hnmr(400mhz,cdcl3)δ7.17(d,j=8.2hz,1h),6.92(d,j=2.0hz,1h),6.79(dd,j=1.8,8.2hz,1h),3.79(br.s.,2h),3.36-3.24(m,2h),3.23-3.14(m,2h),2.93-2.84(m,2h),2.82-2.71(m,2h),2.26-2.13(m,2h),1.91(t,j=7.2hz,2h);es-lcms:m/z271.0(m+bh3),259.1(m+h)。
中間體19:2-氯嘧啶-5-胺
在0℃下,向2-氯-5-硝基嘧啶(5g,31.3mmol)和鋅(20.49g,313mmol)在甲醇(150ml)中的溶液中加入氯化銨(16.77g,313mmol)。在25℃下,攪拌得到的混合物16小時。在lcms分析顯示起始物質消失之后,過濾該混合物。濃縮濾液,得到粗產物,通過柱色譜(pe/ea=3/1至1/1)純化。將通過tlc(pe/ea=1/1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到黃色固體的2-氯嘧啶-5-胺(1g,7.72mmol,產率24.63%):1hnmr(400mhz,methanol-d4)δ8.04(s,2h);es-lcmsm/z130.1(m+h)。
中間體20:4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯胺
步驟1:1-乙基-4-(5-氟-2-(三氟甲基)芐基)哌嗪
在20℃下,攪拌5-氟-2-(三氟甲基)苯甲醛(2g,10.41mmol)和1-乙基哌嗪(1.783g,15.62mmol)在dcm(60ml)中的溶液。在2小時之后,加入三乙酰氧基硼氫化鈉(6.62g,31.2mmol)。在20℃下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后,將該混合物溶于h2o(30ml)中,并用飽和的nahco3調節至ph8。將有機層用鹽水洗滌,并經na2so4干燥。在過濾之后,濃縮濾液,得到粗產物,通過柱色譜(dcm/meoh=0至20:1)純化,得到黃色油狀物的1-乙基-4-(5-氟-2-(三氟甲基)芐基)哌嗪(3g,8.74mmol,產率84%):1hnmr(400mhz,cd3od)δ7.77(dd,j=8.8,5.2hz,1h),7.63(dd,j=10.0,2.0hz,1h),7.21(dt,j=8.4,2.4hz,1h),3.80(s,2h),3.24(br.s.,4h),3.13(q,j=7.6hz,2h),2.77(br.s.,4h),1.34(t,j=7.2hz,3h);es-lcmsm/z:291.1(m+h)。
步驟2:1-乙基-4-(5-氟-4-硝基-2-(三氟甲基)芐基)哌嗪
向1-乙基-4-(5-氟-2-(三氟甲基)芐基)哌嗪(3g,10.33mmol)在硫酸(6ml,113mmol)中的溶液中加入硝酸(0.716g,11.37mmol)。在室溫下,攪拌得到的混合物過夜。在50℃下,攪拌該混合物2小時。在tlc分析(pe/ea=10:1)顯示起始物質消失之后,通過naoh水溶液將該混合物調節至ph8,并用ea(50ml×2)萃取。將有機層用h2o(50ml)和鹽水(50ml)洗滌,然后經na2so4干燥并過濾。濃縮濾液,得到黃色油狀物的1-乙基-4-(5-氟-4-硝基-2-(三氟甲基)芐基)-哌嗪(2.2g,6.56mmol,產率63.5%):1hnmr(400mhz,cd3od)δ8.39(d,j=7.0hz,1h),7.92(d,j=12.0hz,1h),3.75(s,2h),2.60-2.47(m,10h),1.14-1.10(m,3h);es-lcmsm/z336.1(m+h)。
步驟3:4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯胺
向1-乙基-4-(5-氟-4-硝基-2-(三氟甲基)芐基)哌嗪(2.2g,6.56mmol)和鋅(4.29g,65.6mmol)在甲醇(100ml)中的溶液中分批加入氯化銨(3.51g,65.6mmol)。在20℃下,攪拌得到的混合物12小時。在lcms分析顯示起始物質消失之后,過濾該混合物。濃縮濾液,得到粗產物,通過制備hplc(流動相a∶含有0.05%nh3.h2o的水溶液/流動相bmecn/流速:80ml/min/檢測∶uv220nm/254nm/柱:phenomenexgeminic18250*50mm,10um/柱溫:rt/梯度分布描述:40-70(b%))純化,得到黃色固體的4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯胺(0.7g,2.265mmol,產率34.5%):1hnmr(400mhz,cd3od)δ7.31(d,j=12.6hz,1h),7.10(d,j=8.6hz,1h),3.51(s,2h),2.74-2.15(m,10h),1.10(t,j=7.3hz,3h);es-lcmsm/z:306.1(m+h)。
中間體21:
2-(6-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸
步驟1:2-氯-4-(2-甲氧基乙氧基)吡啶
向冷卻至0℃的2-甲氧基乙醇(5.62g,73.8mmol)在thf(100ml)中的混合物中分批加入60%nah(2.95g,73.8mmol),接著加入2-氯-4-硝基吡啶(9g,56.8mmol)。在25℃下,攪拌整個混合物10小時。濃縮該混合物,得到殘余物,通過硅膠柱色譜(pe/etoac=8:1~2:1)純化。通過tlc(pe/etoac=5:1,rf=0.5)發現含有產物的所有級分合并,并濃縮,得到黃色油狀物的2-氯-4-(2-甲氧基乙氧基)吡啶(11g,55.7mmol,產率98.0%):1hnmr(400mhz,cdcl3)δ8.15(d,j=4.6hz,1h),6.87-6.72(m,2h),4.19-4.08(m,2h),3.77-3.67(m,2h),3.41(s,3h);lcms(m/z)188.1(m+h)。
步驟2:5-溴-2-氯-4-(2-甲氧基乙氧基)吡啶.
向2-氯-4-(2-甲氧基乙氧基)吡啶(11g,58.6mmol)和h2so4(100ml,1876mmol)的溶液中加入nbs(11.48g,64.5mmol)。然后,在50℃下,攪拌該混合物4小時。在冷卻至室溫之后,將該混合物傾倒入冷水(500ml)中,用2mol/l的naoh中和至ph=7.5。用etoac(200ml×3)萃取該混合物。經na2so4干燥有機層,過濾并濃縮。通過硅膠柱色譜(5%etoac:95%石油醚,100g硅膠柱)純化粗產物。將通過tlc(etoac:石油醚=1:5,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到黃色油狀物的5-溴-2-氯-4-(2-甲氧基乙氧基)吡啶(6.9g,23.30mmol,產率39.7%):1hnmr(400mhz,cdcl3)δ8.31(s,1h),6.83(s,1h),4.27-4.18(m,2h),3.83-3.76(m,2h),3.45(s,3h);es-lcmsm/z266.0,268.0(m+h)。
步驟3:5-溴-2-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶
向5-溴-2-氯-4-(2-甲氧基乙氧基)吡啶(4.0g,15.01mmol)、18-冠-6(0.198g,0.750mmol)和(4-甲氧基苯基)甲醇(2.488g,18.01mmol)在甲苯(50ml)中的混合物中加入koh(2.53g,45.0mmol)。在110℃下,攪拌整個混合物2小時。將該混合物過濾并濃縮,得到粗產物,通過硅膠柱色譜(10%etoac∶90%石油醚,50g硅膠柱)純化。將通過tlc(etoac∶石油醚=1:5,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到呈白色固體的5-溴-2-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶(5.0g,12.22mmol,產率81.0%):1hnmr(400mhz,cdcl3)δ8.13(s,1h),7.38(d,j=8.8hz,2h),6.92(d,j=8.4hz,2h),6.27(s,1h),5.27(s,2h),4.20-4.12(m,2h),3.82(s,3h),3.80(d,j=4.4hz,2h),3.48(s,3h);es-lcmsm/z:368.1,370.1(m+h)。
步驟4:2-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶
在氮氣氛下,在-78℃下,向5-溴-2-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶(2g,5.43mmol)在thf(30ml)中的混合物中慢慢地加入buli(3.26ml,2.5n,8.15mmol);在-78℃下,攪拌該混合物0.5小時。然后,向該混合物中加入2-異丙氧基-4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷(1.213g,6.52mmol),并在-78℃下攪拌該反應混合物1小時。然后,濃縮該混合物,得到殘余物,用dcm(30ml×2)萃取。用鹽水(30ml)洗滌有機萃取物,經na2so4干燥,過濾并濃縮,得到黃色固體的2-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(2.5g,2.71mmol,產率49.9%):1hnmr(400mhz,cd3od)δ7.34(d,j=8.4hz,3h),6.92-6.88(m,3h),5.25-5.22(m,2h),4.14-4.10(m,2h),3.77(s,3h),3.48-3.43(m,2h),3.41-3.38(m,3h),1.35-1.29(m,12h);lcms(m/z):416.1(m+h)。
步驟5:2-(6-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸乙酯
在80℃下,在n2氣氛下,攪拌2-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(2g,4.82mmol)、pdcl2(dppf)(0.176g,0.241mmol)、2-氯-4-甲基嘧啶-5-羧酸乙酯(1.159g,5.78mmol)、k2co3(4.82ml,9.63mmol)在1,4-二噁烷(20ml)和水(5ml)中的懸浮液2小時。濃縮該混合物,得到殘余物,用dcm(40ml×2)萃取。用鹽水(40ml)有機萃取物,經na2so4干燥,過濾并濃縮,并通過硅膠柱色譜(10%etoac:90%石油醚,20g硅膠柱)純化。將通過tlc(etoac:石油醚=1:5,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到白色固體的2-(6-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基-嘧啶-5-羧酸乙酯(1.1g,1.941mmol,產率40.3%):1hnmr(400mhz,cd3od)δ9.18-9.13(m,1h),8.50-8.44(m,1h),7.39(d,j=8.4hz,2h),6.95-6.89(m,2h),6.56-6.51(m,1h),5.49(s,1h),5.33(s,1h),4.47-4.36(m,3h),4.25-4.17(m,2h),3.81-3.77(m,3h),3.76-3.71(m,2h),3.34(s,3h),2.85(s,2h),1.45-1.40(m,3h);lcms(m/z)454.1(m+h)。
步驟6:2-(6-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸
在60℃下,攪拌2-(6-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸乙酯(1.1g,2.426mmol)、氫氧化鋰、h2o(0.305g,7.28mmol)在thf(15ml)和水(5ml)中的懸浮液12小時。濃縮該混合物,得到殘余物。通過制備hplc(柱∶phenomenexgeminic18250*5010u;流動相∶0.05%氨水-acn;梯度∶在30min內從12到42的b;流速∶90ml/min;波長∶220/254nm)純化粗產物,并凍干,得到白色固體的2-(6-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(800mg,1.692mmol,產率69.8%):1hnmr(400mhz,cd3od)δ8.93-8.86(m,1h),8.35-8.27(m,1h),7.39(d,j=8.8hz,2h),6.94-6.85(m,2h),6.51(s,1h),5.32(s,2h),4.23-4.18(m,2h),3.81-3.77(m,3h),3.72-3.68(m,2h),3.31(br.s.,3h),2.78-2.74(m,3h);lcms(m/z):426.1(m+h)。
中間體22:2-氟-4-((4-甲基哌嗪-1-基)甲基)-5-(三氟甲基)苯胺
步驟1:1-(5-氟-2-(三氟甲基)芐基)-4-甲基哌嗪
在25℃下,攪拌5-氟-2-(三氟甲基)苯甲醛(4g,20.82mmol)和1-甲基哌嗪(3.13g,31.2mmol)在dcm(150ml)中的溶液。在2小時之后,加入氰基硼氫化鈉(3.93g,62.5mmol)。在25℃下,攪拌得到的混合物16小時。lcms分析顯示起始物質消失。用h2o(80ml)洗滌該混合物。將有機層用鹽水(50ml)洗滌,并經na2so4干燥。在過濾之后,濃縮濾液,得到粗產物,通過柱色譜(dcm至dcm/meoh=20/1)純化。將通過tlc(dcm/meoh=20/1,rf=0.4)發現包含產物的所有級分合并,并濃縮,得到黃色油狀物的1-(5-氟-2-(三氟甲基)芐基)-4-甲基哌嗪(2.41g,產率37%):1hnmr(400mhz,methanol-d4)d=7.73(dd,j=8.4,5.6hz,1h),7.60(d,j=10.0hz,1h),7.17(t,j=8.4hz,1h),3.70(s,2h),2.55(brs,8h),2.32(s,3h);es-lcmsm/z:277.2(m+h)。
步驟2:1-(5-氟-4-硝基-2-(三氟甲基)芐基)-4-甲基哌嗪
向1-(5-氟-2-(三氟甲基)芐基)-4-甲基哌嗪(3g,10.86mmol)在硫酸(20ml)中的溶液中滴加硝酸(0.728ml,16.29mmol)。在60℃下,攪拌得到的混合物16小時。lcms分析顯示起始物質消失。將該混合物傾倒到冰-水中,并用naoh水溶液調節至ph=8。用ea(50ml×2)萃取該混合物。將有機層用鹽水(30ml)洗滌,經硫酸鈉干燥,過濾并濃縮,得到褐色固體的1-(5-氟-4-硝基-2-(三氟甲基)芐基)-4-甲基哌嗪(3.3g,9.76mmol,產率90%):1hnmr(400mhz,methanol-d4)δ8.41(d,j=7.2hz,1h),7.93(d,j=12.0hz,1h),3.78(s,2h),2.78(brs,4h),2.62(br.s.,4h),2.48(s,3h);es-lcmsm/z:322.1(m+h)。
步驟3:2-氟-4-((4-甲基哌嗪-1-基)甲基)-5-(三氟甲基)苯胺
在25℃下,在h2氣氛下,攪拌1-(5-氟-4-硝基-2-(三氟甲基)芐基)-4-甲基哌嗪(3.3g,10.27mmol)和10%pd/c(0.4g,0.376mmol)在甲醇(100ml)中的溶液2小時。lcms分析顯示起始物質消失。過濾該混合物。濃縮濾液,得到粗產物,通過柱色譜(dcm/meoh=50:1至20:1)純化。將通過tlc(dcm/meoh=10:1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到褐色固體的2-氟-4-((4-甲基哌嗪-1-基)甲基)-5-(三氟甲基)苯胺(1.4g,4.09mmol,產率39.8%):1hnmr(400mhz,甲醇-d4)δ7.31(d,j=12.4hz,1h),7.10(d,j=8.8hz,1h),3.51(s,2h),2.53(br.s.,8h),2.32-2.29(m,3h);es-lcmsm/z292.1(m+h)。
中間體23:2-((4-甲氧基芐基)氧基)-3-(2-甲氧基乙氧基)-5-(4,4,5,5-四-甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶
步驟1:5-溴-2-氯吡啶-3-醇
在100℃下,攪拌5-溴-2-氯-3-甲氧基吡啶(36g,162mmol)在氫溴酸(200ml,3683mmol)中的混合物48小時。然后,濃縮該混合物,用飽和的nahco3溶液堿化,并用etoac(600ml×2)萃取。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮。通過硅膠柱色譜(pe/etoac=1:0~2:1)純化粗物質。將通過tlc(pe/etoac=2:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的5-溴-2-氯吡啶-3-醇(21g,86mmol,產率52.9%):1hnmr(400mhz,methanol-d4)δ7.96(t,j=2.0hz,1h),7.47(d,j=2.4hz,1h);-es-lcmsm/z208.0,210.0(m+h)。
步驟2:5-溴-2-氯-3-(2-甲氧基乙氧基)吡啶
在60℃下,在n2氣氛下,攪拌5-溴-2-氯吡啶-3-醇(5g,23.99mmol)、1-溴-2-甲氧基-乙烷(5.00g,36.0mmol)和k2co3(6.63g,48.0mmol)在dmf(15ml)中的溶液16小時。lcms分析顯示起始物質消失。過濾該混合物,并濃縮濾液,得到粗產物,通過柱色譜(pe至pe/ea=5/1)純化。將通過tlc(pe/ea=5/1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到白色固體的5-溴-2-氯-3-(2-甲氧基乙氧基)吡啶(5g,18.39mmol,產率77%):1hnmr(400mhz,chloroform-d)δ8.07(s,1h),7.39-7.32(m,1h),4.21-4.18(m,2h),3.82-3.80(m,2h),3.47(d,j=3.2hz,3h);es-lcmsm/z265.9,267.9(m+h)。
步驟3:5-溴-2-((4-甲氧基芐基)氧基)-3-(2-甲氧基乙氧基)吡啶
在0℃下,向5-溴-2-氯-3-(2-甲氧基乙氧基)吡啶(5.3g,19.89mmol)在dmf(50ml)中的溶液中加入60%nah(1.193g,29.8mmol)。在0.5小時之后,加入(4-甲氧基苯基)甲醇(3.30g,23.86mmol)。在70℃下,攪拌得到的混合物16小時。在真空下除去溶劑。將殘余物分配在ea(60ml)和水(40ml)之間,用etoac(60ml×2)萃取。將有機層用鹽水(40ml)洗滌,經硫酸鈉干燥,過濾并濃縮,得到粗產物,通過柱色譜(pe/ea=10:1至5:1)純化。將通過tlc(pe/ea=5:1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到黃色固體的5-溴-2-((4-甲氧基芐基)氧基)-3-(2-甲氧基乙氧基)吡啶(4.3g,11.09mmol,產率55.8%):1hnmr(400mhz,methanol-d4)δ7.76(d,j=1.8hz,1h),7.41(d,j=2.0hz,1h),7.37(d,j=8.8hz,2h),6.89(d,j=8.8hz,2h),5.29(s,2h),4.14-4.12(m,2h),3.78(s,3h),3.74-3.71(m,2h),3.38(s,3h);es-lcmsm/z368.0,370.0(m+h)。
步驟4:2-((4-甲氧基芐基)氧基)-3-(2-甲氧基乙氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶
在90℃下,在n2氣氛下,攪拌5-溴-2-((4-甲氧基芐基)氧基)-3-(2-甲氧基乙氧基)吡啶(3g,8.15mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-雙(1,3,2-二氧雜硼雜環戊烷)(2.276g,8.96mmol)、pdcl2(dppf)(0.596g,0.815mmol)和乙酸鉀(1.599g,16.29mmol)在1,4-二噁烷(100ml)中的溶液2小時。lcms分析顯示起始物質消失。過濾該混合物。濃縮濾液,得到粗產物,通過柱色譜(pe/ea=10:1至5:1)純化。將通過tlc(pe/ea=5/1,rf=0.45)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的2-((4-甲氧基芐基)氧基)-3-(2-甲氧基乙氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(3.6g,7.80mmol,產率96%):1hnmr(400mhz,methanol-d4)δ8.03(s,1h),7.43(s,1h),7.37(d,j=8.4hz,2h),6.88(d,j=8.4hz,2h),5.33(s,2h),4.13-4.10(m,2h),3.77(s,3h),3.73-3.70(m,2h),3.37(s,3h),1.33(s,12h);es-lcmsm/z296.2(m+h-pmb).
中間體24:4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯胺
步驟1:1-(5-氟-2-(三氟甲基)苯基)-n,n-二甲基甲胺
攪拌2-(溴甲基)-4-氟-1-(三氟甲基)苯(0.5g,1.945mmol)、二甲胺鹽酸鹽(0.190g,2.334mmol)、et3n(0.597ml,4.28mmol)在乙腈(20ml)中的混合物過夜。然后,濃縮該混合物,得到殘余物,用dcm(20ml×2)萃取,經na2so4干燥并濃縮,得到1-(5-氟-2-(三氟甲基)-苯基)-n,n-二甲基甲胺(400mg,1.808mmol,產率93%):1hnmr(400mhz,cd3od)δ7.71-7.75(m,1h),7.55-7.58(m,1h),7.15-7.19(m,1h),3.62(s,2h),2.29(s,6h);es-lcmsm/z222(m+h)。
步驟2:1-(5-氟-4-硝基-2-(三氟甲基)苯基)-n,n-二甲基甲胺
在0℃下,向1-(5-氟-2-(三氟甲基)苯基)-n,n-二甲基甲胺(100mg,0.452mmol)在h2so4(24.10μl,0.452mmol)中的混合物中滴加硝酸(28.5mg,0.452mmol)。攪拌該混合物30分鐘,然后,傾倒入冰/水中。將該混合物用飽和的nahco3溶液調節至ph=9,用dcm(20ml×2)萃取,經na2so4干燥并濃縮,得到1-(5-氟-4-硝基-2-(三氟甲基)苯基)-n,n-二甲基甲胺(100mg,0.376mmol,產率83%):1hnmr(400mhz,cd3od)δ7.62-7.64(m,1h),7.12-7.15(m,1h),2.89(s,2h),1.52(s,6h);es-lcmsm/z267(m+h)。
步驟3:4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯胺
向1-(5-氟-4-硝基-2-(三氟甲基)苯基)-n,n-二甲基甲胺(4.6g,17.28mmol)和鋅(11.30g,173mmol)在甲醇(50ml)中的混合物中加入nh4cl(9.24g,173mmol)。在15℃下,攪拌該混合物12小時。過濾該混合物,并濃縮濾液,得到殘余物,將其分配在dcm(100ml)和h2o(50ml)之間,用dcm(100ml×2)萃取。將有機萃取物用鹽水(50ml)洗滌,經na2so4干燥,過濾并濃縮,得到3.5g的粗產物。在通過制備hplc(儀器∶dc/柱∶gemini-c18150*25mm*10ul/流動相a∶水(+0.1%hcl)/流動相b∶乙腈/梯度∶43-63b%)/流速∶25ml/min/運行時間∶15min)純化之后,得到黃白色固體的4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯胺二鹽酸鹽(560.65mg,1.814mmol,產率10.5%):1hnmr(400mhz,meod-d4)δ7.42(d,j=11.6hz,1h),7.27(d,j=8.4hz,1h),4.34(s,2h),2.88(s,6h);es-lcmsm/z237.1(m+h)。
中間體25:(1-(4-氨基-2-(三氟甲基)苯基)-2-甲基-丙烷-2-基)氨基甲酸叔丁酯
步驟1:2,2-二甲基-3-(2-(三氟甲基)苯基)丙酸乙酯
向冷卻至-30℃的異丁酸乙酯(37.9g,326mmol)在thf(1l)中的混合物中滴加lda(188ml,377mmol)。在-30℃下,攪拌該混合物1小時。在-30℃下,向該混合物中加入1-(溴甲基)-2-(三氟甲基)苯(60g,251mmol)在thf(150ml)中的溶液。在-30℃下,攪拌整個混合物1小時,然后在25℃下攪拌1小時。用nh4cl(aq,200ml)淬滅該混合物。將該混合物加入到h2o(200ml)中,并用etoac(800ml×3)萃取。將有機層用鹽水(800ml)洗滌,經na2so4干燥,過濾并濃縮。在硅膠柱色譜(pe/etoac=200:1)上純化粗物質。將通過tlc(pe/etoac=10:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的2,2-二甲基-3-(2-(三氟甲基)苯基)丙酸乙酯(57.5g,產率83.2%):1hnmr(400mhz,cdcl3)δ7.62(d,j=7.9hz,1h),7.46-7.38(m,1h),7.29(t,j=7.6hz,1h),7.22(d,j=7.7hz,1h),4.17(q,j=7.1hz,2h),3.14(s,2h),1.25(t,j=7.2hz,3h),1.17(s,6h)。
步驟2:2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酸乙酯
向冷卻至0℃下的2,2-二甲基-3-(2-(三氟甲基)苯基)丙酸乙酯(115g,419.1mmol)在h2so4(500ml)的溶液中分批加入kno3(44.4g,440.8mmol)。在0℃下,攪拌該混合物30分鐘。將該混合物傾倒入冰-水(1.5l)中,并用etoac(1l×3)萃取。將合并的有機層用飽和的na2co3溶液(1l×3)洗滌,經na2so4干燥并濃縮,得到褐色油狀物的2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酸乙酯(120g,376.1mmol,產率89.5%):1hnmr(400mhz,cdcl3)8.53(d,j=2.0hz,1h),8.29(dd,j=2.0,8.5hz,1h),7.49(d,j=8.5hz,1h),4.20(q,j=7.0hz,2h),3.25(s,2h),1.27(t,j=7.0hz,3h),1.24-1.17(m,6h);es-lcmsm/z:320(m+h)。
步驟3:2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酸
向2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酸乙酯(20g,62.6mmol在thf(60ml)中的溶液中加入naoh(39.2ml,313mmol)。在80℃下,攪拌該混合物12小時。然后,除去thf。用濃hcl將該混合物的ph調節至ph=1-2。用dcm(30ml×3)萃取該混合物。將有機相用水(20ml×2)和鹽水(20ml)洗滌,經na2so4干燥,過濾并濃縮。通過硅膠柱色譜(硅膠=20g)(從pe/etoac=10:1到pe/etoac=1:1)純化粗物質。將通過tlc(pe/etoac=1:1,rf=0.3)發現包含產物的所有級分合并,并濃縮,得到黃色固體的2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酸(16.04g,52.3mmol,產率84%):1hnmr(400mhz,cdcl3)δ8.55(d,j=2.2hz,1h),8.41-8.26(m,1h),7.70-7.54(m,1h),3.29(s,2h),1.28(s,6h)。
步驟4:2-甲基-1-(4-硝基-2-(三氟甲基)苯基)丙-2-胺
將et3n(8.21ml,58.9mmol)加入到2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酸(16.04g,55.1mmol)在甲苯(160ml)中的溶液中。在0℃下,加入疊氮磷酸二苯酯(diphenylphosphorazidate)(16.22g,58.9mmol),并在0℃下,攪拌該混合物1小時。在20℃下,再攪拌該混合物1小時,然后將混合物在100℃下攪拌3小時。將該溶液冷卻,并用水(3×50ml)洗滌,分離甲苯相,經na2so4干燥,并在真空中蒸發。加入15%鹽酸(36ml)和乙酸(36ml)的混合物,并在20℃下攪拌得到的混合物12小時。將該混合物分配在etoac(30ml)和水(40ml)之間。用etoac(3×20ml)萃取水層。然后,用2nnaoh調節水層至ph=9,并用etoac(3×30ml)萃取。在真空中濃縮合并的有機相,得到黃色油狀物的2-甲基-1-(4-硝基-2-(三氟甲基)苯基)丙-2-胺(8g,27.5mmol,產率49.9%):1hnmr(400mhz,cdcl3)δ8.55(d,j=1.8hz,1h),8.33(dd,j=1.8,8.4hz,1h),8.03-7.86(m,1h),3.00(s,2h),1.18(s,6h);es-lcmsm/z263.4(m+h)。
步驟5:(2-甲基-1-(4-硝基-2-(三氟甲基)-苯基)-丙烷-2-基)-氨基甲酸叔丁酯
向2-甲基-1-(4-硝基-2-(三氟甲基)苯基)丙烷-2-胺(6g,22.88mmol)在thf(60ml)中的溶液中加入氫氧化鈉(22.88ml,45.8mmol)和二叔丁基二碳酸酯(5.99g,27.5mmol)。在20℃下,攪拌該混合物12小時。然后,將該溶液分配在乙酸乙酯(20ml)和水(40ml)之間。用乙酸乙酯(3×30ml)萃取水相。將合并的有機萃取物用鹽水(40ml)洗滌,經na2so4干燥,過濾并濃縮,得到(2-甲基-1-(4-硝基-2-(三氟甲基)苯基)丙烷-2-基)氨基甲酸叔丁酯(6.675g,16.12mmol,產率70.5%)。tlc(pe/etoac=5:1,rf=0.6):1hnmr(400mhz,cdcl3)δ8.54(s,1h),8.39-8.25(m,1h),7.58(d,j=8.4hz,1h),3.40(br.s.,2h),1.51(s,9h),1.25(s,6h);es-lcmsm/z307.3(m-t-bu+h)。
步驟6:(1-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙烷-2-基)氨基甲酸叔丁酯
向(2-甲基-1-(4-硝基-2-(三氟甲基)-苯基)丙烷-2-基)氨基甲酸叔丁酯(6.675g,18.42mmol)在甲醇(60ml)中的懸浮液中加入鈀碳(10%水溶液,0.196g,1.842mmol)。在20℃下,在h2氣氛(15psi)下,氫化該混合物5小時。然后,過濾該溶液并濃縮,得到黃色油狀物的(1-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙烷-2-基)氨基甲酸叔丁酯(4.5g,8.53mmol,產率46.3%):tlc(pe/ea=1:1,rf=0.4);1hnmr(400mhz,cd3od)δ7.78(s,1h),7.51(d,j=7.9hz,1h),7.28(d,j=8.4hz,1h),3.34(s,2h),1.52(s,9h),1.18(br.s.,6h)。
中間體26:3-氨基-n-(2-(二甲基氨基)乙基)-5-(三氟甲基)苯甲酰胺
步驟1:3-硝基-5-(三氟甲基)苯甲酸
向3-(三氟甲基)苯甲酸(5g,26.3mmol)在硫酸(50ml,938mmol)中的混合物中加入硝酸(3.53ml,79mmol)。在0℃下,攪拌該混合物15分鐘,并且經1小時升溫至90℃。然后,將該混合物滴加到冰水中。接著,過濾該混合物,得到白色固體的3-硝基-5-(三氟甲基)苯甲酸(5g,20.20mmol,產率77%):1hnmr(400mhz,methanol-d4)δ8.99(s,1h),8.72(s,1h),8.61(s,1h)。
步驟2:n-(2-(二甲基氨基)乙基)-3-硝基-5-(三氟甲基)苯甲酰胺
向3-硝基-5-(三氟甲基)苯甲酸(500mg,2.127mmol)在dcm(20ml)中的混合物中加入n1,n1-二甲基乙烷-1,2-二胺(0.112ml,2.339mmol)、hatu(970mg,2.55mmol)和diea(0.557ml,3.19mmol)。在25℃下,攪拌該混合物16小時。然后,加入飽和的nahco3溶液(20ml)。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮,得到n-(2-(二甲基氨基)乙基)-3-硝基-5-(三氟甲基)-苯甲酰胺(400mg,1.114mmol,產率52.4%)。tlc(dcm/meoh=15:1,rf0.4):1hnmr(400mhz,methanol-d4)δ8.98(s,1h),8.67(s,1h),8.59(s,1h),3.57(t,j=6.5hz,2h),2.60(t,j=6.5hz,2h),2.34-2.29(m,6h);es-lcmsm/z306.1(m+h)。
步驟3:3-氨基-n-(2-(二甲基氨基)乙基)-5-(三氟甲基)苯甲酰胺
向n-(2-(二甲基氨基)乙基)-3-硝基-5-(三氟甲基)苯甲酰胺(400mg,1.310mmol)在甲醇(20ml)中的混合物中加入pd/c(10%,40mg)。在25℃下,在氫氣下,攪拌該混合物16小時。然后,過濾該混合物并濃縮,得到3-氨基-n-(2-(二甲基氨基)乙基)-5-(三氟甲基)苯甲酰胺(300mg,0.926mmol,產率70.7%)。tlc(dcm/meoh=10:1,rf=0.2):1hnmr(400mhz,methanol-d4)δ7.28(d,j=10.8hz,2h),7.03(s,1h),3.50(t,j=6.7hz,2h),2.55(t,j=6.7hz,2h),2.30(s,6h);es-lcmsm/z276.1(m+h)。
本發明的化合物的制備
實施例1:1-(2-氟-4-(7-氧代-6,7-二氫呋喃并[2,3-c]吡啶-4-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:(3-氟-4-(3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲基)苯基)硼酸
向1-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(6g,11.76mmol)、nh4oac(2.72g,35.3mmol)在丙酮(50ml)和水(50ml)中的混合物中加入naio4(7.54g,35.3mmol)。然后,在25℃下攪拌混合物12小時。接著,濃縮該混合物,得到殘余物,用dcm(20ml×2)萃取。將有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮,得到黃白色固體的(3-氟-4-(3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲基)苯基)硼酸(4.5g,9.32mmol,產率79%):1hnmr(400mhz,cdcl3)δ8.12-8.08(m,1h),7.80(s,1h),7.57-7.44(br,3h),6.65-6.63(d,j=8.8hz,1h),4.93-4.91(d,j=6.4hz,2h),4.66-4.64(d,j=7.6hz,2h),1.74(s,3h);es-lcmsm/z429.1(m+h)。
步驟2:(e)-3-(呋喃-3-基)丙烯酸
向呋喃-3-甲醛(2.3g,23.94mmol)在吡啶(15ml)中的懸浮液中加入丙二酸(2.74g,26.3mmol)。加入哌啶(0.204g,2.394mmol),并在100℃下攪拌該混合物12小時。然后,將該混合物冷卻至室溫。接著,將該溶液傾倒入水(10ml)中,用6mhcl酸化。用ea稀釋得到的溶液。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。得到(e)-3-(呋喃-3-基)丙烯酸(2.49g,18.03mmol,產率75%)。tlc(pe/ea=5:1,rf=0.6):1hnmr(400mhz,cd3od)δ7.81(s,1h),7.59(s,1h),7.55-7.52(d,j=12.8hz,1h),6.73(s,1h),6.20-6.16(d,j=15.6hz,1h);es-lcmsm/z139.0(m+h)。
步驟3:(e)-3-(呋喃-3-基)丙烯酰基疊氮化物
向(e)-3-(呋喃-3-基)丙烯酸(2.49g,18.03mmol)在thf(10ml)中的溶液中加入et3n(2.189g,21.63mmol)。加入dppa(5.46g,19.83mmol),并將該混合物在25℃下靜置4小時。然后,將溶液分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。用meoh洗滌殘余物,并過濾,得到淺黃色固體的(e)-3-(呋喃-3-基)丙烯酰基疊氮化物(3.46g,21.21mmol,產率118%):1hnmr(400mhz,cdcl3)δ8.76(s,1h),7.46(s,1h),4.16(s,3h);1hnmr(400mhz,cd3cl)δ7.69(s,1h),7.65-7.61(d,j=16hz,1h),7.43(s,1h),6.58(s,1h),6.15-6.11(d,j=16hz,1h)。
步驟4:呋喃并[2,3-c]吡啶-7(6h)-酮
向(e)-3-(呋喃-3-基)丙烯酰基疊氮化物(3.46g,21.21mmol)在1,2-二氯苯(31.2g,212mmol)中的溶液中加入i2(0.022g,0.085mmol)。將該混合物在180℃下靜置2小時。然后濃縮該溶液。通過硅膠柱色譜(pe/ea=1:1)純化殘余物。將通過tlc(dcm/meoh=10:1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的呋喃并[2,3-c]吡啶-7(6h)-酮(765mg,5.66mmol,產率26.7%):1hnmr(400mhz,cd3od)δ7.96-7.95(d,j=2.0hz,1h),7.20-7.18(d,j=6.8hz,1h),6.84-6.83(d,j=2.0hz,1h),6.70-6.68(d,j=6.8hz,1h);es-lcmsm/z241(m+h)。
步驟5:4-溴呋喃并[2,3-c]吡啶-7(6h)-酮
向呋喃并[2,3-c]吡啶-7(6h)-酮(20mg,0.148mmol)在acoh(5ml)中的溶液中加入br2(7.63μl,0.148mmol)。將該混合物在25℃下靜置2小時。然后,將溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。得到4-溴呋喃并[2,3-c]吡啶-7(6h)-酮(16mg,0.075mmol,產率50.5%)。tlc(pe/ea=5:1,rf=0.6):es-lcmsm/z214.9-215.9(m+h).
步驟6:1-(2-氟-4-(7-氧代-6,7-二氫呋喃并[2,3-c]吡啶-4-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
將(3-氟-4-(3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲基)苯基)硼酸(100mg,0.234mmol)在1,4-二噁烷(1.8ml)和水(0.600ml)中的懸浮液加入到4-溴呋喃并[2,3-c]吡啶-7(6h)-酮(50mg,0.234mmol)在1,4-二噁烷(1.8ml)和水(0.600ml)中的溶液中。加入pdcl2(dppf)(17.09mg,0.023mmol)和cs2co3(190mg,0.584mmol),并在110℃下,在微波下攪拌該混合物30分鐘。然后,將該混合物冷卻至室溫。接著,將溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過制備hplc(mecn/h2o作為洗脫液,酸性條件)純化殘余物,得到黃色固體的1-(2-氟-4-(7-氧代-6,7-二氫呋喃并[2,3-c]吡啶-4-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(16.89mg,0.033mmol,產率13.97%):1hnmr(400mhz,cd3od)δ8.22-8.20(m,1h),8.06(s,1h),7.80(s,1h),7.56-7.53(m,1h),7.38-7.33(m,3h),7.03(s,1h),6.63-6.61(d,j=8.8hz,1h),4.90-4.88(d,j=7.2hz,2h),4.64-4.62(d,j=7.6hz,2h),1.72(s,3h);es-lcmsm/z518.1(m+h)。
實施例2:1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲
步驟1:2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯胺
在n2下向在20℃下攪拌的4-溴-2-氟苯胺(40g,211mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-雙(1,3,2-二氧雜硼雜環戊烷)(64.1g,253mmol)和koac(41.3g,421mmol)在1,4-二噁烷(500ml)中的溶液中一次性加入pdcl2(dppf)(7.70g,10.53mmol)。在100℃下,攪拌反應混合物3小時。在真空下濃縮溶液,得到2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯胺(44g,158mmol,產率74.9%):1hnmr(400mhz,cdcl3)δ7.46-7.40(m,2h),6.75-6.71(m,1h),1.30(s,j=3.6hz,12h);es-lcmsm/z238.1(m+h)。
步驟2:4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯胺
向5-溴-3-乙氧基-2-((4-甲氧基芐基)氧基)吡啶(5g,14.78mmol)在1,4-二噁烷(30ml)和水(10.0ml)中的混合物中加入5-溴-3-乙氧基-2-((4-甲氧基芐基)氧基)吡啶(5g,14.78mmol)、cs2co3(9.63g,29.6mmol)和pdcl2(dppf)(1.082g,1.478mmol)。在110℃下,在n2下攪拌該混合物16小時。然后,過濾該反應殘余物,并濃縮濾液,通過硅膠柱色譜(pe/ea=2/1)純化。將通過tlc(pe/ea=8/1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到白色固體的4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯胺(4g,9.77mmol,產率66.1%):1hnmr(400mhz,cd3od)δ7.83(d,j=2.0hz,1h),7.40-7.37(m,2h),7.34(d,j=2.0hz,1h),7.24-7.20(m,1h),7.17-7.14(m,1h),6.92-6.89(m,3h),5.33(s,2h),4.15-4.09(m,2h),3.78(s,3h),1.40(t,j=7.2hz,3h);es-lcmsm/z369.1(m+h)。
步驟3:3-乙氧基-5-(3-氟-4-異氰酰基苯基)-2-((4-甲氧基芐基)氧基)吡啶
將4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯胺(197mg,0.535mmol)在thf(10ml)中的懸浮液加入到三光氣(71.4mg,0.241mmol)在thf(10ml)中的溶液中。將該混合物在60℃下靜置5分鐘。然后,將該混合物冷卻至室溫。然后,濃縮溶液。得到3-乙氧基-5-(3-氟-4-異氰酰基苯基)-2-((4-甲氧基芐基)氧基)吡啶(200mg,0.507mmol,產率95%)。tlc(pe/ea=5/1,rf=0.5):es-lcmsm/z307.1(m-87h)。
步驟4:1-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲
將3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯胺(129mg,0.535mmol)在thf(10ml)中的懸浮液加入到3-乙氧基-5-(3-氟-4-異氰酰基苯基)-2-((4-甲氧基芐基)氧基)吡啶(212mg,0.535mmol)在thf(10ml)中的溶液中。加入et3n(0.186ml,1.337mmol)和dmap(6.53mg,0.053mmol),并在60℃下,攪拌該混合物10小時。將該混合物冷卻至室溫。然后,將溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過制備tlc(dcm/meoh=20/1,rf=0.4)純化殘余物,得到淺黃色固體的1-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲(80mg,0.126mmol,產率23.53%):1hnmr(400mhz,cd3od)δ8.22(s,1h),8.18(s,1h),7.98(s,1h),7.91(s,1h),7.74(s,1h),7.49(s,1h),7.49-7.37(m,6h),6.90-6.88(m,2h),5.33(s,2h),4.14-4.12(m,2h),3.78(s,3h),2.30(s,3h),1.42-1.39(t,j=7.0hz,3h);es-lcmsm/z636.0(m+h)。
步驟5:1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲
將1-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲(80mg,0.126mmol)在meoh(10ml)中的懸浮液加入到pd/c(26.8mg,0.252mmol)(10%)在meoh(10ml)中的溶液中。在26℃下,在h2氣氛下氫化該混合物10小時。然后,過濾該溶液并濃縮。通過制備hplc(mecn/h2o作為洗脫液,堿性條件)純化殘余物,得到白色固體的1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲(14.40mg,0.028mmol,產率22.20%)。tlc(dcm/meoh=10/1,rf=0.4):1hnmr(400mhz,cd3od)δ8.16(s,1h),8.11-8.10(d,j=1.6hz,1h),7.97(s,1h),7.74(s,1h),7.49(s,1h),7.36-7.35(m,3h),7.27(s,1h),7.22(s,1h),4.13-4.11(m,2h),2.26(s,3h),1.48-1.44(t,j=7.0hz,3h);es-lcmsm/z516.1(m+h)。
實施例3:1-(4-乙氧基-3-(三氟甲基)苯基)-3-(2-氟-4-(1-氧代-2,5,6,7-四氫-1h-環戊二烯并[c]吡啶-4-基)苯基)脲
步驟1:2-(2-乙氧基-2-氧代乙基)環戊-1-烯羧酸乙酯
在120℃下,攪拌2-(三苯基亞膦基)乙酸乙酯(89g,256mmol)、2-氧代環戊烷羧酸乙酯(40g,256mmol)在甲苯(300ml)中的混合物34小時。然后,除去溶劑,并用ea(2×200ml)萃取殘余物,將合并的有機相用鹽水(40ml)洗滌,并經無水na2so4干燥,過濾,并濃縮濾液,通過柱(pe:ea=20:1)純化殘余物,得到呈黃色油狀物的2-(2-乙氧基-2-氧代乙基)環戊-1-烯羧酸乙酯(15g,產率23%):1hnmr(400mhz,cdcl3)δ4.13(m,4h),3.66(s,2h),3.31(m,2h),2.29(m,2h),1.84(m,2h),1.28(m,8h);es-lcmsm/z227.1(m+h)。
步驟2:1-氧代-1,5,6,7-四氫環戊二烯并[c]吡喃-4-羧酸乙酯
在120℃下,攪拌2-(2-乙氧基-2-氧代乙基)環戊-1-烯羧酸乙酯(7.5g,33.1mmol)、1,1-二甲氧基-n,n-二甲基甲胺(3.95g,33.1mmol)在dmf(50ml)中的混合物2小時,除去溶劑,并通過柱(pe:ea=5:1)純化殘余物,得到呈黃色油狀物的1-氧代-1,5,6,7-四氫環戊二烯并[c]吡喃-4-羧酸乙酯(1.2g,產率10.61%):1hnmr(400mhz,cd3od)δ4.18(m,5h),1.88(m,2h),1.21(m,5h);es-lcmsm/z209.1(m+h).
步驟3:2,5,6,7-四氫-1h-環戊二烯并[c]吡啶-1-酮
在80℃下,攪拌1-氧代-1,5,6,7-四氫環戊二烯并[c]吡喃-4-羧酸乙酯(200mg,0.961mmol)、氨水(0.208ml,9.61mmol)在etoh(1ml)中的混合物2小時,濃縮溶劑,并通過制備tlc(dcm:meoh=10:1)純化殘余物,得到2,5,6,7-四氫-1h-環戊二烯并[c]吡啶-1-酮(23mg,產率16.67%):1hnmr(400mhz,cd3od)δ7.25(d,j=7.6hz,1h),6.40(d,j=6.4hz,1h),2.9-2.72(m,4h),2.06(m,2h);es-lcmsm/z136.1(m+h)。
步驟4:4-溴-2,5,6,7-四氫-1h-環戊二烯并[c]吡啶-1-酮
在25℃下,攪拌2,5,6,7-四氫-1h-環戊二烯并[c]吡啶-1-酮(34mg,0.252mmol)、溴(0.016ml,0.302mmol)在acoh(2ml)中的混合物1小時。出現褐色固體,除去溶劑,并通過制備tlc(dcm:meoh=40:1)純化殘余物,得到呈褐色固體的4-溴-2,5,6,7-四氫-1h-環戊二烯并[c]吡啶-1-酮(50mg,產率91%):1hnmr(400mhz,cd3od)δ7.48(s,1h),2.94(m,4h),2.15(m,2h);es-lcmsm/z215.9(m+2h)。
步驟5:4-(4-氨基-3-氟苯基)-2,5,6,7-四氫-1h-環戊二烯并[c]吡啶-1-酮
在90℃下,在微波下,攪拌4-溴-2,5,6,7-四氫-1h-環戊二烯并[c]吡啶-1-酮(20mg,0.093mmol)、2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯胺(22.15mg,0.093mmol)、pdcl2(dppf)(6.84mg,9.34μmol)、k2co3(25.8mg,0.187mmol)在1,4-二噁烷(3ml)和水(1ml)中的混合物30分鐘。lcms顯示反應完成,濃縮溶劑,并通過制備tlc(dcm:meoh=10:1)純化殘余物,得到4-(4-氨基-3-氟苯基)-2,5,6,7-四氫-1h-環戊二烯并[c]吡啶-1-酮(11mg,產率48.2%):1hnmr(400mhz,cd3od)δ7.27-7.25(m,1h),7.0-6.42(m,3h),2.96-2.78(m,4h),2.08(m,2h);es-lcmsm/z245.1(m+h)。
步驟6:1-(4-乙氧基-3-(三氟甲基)苯基)-3-(2-氟-4-(1-氧代-2,5,6,7-四氫-1h-環戊二烯并[c]吡啶-4-基)苯基)脲
在60℃下,攪拌4-乙氧基-3-(三氟甲基)苯胺(9.23mg,0.045mmol)、三光氣(6.01mg,0.020mmol)在thf(3ml)中的混合物0.5小時,lcms顯示反應完成,濃縮溶劑,得到1-乙氧基-4-異氰酰基-2-(三氟甲基)苯(10.1mg,0.041mmol,產率92%)。在60℃下,攪拌1-乙氧基-4-異氰酰基-2-(三氟甲基)苯(10mg,0.043mmol)、4-(4-氨基-3-氟苯基)-2,5,6,7-四氫-1h-環戊二烯并[c]吡啶-1-酮(10.57mg,0.043mmol)、et3n(6.03μl,0.043mmol)在thf(4ml)中的混合物30分鐘,濃縮溶劑,并通過制備hplc純化殘余物,得到1-(4-乙氧基-3-(三氟甲基)苯基)-3-(2-氟-4-(1-氧代-2,5,6,7-四氫-1h-環戊二烯并[c]吡啶-4-基)苯基)脲(5mg,產率24.31%):1hnmr(400mhz,cd3od)δ8.22(t,j=8.80hz,1h),7.75(d,j=2.4hz,1h),7.70(s,1h),7.55(m,1h),7.30(d,j=12hz,1h),7.23(d,j=7.2hz,1h),7.12(d,j=8.8hz,1h),4.14(t,j=6.8hz,2h),3.10(t,j=7.6hz,2h),2.97(t,j=7.6hz,2h),2.19(m,2h),1.39(t,j=7.2hz,3h);es-lcmsm/z476.1(m+h)。
實施例4:1-(2-氟-4-(4-氧代-4,5-二氫-1h-吡唑并[4,3-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:4-氯-1h-吡唑并[4,3-c]吡啶
在80℃下,攪拌2,4-二氯煙堿醛(800mg,4.55mmol)和肼(364mg,9.09mmol)在dme(10ml)中的混合物2小時,濃縮該溶劑,并通過柱色譜(dcm:meoh=20:1,800ml)純化殘余物,得到4-氯-1h-吡唑并[4,3-c]吡啶(400mg,2.474mmol,產率54.4%):1hnmr(400mhz,cdcl3)δ13.85(m,1h),8.31(s,1h),8.13(d,j=5.6hz,1h),7.60(d,j=5.6hz,1h);es-lcmsm/z154.0(m+h)。
步驟2:1h-吡唑并[4,3-c]吡啶-4(5h)-酮
在100℃下,攪拌4-氯-1h-吡唑并[4,3-c]吡啶(400mg,2.60mmol)、acoh(29.8ml,521mmol)和水(0.1ml)的混合物8小時,lcms顯示反應完成,濃縮溶劑,得到1h-吡唑并[4,3-c]吡啶-4-醇(300mg,2.027mmol,產率78%):1hnmr(400mhz,cdcl3)δ10.87(m,1h),8.06(s,1h),7.11(d,j=6.8hz,2h),6.42(d,j=6.8hz,2h)。
步驟3:7-溴-1h-吡唑并[4,3-c]吡啶-4(5h)-酮
在30℃下,攪拌1h-吡唑并[4,3-c]吡啶-4(5h)-酮(80mg,0.592mmol)、br2(0.031ml,0.592mmol)在acoh(5ml)中的混合物8小時,濃縮溶劑,并通過制備hplc純化殘余物,得到7-溴-1h-吡唑并[4,3-c]吡啶-4(5h)-酮(65mg,0.301mmol,產率50.8%):1hnmr(400mhz,dmso)δ13.2-12.9(m,1h),10.4-10.0(m,1h),7.7-7.3(m,1h),6.57-6.42(m,1h);es-lcmsm/z214.0,216.0(m+h)。
步驟4:1-(2-氟-4-(4-氧代-4,5-二氫-1h-吡唑并[4,3-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
在120℃下,在微波下,攪拌7-溴-1h-吡唑并[4,3-c]吡啶-4(5h)-酮(20mg,0.093mmol)、1-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(40.0mg,0.093mmol)、pdcl2(dppf)-dcm加合物(7.63mg,9.34μmol)、k2co3(25.8mg,0.187mmol)在dmf(2ml)和水(0.2ml)中的混合物130分鐘,濃縮溶劑,并通過制備tlc(dcm:meoh=10:1,rf=0.35)純化殘余物,然后通過制備hplc純化,得到1-(2-氟-4-(4-氧代-4,5-二氫-1h-吡唑并[4,3-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(1.33mg,2.480μmol,產率2.65%):1hnmr(400mhz,cd3od+dmso-d6)δ8.49-8.21(m,2h),7.84(d,j=2.8hz,1h),7.57-7.53(m,3h),7.31(s,1h),6.65(d,j=8.8hz,1h),4.91(m,2h),4.64(m,2h),1.72(s,1h);es-lcmsm/z518.1(m+h)。
實施例5:1-(5'-乙氧基-6-甲基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲
步驟1:5-氨基-5'-乙氧基-6-甲基-[2,3'-聯吡啶]-6'(1'h)-酮
在25℃下,在h2氣氛下,攪拌6'-(芐氧基)-5'-乙氧基-6-甲基-5-硝基-2,3'-二吡啶(150mg,0.411mmol)和pd/c(2.184mg,0.021mmol)在meoh(10ml)中的混合物1小時。然后,濃縮該混合物,得到殘余物,用dcm(20ml×2)萃取。將有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮。通過制備tlc(ea:pe=1:1)純化殘余物,得到5-氨基-5'-乙氧基-6-甲基-[2,3'-聯吡啶]-6'(1'h)-酮(80mg,0.245mmol,產率59.6%):1hnmr(400mhz,cd3od)δ7.46(d,j=2.00hz,1h),7.42(d,j=2.00hz,1h),7.30-7.28(m,1h),7.07-7.05(d,j=8.40hz,1h),4.14-4.08(m,2h);2.38(s,3h),1.45(t,j=7.00hz,3h);es-lcmsm/z246(m+h)。
步驟2:4-異氰酰基-1-異丙氧基-2-(三氟甲基)苯
向4-異丙氧基-3-(三氟甲基)苯胺鹽酸鹽(70mg,0.274mmol)在thf(10ml)中的混合物中加入et3n(0.038ml,0.274mmol)。然后,將混合物加熱至60℃30分鐘,濃縮該混合物,得到4-異氰酰基-1-異丙氧基-2-(三氟甲基)苯(60mg,0.224mmol,產率82%):es-lcmsm/z278(m+33)。
步驟3:1-(5'-乙氧基-6-甲基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲
向5-氨基-5'-乙氧基-6-甲基-[2,3'-聯吡啶]-6'(1'h)-酮(60mg,0.245mmol)和4-異氰酰基-1-異丙氧基-2-(三氟甲基)苯(60.0mg,0.245mmol)在thf(10ml)中的混合物中加入et3n(0.102ml,0.734mmol)。然后,加熱混合物至60℃30分鐘,濃縮該混合物,接著通過制備hplc純化,得到淺黃色固體的1-(5'-乙氧基-6'-羥基-6-甲基-[2,3'-聯吡啶]-5-基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲鹽酸鹽(54.09mg,0.102mmol,產率41.6%):1hnmr(400mhz,cd3od)δ8.83(m,1h),7.93(s,1h),7.79-7.73(d,j=11.2hz,1h),7.59(t,j=5.80hz,1h),7.44(s,1h),7.20-7.17(d,j=8.80hz,1h),4.72(t,j=6.20hz,1h),4.17(t,j=7.00hz,2h),2.77-2.75(d,j=8.00hz,3h),1.51(t,j=7.00hz,3h),1.36-1.34(d,j=6.00hz,6h);es-lcmsm/z491(m+h)。
實施例6:1-(3-(二氟甲基)-4-異丙氧基苯基)-3-(5'-乙氧基-6-甲基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)脲
步驟1:3-(二氟甲基)-4-異丙氧基苯胺
在25℃下,攪拌2-(二氟甲基)-1-異丙氧基-4-硝基苯(200mg,0.865mmol)、nh4cl(463mg,8.65mmol)和鋅(566mg,8.65mmol)在meoh(20ml)中的混合物2小時。將該混合物用dcm(200ml×2)萃取,經na2so4干燥并濃縮,得到3-(二氟甲基)-4-異丙氧基苯胺(150mg,0.482mmol,產率55.7%):1hnmr(400mhz,cd3od)δ6.90-6.80(m,3h),6.85(t,j=56.00hz,1h),4.50-4.38(m,1h),1.26-1.25(d,j=6.00hz,1h);es-lcmsm/z202(m+h)。
步驟2:2-(二氟甲基)-4-異氰酰基-1-異丙氧基苯
向3-(二氟甲基)-4-異丙氧基苯胺(200mg,0.994mmol)在thf(10ml)中的混合物中加入三光氣(118mg,0.398mmol)。然后,將混合物加熱至60℃30分鐘,濃縮該混合物,得到4-氰酰基-2-(二氟甲基)-1-異丙氧基苯(210mg,0.620mmol,產率62.4%);es-lcmsm/z260(m+33)。
步驟3:1-(3-(二氟甲基)-4-異丙氧基苯基)-3-(5'-乙氧基-6-甲基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)脲
向5-氨基-5'-乙氧基-6-甲基-[2,3'-聯吡啶]-6'(1'h)-酮(100mg,0.408mmol)、4-氰酰基-2-(二氟甲基)-1-異丙氧基苯(93mg,0.408mmol)在thf(10ml)中的混合物中加入et3n(0.114ml,0.815mmol)。然后,將混合物加熱至60℃30分鐘,濃縮,接著通過制備hplc純化,得到黃色固體的1-(3-(二氟甲基)-4-異丙氧基苯基)-3-(5'-乙氧基-6-甲基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)脲鹽酸鹽(16.72mg,0.032mmol,產率7.80%):1hnmr(400mhz,cd3od)δ8.71-8.69(d,j=8.40hz,1h),7.85-7.82(d,j=9.20hz,1h),7.68(d,j=2.00hz,1h),7.52-7.49(m,1h),7.43(d,j=2.40,1h),7.07(d,j=1.60hz,1h),6.93(t,j=52.0hz,1h),4.66-4.60(m,2h),4.17-4.12(m,3h),2.69(s,3h),1.47(t,j=7.00hz,3h),1.33-1.31(d,j=6.00hz,6h);es-lcmsm/z473(m+h)。
實施例7:1-(2-氟-4-(5-甲基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:2-氟-4-(6-甲氧基-5-甲基吡啶-3-基)苯胺
向(6-甲氧基-5-甲基吡啶-3-基)硼酸(300mg,1.797mmol),4-溴-2-氟苯胺(341mg,1.797mmol)在水(3ml)和1,4-二噁烷(9ml)中的混合物中加入cs2co3(1171mg,3.59mmol)和pdcl2(dppf)(65.7mg,0.090mmol)。然后,在100℃下,攪拌該混合物3小時。濃縮該混合物,得到殘余物,將其溶于ea和水中,用ea萃取,得到有機層。濃縮有機層,得到殘余物。通過硅膠柱色譜純化殘余物,得到呈黃色油狀物的2-氟-4-(6-甲氧基-5-甲基吡啶-3-基)苯胺(320mg,1.378mmol,產率77%)。1hnmr(400mhz,cdcl3)δ8.12(d,j=2.8hz1h),7.51(s,1h),7.17(dd,j=2.0hzand12hz,1h),7.19(dd,j=2.0hzand12hz,1h),6.84(dd,j=9.2hzand8.0hz,1h)3.97(s,3h),2.75(s,2h),2.22(s,3h),es-lcmsm/z233.1(m+h)。
步驟2:5-(4-氨基-3-氟苯基)-3-甲基吡啶-2(1h)-酮
在100℃下,在n2下,攪拌2-氟-4-(6-甲氧基-5-甲基吡啶-3-基)苯胺(170mg,0.732mmol)在hbr/h2o(10ml)中的溶液16小時。濃縮反應混合物,得到殘余物,并將殘余物溶于ea中。將有機相用飽和的nahco3溶液(10ml)、水(10ml)和鹽水(10ml)洗滌,經na2so4干燥,并在真空中蒸發,得到呈黃色固體的5-(4-氨基-3-氟苯基)-3-甲基吡啶-2(1h)-酮(120mg,0.550mmol,產率75%)。1hnmr(400mhz,cd3od)δ8.01(d,j=6hz1h),7.86(d,j=6hz1h)7.71(d,j=12hz,1h),7.60(m,2h),2.26(s,3h),es-lcmsm/z219.1(m+h)。
步驟3:1-(2-氟-4-(5-甲基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向在室溫下,在n2下攪拌的4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯胺(50mg,0.202mmol)在thf(10ml)中的溶液中加入三光氣(24.01mg,0.081mmol)。在50℃下,攪拌該混合物40分鐘。向混合物中加入5-(4-氨基-3-氟苯基)-3-甲基吡啶-2(1h)-酮(44.1mg,0.202mmol)和et3n(0.085ml,0.607mmol)。在50℃下,攪拌該混合物4小時,然后,通過hplc純化,得到1-(2-氟-4-(5-甲基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(26mg,0.052mmol,產率25.9%):1hnmr(400mhz,cd3od)δ8.17(t,j=8.4hz1h),7.86(dd,j=1.6hzand8hz2h)7.59(m,2h),7.40(m,2h),6.66(d,j=8hz1h),es-lcmsm/z492.1(m+h)。
實施例8:1-(5'-乙氧基-2-甲基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲
步驟1:5-溴-6-甲基吡啶-2-胺
0℃下,在n2下,攪拌6-甲基吡啶-2-胺(5g,46.2mmol)在meoh(20ml)中的溶液。將nbs(8.23g,46.2mmol)慢慢地加入到溶液中,在0℃下,攪拌反應混合物1小時。在室溫下,攪拌反應混合物16小時。然后,濃縮該溶液,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜純化殘余物,得到5-溴-6-甲基吡啶-2-胺(3g,16.04mmol,產率34.7%)。1hnmr(400mhz,cd3od)δ7.49(d,j=8.8hz,1h),6.33(d,j=8.8hz,1h),2.39(s,3h),es-lcmsm/z188.9(m+h)。
步驟2:4-異丙氧基-3-(三氟甲基)苯胺
在30℃下,在h2氣氛下攪拌1-異丙氧基-4-硝基-2-(三氟甲基)苯(2g,8.03mmol)和pd/c(0.2g,1.879mmol)在meoh(30ml)中的懸浮液。在30℃下,攪拌反應混合物4小時。過濾該反應混合物,并濃縮濾液,得到4-異丙氧基-3-(三氟甲基)苯胺(1.8g,7.06mmol,產率88%)。1hnmr(400mhz,cdcl3)δ7.84(m,2h),6.90(t,j=2.8hz,1h),6.85(s,1h),6.79(t,j=2.8hz,1h),4.52-4.43(m,1h),2.60(s,3h),1.32(d,j=2.8hz,6h)-;es-lcmsm/z220.0(m+h)。
步驟3:1-(5-溴-6-甲基吡啶-2-基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲
在60℃下,在n2氣氛下,攪拌5-溴-6-甲基吡啶-2-胺(1g,5.35mmol)和三光氣(0.714g,2.406mmol)在thf(20ml)中的溶液。在60℃下,攪拌反應混合物15分鐘。將et3n和4-異丙氧基-3-(三氟甲基)苯胺(1.172g,5.35mmol)加入到反應混合物中。在60℃下,攪拌該反應混合物16小時。然后,將該溶液冷卻至室溫,并經由
步驟4:1-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-2-甲基-[3,3'-聯吡啶]-6-基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲
在n2下,攪拌cs2co3(0.846g,2.60mmol)、pdcl2(dppf)(0.095g,0.130mmol)、3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(1g,2.60mmol)和1-(4-溴-2-氟苯基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲(1.130g,2.60mmol)在二噁烷/水(20ml)中的溶液。在120℃下,攪拌該反應混合物16小時。然后,濃縮該溶液,并通過硅膠柱色譜(pe/ea=3:1)純化殘余物,得到1-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-2-甲基-[3,3'-聯吡啶]-6-基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲(400mg,0.652mmol,產率25.1%);1hnmr(400mhz,cd3od)δ7.65(d,j=2hz,1h),7.62(m,3h),7.41(d,j=8.4hz,2h),7.22(d,j=2hz,1h),7.17(d,j=9.2hz,1h),7.04(d,j=8.4hz,1h),6.92(d,j=8.4hz,2h),5.36(s,2h),4.70(m,1h),4.09(m,2h),3.79(s,3h),3.14(d,j=2hz,3h),1.44(s,3h),1.20(s,6h).es-lcmsm/z611.1(m+h)。
步驟5:1-(5'-乙氧基-2-甲基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲
在25℃下,在n2下,攪拌1-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-2-甲基-[3,3'-聯吡啶]-6-基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲(400mg,0.655mmol)在tfa:dcm(20ml)中的溶液。在25℃下,攪拌反應混合物2小時。在真空中濃縮反應混合物。通過制備hplc(mecn/h2o作為洗脫液,酸性條件)純化殘余物,得到1-(5'-乙氧基-2-甲基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-異丙氧基-3-(三氟甲基)苯基)脲(34.63mg,0.071mmol,產率10.78%),1hnmr(400mhz,cd3oh)δ7.84(d,j=2.4hz,1h),7.60(m,2h),7.17(d,j=9.2hz,1h),7.03(d,j=8.4hz,1h),6.98(dd,j=7.6hz,j=2.0hz2h),4.57(s,1h),4.15(m,2h),2.52(s,3h),1.45(t,j=6.8hz,3h),1.33(d,j=6.0hz,3h),es-lcmsm/z491.2(m+h)。
實施例9:1-(5'-乙氧基-5-甲基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲
步驟1:3-(4-異氰酰基-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯
向3-(4-氨基-2-(三氟甲基)苯基)-2,2-二甲基丙酸酯(300mg,1.037mmol)在thf(30ml)中的溶液中分批加入三光氣(108mg,0.363mmol)。在60℃下,攪拌該混合物并回流30分鐘。在lcms分析顯示起始物質消失之后。將反應溶液蒸干,得到3-(4-異氰酰基-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯(250mg,0.725mmol,產率69.9%):es-lcmsm/z348.1(m+meoh)。
步驟2:3-(4-(3-(5-溴-3-甲基吡啶-2-基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯
向2-((3-(4-異氰酰基-2-(三氟甲基)苯基)-2,2-二甲基丙酰基)氧基)乙烷-1-基鎓(250mg,0.795mmol)、5-溴-3-甲基吡啶-2-胺(149mg,0.795mmol)在thf(30ml)中的溶液中加入dmap(194mg,1.591mmol)和et3n(0.222ml,1.591mmol)。在60℃下,攪拌該混合物3小時。在lcms分析顯示起始物質消失之后,用ea(40ml)萃取反應混合物,并用水(15ml)和鹽水(15ml)洗滌有機層。將有機相蒸干,并通過制備tlc(pe/ea=1/1,rf=0.4)純化殘余物,得到純產物3-(4-(3-(5-溴-3-甲基吡啶-2-基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯(200mg,0.262mmol,產率32.9%):1hnmr(400mhz,cdcl3)δ8.32(d,j=2.4hz,1h),8.03(d,j=2.4hz,1h),7.81(d,j=1.6hz,1h),7.63(d,j=8.8hz,1h),7.24(d,j=5.6hz,1h),4.17(d,j=7.2hz,2h),3.10(s,2h),2.32(s,3h),1.26(s,3h),1.18(s,6h);es-lcmsm/z502.1(m+h)。
步驟3:3-(4-(3-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-5-甲基-[3,3'-聯吡啶]-6-基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯
將具有2-((3-(4-(3-(5-溴-3-甲基吡啶-2-基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酰基)氧基)乙烷-1-基鎓(100mg,0.199mmol),3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(77mg,0.199mmol)、pdcl2(dppf)(14.60mg,0.020mmol)和cs2co3(195mg,0.598mmol)在1,4-二噁烷(3ml)和水(1ml)中的溶液的反應容器密封,并在微波中于110℃下加熱20分鐘。在lcms分析顯示觀察到正確的產物之后,將反應溶液蒸干,并用dcm(40ml)萃取殘余物,用h2o(15ml)和鹽水(15ml)洗滌。經na2so4干燥有機層,過濾并濃縮。通過制備tlc(dcm/meoh=20/1,rf=0.45)純化殘余物,得到純產物2-((3-(4-(3-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-5-甲基-[3,3'-聯吡啶]-6-基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酰基)氧基)乙烷-1-基鎓(50mg,0.067mmol,產率33.6%):1hnmr(400mhz,dmso-d6)δ8.88(br.s.,1h),8.59(s,1h),8.02-8.07(m,2h),7.74(d,j=8.4hz,1h),7.60(d,j=1.8hz,1h),7.41(d,j=8.8hz,2h),7.23(d,j=8.4hz,1h),6.95(d,j=8.8hz,2h),5.34(s,2h),4.06-4.21(m,4h),3.76(s,3h),3.01(s,2h),2.36(s,3h),1.35(t,j=7.0hz,3h),1.08-1.31(m,9h);es-lcmsm/z681.2(m+h)。
步驟4:1-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-5-甲基-[3,3'-聯吡啶]-6-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲
向3-(4-(3-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-5-甲基-[3,3'-聯吡啶]-6-基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯(50mg,0.073mmol)在thf(10ml)中的溶液中分批加入lah(8.36mg,0.220mmol)。在0℃下,攪拌該混合物1小時。在lcms分析顯示起始物質消失之后,用水(2ml)、naoh(6ml)和水(2ml)淬滅反應溶液。然后,用dcm(30ml)萃取該混合物,并用鹽水(10ml)洗滌。經na2so4干燥有機層,過濾并濃縮。通過制備tlc(dcm/meoh=40/1,rf=0.54)純化殘余物,得到純產物1-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-5-甲基-[3,3'-聯吡啶]-6-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲(40mg,0.047mmol,產率63.6%):1hnmr(400mhz,cd3od)δ8.50(s,1h),8.02-7.95(m,2h),7.91(br.s.,1h),7.70(d,j=8.6hz,1h),7.50-7.44(m,2h),7.41(d,j=8.6hz,2h),6.92(d,j=8.8hz,2h),5.38(s,2h),4.60(s,2h),4.17(q,j=7.0hz,2h),3.82-3.76(m,3h),2.80(s,2h),2.40(s,3h),1.44(t,j=7.0hz,3h),0.86(s,6h);es-lcmsm/z639.2(m+h)。
步驟5:1-(5'-乙氧基-5-甲基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲
在20℃下,攪拌在hcl中的1-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-5-甲基-[3,3'-聯吡啶]-6-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲(20mg,0.031mmol)在meoh(8ml,32.0mmol)中的溶液30分鐘。在lcms分析顯示起始物質消失之后,將反應混合物蒸干,并通過制備hplc(儀器∶db/柱∶asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b:mecn/流速:25ml/min/梯度分布描述:40-60(b%))純化,得到黃白色固體的1-(5'-乙氧基-5-甲基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲(7.36mg,0.014mmol,產率44.1%):1hnmr(400mhz,cd3od)δ8.50(s,1h),8.37(d,j=2.0hz,1h),8.03(d,j=2.0hz,1h),7.63(d,j=8.8hz,1h),7.52(d,j=8.4hz,1h),7.47(d,j=2.4hz,1h),7.25(d,j=2.2hz,1h),4.18-4.136(m,2h),3.32(br.s.,2h),2.82(s,2h),2.54(s,3h),1.49(t,j=7.0hz,3h),0.86(s,6h);es-lcmsm/z519.1(m+h)。
實施例10:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(1-羥基乙基)-3-(三氟甲基)苯基)脲
步驟1:2-氯-5-異氰酰基-4-甲基嘧啶
向2-氯-4-甲基嘧啶-5-胺(300mg,2.090mmol)在thf(20ml)中的溶液中一次性加入三光氣(620mg,2.090mmol)。在60℃下,攪拌該混合物20分鐘。lcms分析顯示起始物質消失:es-lcmsm/z202.1(m+meoh)。
步驟2:1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-氯-4-甲基嘧啶-5-基)脲
向1-(4-氨基-2-(三氟甲基)苯基)乙酮(419mg,2.064mmol)在thf(20ml)中的溶液中加入dmap(126mg,1.032mmol)、et3n(0.863ml,6.19mmol)和2-氯-5-異氰酰基-4-甲基嘧啶(350mg,2.064mmol)在thf(5ml)中的溶液。在60℃下,攪拌回流該混合物1小時。在lcms分析顯示起始物質消失之后。將反應溶液用dcm(60ml)萃取,并用h2o(20ml)和鹽水(20ml)洗滌。經na2so4干燥有機層,過濾并濃縮。通過硅膠柱色譜(pe/ea=2/1至1/2)純化殘余物,得到純產物1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-氯-4-甲基嘧啶-5-基)脲(300mg,0.757mmol,產率36.7%):1hnmr(400mhz,cd3od)δ9.05(s,1h),7.97(s,1h),7.77-7.71(m,2h),2.55(s,3h),2.51(s,3h);es-lcmsm/z373.0(m+h)。
步驟3:1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
在微波中,在110℃下,攪拌1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-氯-4-甲基嘧啶-5-基)脲(200mg,0.537mmol)、3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(207mg,0.537mmol)、pdcl2(dppf)(39.3mg,0.054mmol)和cs2co3(524mg,1.610mmol)在1,4-二噁烷(3ml)和水(1ml)中的溶液20分鐘。在lcms分析顯示觀察到正確的物質之后。將反應溶液蒸干,用dcm(40ml)萃取,并用h2o(10ml)和鹽水(10ml)洗滌。通過制備tlc(dcm/meoh=20/1,rf=0.52)純化殘余物,得到給定產物1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(250mg,0.243mmol,產率45.4%):1hnmr(400mhz,cd3od)δ9.09(s,1h),8.66(d,j=2.0hz,1h),8.06(d,j=1.6hz,1h),7.98(s,1h),7.74(d,j=2.0hz,1h),7.71(s,1h),7.39(d,j=8.8hz,2h),6.89(d,j=8.8hz,2h),5.36(s,2h),4.17-4.12(m,2h),3.77(s,3h),2.56(s,3h),2.54(s,3h),1.42(t,j=7.0hz,3h);es-lcmsm/z476.1(m-pmb+h),596.1(m+h)。
步驟4:1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(1-羥基乙基)-3-(三氟甲基)苯基)脲
向1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(140mg,0.235mmol)在thf(5ml)中的溶液中分批加入nabh4(44.5mg,1.175mmol)。在20℃下,攪拌該混合物3小時。在lcms分析顯示起始物質消失之后。滴加水(10ml)以淬滅反應溶液。用ea(30ml)萃取該混合物,并用鹽水(10ml)洗滌。經na2so4干燥有機層,過濾并濃縮。通過制備tlc(dcm/meoh=20/1,rf=0.56)純化殘余物,得到產物1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(1-羥基乙基)-3-(三氟甲基)苯基)脲(100mg,0.100mmol,產率42.7%):1hnmr(400mhz,cd3od)δ9.10(s,1h),8.67(d,j=1.8hz,1h),8.08(d,j=1.8hz,1h),7.87(d,j=2.0hz,1h),7.75(d,j=8.8hz,1h),7.65(d,j=8.8hz,1h),7.40(d,j=8.4hz,2h),6.91(d,j=8.8hz,2h),5.38(s,2h),5.16(d,j=6.0hz,1h),4.18-4.13(m,2h),3.78(s,3h),2.57(s,3h),1.47-1.42(m,3h),1.40(d,j=7.2hz,3h);es-lcmsm/z598.1(m+h)。
步驟5:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(1-羥基乙基)-3-(三氟甲基)苯基)脲
向1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(1-羥基乙基)-3-(三氟甲基)苯基)脲(80mg,0.134mmol)在meoh(20ml)中的溶液中分批加入10%pd/c(14.25mg,0.134mmol)。在室溫下,在h2氣氛下攪拌該混合物1小時。在lcms分析顯示起始物質消失之后。過濾反應混合物,并蒸干濾液。然后,通過制備hplc(儀器∶gilson215/柱∶geminic1810u150*25mm/流動相a∶水(0.01mol/l(nh4)hco3)/流動相b∶mecn/流速:25ml/min/梯度分布描述:28-58(b%))純化殘余物,得到純產物1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(1-羥基乙基)-3-(三氟甲基)苯基)脲(8.61mg,0.018mmol,產率13.35%):1hnmr(400mhz,cd3od)δ9.05(s,1h),8.08(d,j=2.0hz,1h),7.88(br.s.,2h),7.77(d,j=8.6hz,1h),7.67(d,j=8.6hz,1h),5.18(d,j=6.0hz,1h),4.18-4.13(m,2h),2.56(s,3h),1.49(t,j=7.0hz,3h),1.42(d,j=6.6hz,3h);es-lcmsm/z478.1(m+h)。
實施例11:1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲
步驟1:4-溴-2-氟-1-異氰酰基苯
向4-溴-2-氟苯胺(720mg,3.79mmol)在thf(30ml)中的混合物中加入三光氣(450mg,1.516mmol)。在50℃下,攪拌該混合物1小時。濃縮該混合物,得到淺黃色油狀物的4-溴-2-氟-1-異氰酰基苯(750mg,3.47mmol,產率92%);es-lcmsm/z249.9(m+meoh+h)。
步驟2:1-(4-溴-2-氟苯基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲
向4-溴-2-氟-1-異氰酰基苯(751mg,3.48mmol)在thf(50ml)中的混合物中加入5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-胺(450mg,2.318mmol)和et3n(0.645ml,4.64mmol)。然后,在50℃下,攪拌該混合物4小時。濃縮該混合物。在硅膠柱色譜(pe/ea=5:1)上純化殘余物。將通過tlc(pe/ea=2:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的1-(4-溴-2-氟苯基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(220mg,0.536mmol,產率23.14%):1hnmr(400mhz,meod)δ:8.07(t,j=4.8hz,1h),7.38(dd,j=2.4,10.8hz,1h),7.32-7.29(m,1h),6.76(s,1h),1.58(s,6h);es-lcmsm/z412.0,410.0(m+h)。
步驟3:1-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲
在n2氣氛下,向3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(250mg,0.649mmol)、1-(4-溴-2-氟苯基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(220mg,0.536mmol)在水(1ml)和1,4-二噁烷(3ml)中的混合物中加入cs2co3(423mg,1.298mmol)和pdcl2(dppf)-dcm加合物(53.0mg,0.065mmol)。然后,攪拌該混合物,并在微波爐中,在130℃照射30分鐘。濃縮該混合物,并用ea萃取。將合并的有機物濃縮。通過制備tlc(pe/ea=2:1,rf=0.5)純化殘余物,得到黃白色固體的1-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(150mg,0.161mmol,產率24.74%):1hnmr(400mhz,meod)δ:8.22(t,j=4.8hz,1h),7.95(d,j=2.4hz,1h),7.48-7.37(m,5h),6.95-6.81(m,3h),5.38-5.35(m,2h),4.20-4.14(m,2h),3.81(s,3h),1.62-1.37(m,9h);es-lcmsm/z589.0(m+h)。
步驟4:1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲
在25℃下,攪拌1-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(150mg,0.255mmol)和tfa(在dcm中10%,100ml)的混合物2小時。濃縮該混合物,并通過制備hplc(mecn/h2o作為洗脫液,酸性條件)純化殘余物,得到黃白色固體的1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(84.37mg,0.177mmol,產率87%):1hnmr(400mhz,meod)δ:8.17(t,j=8.4hz,1h),7.40(dd,j=2.0,12.4hz,1h),7.36-7.33(m,1h),7.27(d,j=2.4hz,1h),7.22(d,j=2.0hz,1h),6.77(s,1h),4.12(q,j=7.2hz,2h),1.59(s,6h),1.46(t,j=7.2hz,3h);es-lcmsm/z469.1(m+h)。
實施例12:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲
步驟1:1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲
向2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(200mg,0.506mmol)在1,4-二噁烷(30ml)中的混合物中加入et3n(0.106ml,0.759mmol),并在25℃下攪拌15分鐘。然后,向該混合物中加入dppa(209mg,0.759mmol),并攪拌15分鐘。向該混合物中加入4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯胺(124mg,0.506mmol),并在80℃下攪拌3小時。濃縮該混合物,并通過制備tlc(dcm/meoh=15:1,rf=0.45)純化殘余物,得到淺黃色固體的1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲(80mg,0.107mmol,產率21.08%):1hnmr(400mhz,cd3od)δ9.16(s,1h),8.08(s,1h),7.90(s,1h),7.81-7.75(m,1h),7.64-7.62(m,1h),7.55(s,1h),7.26-7.20(m,2h),6.88-6.86(m,2h),5.99-5.96(m,2h),4.71-4.64(m,2h),4.33-4.25(m,2h),4.12-4.05(m,2h),3.76(s,3h),2.56(s,2h),2.50-2.30(m,3h),1.37-1.35(m,3h),1.18(s,3h);es-lcms(m/z):638.2(m+h)。
步驟2:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲
在25℃下,攪拌1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲(80mg,0.125mmol)和tfa(10%indcm,30ml)的混合物2小時。濃縮該混合物。通過制備制備hplc(儀器∶gilsongx281;柱:gemini150*25mm*5um;流動相a∶水(0.05%氨水溶液);流動相b∶mecn;梯度∶36-66(b%);流速:25ml/min;運行時間∶10min)純化殘余物,得到白色固體的1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲(4.58mg,8.85μmol,產率7.05%):1hnmr(400mhz,cd3od)δ9.15(s,1h),7.90(d,j=2.4hz,1h),7.77(s,1h),7.63(d,j=8.4hz,1h),7.23(d,j=8.4hz,1h),5.99(s,1h),4.68(d,j=6.0hz,2h),4.30(d,j=5.6hz,2h),4.11(q,j=6.8hz,2h),3.03(s,2h),2.55(s,3h),1.44-1.29(m,6h);es-lcmsm/z:518.1(m+h)。
實施例13:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲
步驟1:1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲
向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(180mg,0.455mmol)在1,4-二噁烷(30ml)中的混合物中加入et3n(0.095ml,0.683mmol),并在25℃下攪拌15分鐘。然后,向該混合物中加入dppa(188mg,0.683mmol),并攪拌15分鐘。向該混合物中加入4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯胺(112mg,0.455mmol),并在80℃下攪拌3小時。濃縮該混合物,并通過制備tlc(dcm/meoh=20:1,rf=0.5)純化殘余物,得到淺黃色固體的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲(100mg,0.133mmol,產率29.3%):1hnmr(400mhz,cd3od)δ9.10(s,1h),8.66(s,1h),8.07-8.06(m,1h),7.90(s,1h),7.61(d,j=8.4hz,1h),7.40(d,j=8.4hz,2h),7.22(d,j=8.4hz,1h),6.91(d,j=8.4hz,2h),5.38(s,2h),4.68(d,j=5.6hz,2h),4.30(d,j=5.6hz,2h),4.19-4.12(m,2h),3.81-3.74(m,3h),3.02(s,2h),2.59-2.52(m,3h),1.43(t,j=7.2hz,3h),1.35(s,3h);es-lcms(m/z):638.1(m+h)。
步驟2:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲
在25℃下,攪拌1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲(100mg,0.157mmol)和tfa(在dcm中10%,30ml)的混合物2小時。濃縮該混合物。通過制備hplc(儀器∶gilsongx281;柱∶gemini150*25mm*5um;流動相a∶水(0.05%氨水溶液);流動相b∶mecn;梯度∶40-70(b%);流速:25ml/min;運行時間∶10min)純化殘余物,得到白色固體的1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)甲基)-3-(三氟甲基)苯基)脲(49mg,0.092mmol,產率58.8%):1hnmr(400mhz,cd3od)δ9.03(s,1h),8.06(s,1h),7.90(s,1h),7.85(d,j=2.0hz,1h),7.63-7.61(m,1h),7.24-7.22(m,1h),4.69(d,j=6.0hz,2h),4.30(d,j=6.0hz,2h),4.14(q,j=6.8hz,2h),3.03(s,2h),2.55(s,3h),1.48(t,j=7.2hz,3h),1.35(s,6h);es-lcmsm/z:518.1(m+h)。
實施例14:1-(4-(2-氰基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酸
將2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酸乙酯(2g,6.26mmol)在meoh(30ml)中的混合物加入到lioh(0.450g,18.79mmol)在水(30ml)中的溶液中。然后,在60℃下,攪拌該混合物10小時。將該混合物用6.0mol/l的hcl酸化至ph=6.0,然后用dcm/meoh(10/1,50ml×3)萃取。將合并的有機層經na2so4干燥,并濃縮,得到白色固體的2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酸(1.5g,4.48mmol,產率71.5%):1hnmr(400mhz,cd3od)δ:8.48(d,j=2.4hz,1h),8.37(dd,j=2.4,8.8hz,1h),7.75(d,j=8.8hz,1h),3.24(s,2h),1.17(s,6h)。
步驟2:2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酰胺
向冷卻至0℃的2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酸(8.5g,29.2mmol)和dmf(0.2ml)在dcm(250ml)中的混合物中加入草酰二氯(3.07ml,35.0mmol),并在25℃下,攪拌該混合物1小時。濃縮該混合物,并向殘余物中加入dcm(250ml)。在25℃下,在nh3下,攪拌該混合物2小時。濃縮該混合物。將殘余物分配在ea(200ml)和h2o(200ml)之間。將有機層用鹽水洗滌,經na2so4干燥,過濾并濃縮,得到黃色油狀物的2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酰胺(5.5g,10.74mmol,產率36.8%):1hnmr(400mhz,cd3od)δ:8.49(d,j=2.0hz,1h),8.37(dd,j=2.4,8.8hz,1h),7.73(d,j=8.8hz,1h),3.22(s,2h),1.18(s,6h);es-lcms(m/z):291.0(m+h)。
步驟3:2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙腈(propanenitrile)
向2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙酰胺(5g,17.23mmol)和et3n(7.20ml,51.7mmol)在dcm(50ml)中的混合物中加入(3.65ml,25.8mmol)。在25℃下,攪拌該混合物10小時。用飽和的nahco3和鹽水(50ml×2)洗滌該混合物。經mgso4干燥有機層并濃縮。在硅膠柱色譜(pe/ea=10:1)上純化殘余物。將通過tlc(pe/ea=5:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙腈(4g,13.55mmol,產率79%):1hnmr(400mhz,cd3od)δ:8.56(d,j=2.4hz,1h),8.50(dd,j=2.0,8.4hz,1h),8.05(d,j=8.4hz,1h),3.21(s,2h),1.43(s,6h);es-lcms(m/z):290.0(m+h2o)。
步驟4:3-(4-氨基-2-(三氟甲基)苯基)-2,2-二甲基丙腈
向2,2-二甲基-3-(4-硝基-2-(三氟甲基)苯基)丙腈(4g,14.69mmol)在ea(100ml)中的混合物中加入sncl2·h2o(12.20g,58.8mmol),并回流2小時。在冷卻之后,將該混合用飽和的nahco3溶液中和至ph=7.5。用ea(100ml×4)萃取該混合物。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。在硅膠柱色譜(pe/ea=5:1)上純化殘余物。將通過tlc(pe/ea=2:1,rf=0.45)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的3-(4-氨基-2-(三氟甲基)苯基)-2,2-二甲基丙腈(3.5g,13.29mmol,產率90%):1hnmr(400mhz,cd3od)δ:7.40(d,j=8.4hz,1h),6.98(d,j=2.4hz,1h),6.86(dd,j=2.4,8.4hz,1h),2.90(s,2h),1.34(s,6h);es-lcmsm/z:243.1(m+h)。
步驟5:1-(4-(2-氰基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(200mg,0.503mmol)在1,4-二噁烷(30ml)中的混合物中加入et3n(0.105ml,0.755mmol),并在25℃下攪拌15分鐘。然后,向該混合物中加入dppa(208mg,0.755mmol),并攪拌15分鐘。向該混合物中加入3-(4-氨基-2-(三氟甲基)苯基)-2,2-二甲基丙腈(122mg,0.503mmol),并在80℃下攪拌3小時。濃縮該混合物,并通過制備tlc(dcm/meoh=20:1,rf=0.5)純化殘余物,得到淺黃色固體的1-(4-(2-氰基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲(80mg,0.113mmol,產率22.5%):1hnmr(400mhz,cd3od)δ:9.04(s,1h),8.08-8.04(m,1h),7.96(s,1h),7.85(s,1h),7.80-7.75(m,1h),7.67-7.65(m,1h),7.25(d,j=8.4hz,2h),6.91-6.84(m,2h),4.59(s,2h),4.16-4.11(m,2h),3.77(s,3h),3.03(s,2h),2.55(s,3h),1.50-1.45(m,3h),1.38(s,6h);es-lcms(m/z):515.1(m-pmb+h)。
步驟6:1-(4-(2-氰基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
在25℃下,攪拌1-(4-(2-氰基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(80mg,0.126mmol)和tfa(在dcm中10%,30ml)中的混合物2小時。濃縮該混合物。通過制備hplc(儀器∶gilsongx281;柱∶gemini150*25mm*5um;流動相a∶水(0.05%氨水溶液);流動相b∶mecn;梯度∶42-72(b%);流速:25ml/min;運行時間∶10min)純化殘余物,得到白色固體的1-(4-(2-氰基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲(22.67mg,0.043mmol,產率34.3%):1hnmr(400mhz,cd3od)δ:9.03(s,1h),8.06(s,1h),7.96(s,1h),7.86-7.85(m,1h),7.68-7.66(m,2h),4.14(q,j=7.2hz,2h),3.03(s,2h),2.55(s,3h),1.48(t,j=7.2hz,3h),1.38(s,6h);es-lcmsm/z:515.1(m+h)。
實施例15:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲
步驟1:2-氯-4-甲基嘧啶-5-胺
向在20℃下,在n2下攪拌的2,4-二氯-6-甲基-5-硝基嘧啶(10g,48.1mmol)和nh4cl(25.7g,481mmol)在meoh(100ml)中的溶液中一次性加入鋅(31.4g,481mmol)。在70℃下,攪拌反應混合物50小時。過濾該混合物,并在真空中濃縮濾液。通過硅膠柱色譜(dcm/meoh=30:1)純化殘余物。將通過tlc(ea/ea=1=1:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的2-氯-4-甲基嘧啶-5-胺(2g,13.93mmol,產率29.0%):1hnmr(400mhz,cdcl3)δ:7.95(s,1h),3.66(s,2h),2.88(s,3h);es-lcmsm/z:144.2(m+h)。
步驟2:2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-胺
向在20℃下,在n2下攪拌的3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(3.22g,8.36mmol)、2-氯-4-甲基嘧啶-5-胺(1g,6.97mmol)和cs2co3(5.67g,17.41mmol)在dmf(3ml)和水(1ml)中的溶液中一次性加入pdcl2(pph3)2(0.244g,0.348mmol)。在110℃下,加熱反應容器3小時。然后,將溶液濃縮,并分配在ea和水之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜tlc(pe/ea=1:1)純化殘余物。將通過tlc(pe/ea=1:1,rf=0.3)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-胺(1.6g,4.37mmol,產率62.7%):1hnmr(400mhz,cdcl3)δ:8.68(s,1h),8.11(s,1h),7.97(s,1h),7.46(d,j=8.4hz,2h),6.89(d,j=8.4hz,2h),5.48(s,2h),4.20(q,j=7.2hz,2h),3.80(s,3h),3.64(s,2h),2.45(s,3h),1.47(t,j=7.2hz,3h);es-lcmsm/z:367.1(m+h)。
步驟3:3-異氰酰基-5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑
在50℃下,攪拌5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-胺(300mg,1.545mmol)和三光氣(183mg,0.618mmol)在thf(30ml)中的混合物0.5小時。濃縮該混合物,得到黃色固體的3-異氰酰基-5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑(300mg,1.186mmol,產率77%):es-lcmsm/z:253.0(m+meoh)。
步驟4:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲
向3-異氰酰基-5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑(100mg,0.454mmol)在thf(50ml)中的混合物中加入2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-胺(100mg,0.273mmol)和et3n(0.126ml,0.908mmol)。然后,在50℃下,攪拌該混合物1小時。向該混合物中加入另外的3-異氰酰基-5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑(100mg,0.454mmol)在thf(15ml)中的溶液,并在50℃下,攪拌該混合物4小時。濃縮該混合物。通過制備tlc(dcm/meoh=10:1,rf=0.6)純化殘余物,得到黃色固體的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(60mg,0.102mmol)。在25℃下,攪拌1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(60mg,0.102mmol)在tfa(在dcm中10%,30ml)中的混合物1小時。濃縮該混合物,并通過制備hplc(mecn/h2o作為洗脫液,堿性條件)純化殘余物,得到白色固體的1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(5.97mg,0.013mmol,產率2.82%):1hnmr(400mhz,cd3od+cdcl3)δ:9.09(s,1h),8.05(d,j=2.0hz,1h),7.82(d,j=2.0hz,1h),6.70(s,1h),4.14(q,j=7.2hz,2h),2.55(s,3h),1.58(s,6h),1.48(t,j=6.8hz,3h);es-lcmsm/z467.1(m+h)。
實施例16:1-(5-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-3-甲基吡嗪-2-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲
步驟1:5-溴-2-異氰酰基-3-甲基吡嗪
向5-溴-3-甲基吡嗪-2-胺(450mg,2.393mmol)在thf(30ml)中的混合物中加入三光氣(284mg,0.957mmol)。在50℃下,攪拌該混合物1小時。濃縮該混合物,得到淺黃色油狀物的5-溴-2-異氰酰基-3-甲基吡嗪(500mg,0.963mmol,產率40.2%):es-lcmsm/z247.9(m+meoh+h)。
步驟2:1-(5-溴-3-甲基吡嗪-2-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲
向5-溴-2-異氰酰基-3-甲基吡嗪(507mg,2.369mmol)在thf(50ml)中的混合物中加入5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-胺(400mg,2.060mmol)和et3n(0.573ml,4.12mmol)。在50℃下,攪拌該混合物4小時。濃縮該混合物。在硅烷柱色譜(pe/ea=5:1)上純化殘余物。將通過tlc(pe/ea=2:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的1-(5-溴-3-甲基吡嗪-2-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(150mg,0.187mmol,產率9.10%):1hnmr(400mhz,cd3od)δ:7.79(s,1h),6.92(s,1h),2.58(s,3h),1.52(s,6h);es-lcmsm/z409.9(m+2)。
步驟3:1-(5-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-3-甲基吡嗪-2-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲
在n2氣氛下,向3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(80mg,0.208mmol)、1-(5-溴-3-甲基吡嗪-2-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(85mg,0.208mmol)在水(1ml)和1,4-二噁烷(3ml)中的混合物中加cs2co3(135mg,0.415mmol)和pdcl2(dppf)(15.19mg,0.021mmol)。然后,攪拌該混合物,并在微波爐中于120℃下照射30分鐘。濃縮該混合物,并用ea萃取。濃縮合并的有機物。通過制備tlc(pe/ea=2:1,rf=0.5)純化殘余物,得到黃色固體的1-(5-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-3-甲基吡嗪-2-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(20mg,0.014mmol,產率6.57%):1hnmr(400mhz,cd3od)δ:8.71(d,j=6.4hz,1h),8.38(s,1h),7.89(d,j=12.0hz,2h),7.44(d,j=8.4hz,2h),6.94(d,j=8.4hz,2h),5.42(d,j=3.6hz,2h),4.62(s,2h),4.23-4.17(m,2h),3.82(s,3h),1.72-1.51(m,6h),1.47(t,j=6.8hz,3h);es-lcmsm/z587.1(m+h)。
步驟4:1-(5-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-3-甲基吡嗪-2-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲
在25℃下,攪拌1-(5-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-3-甲基吡嗪-2-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(20mg,0.034mmol)和hcl(在二噁烷中4mol/l,20ml)的混合物2小時。濃縮該混合物。通過制備hplc(mecn/h2o作為洗脫液,酸性條件)純化殘余物,得到白色固體的1-(5-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-3-甲基吡嗪-2-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲鹽酸鹽(1.2mg,2.386μmol,產率7.00%):1hnmr(400mhz,dmso-d6)δ:11.92(s,1h),11.13(s,1h),9.28(s,1h),8.73(s,1h),7.72(s,1h),7.43(d,j=2.0hz,1h),6.89(s,1h),4.02(q,j=7.1hz,2h),2.51(s,3h),1.53(s,6h),1.33(t,j=6.9hz,3h);es-lcmsm/z467.2(m+h)。
實施例17:1-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-(哌嗪-1-基甲基)-3-(三氟甲基)苯基)脲
步驟1:(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)氨基甲酸叔丁酯
在n2氣氛下,向5-溴吡啶-2-醇(600mg,3.45mmol)、(4-((叔-丁氧基羰基)氨基)苯基)硼酸(817mg,3.45mmol)在水(3ml)和1,4-二噁烷(9ml)中的混合物中加入cs2co3(2247mg,6.90mmol)、pdcl2(dppf)(126mg,0.172mmol)。然后,攪拌該混合物,并在微波爐中于100℃下照射1小時。濃縮該混合物,用ea萃取。濃縮有機相。通過制備tlc(dcm/meoh=10∶1)純化殘余物,得到(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)氨基甲酸叔丁酯(100mg,0.349mmol,產率10.13%):1hnmr(400mhz,cdcl3)δ:7.67(dd,j=2.4,9.6hz,1h),7.43-7.40(m,1h),7.35(d,j=8.8hz,2h),7.26(d,j=8.4hz,2h),6.60(d,j=9.6hz,1h),1.40(s,9h);es-lcmsm/z287.2(m+h)。
步驟2:5-(4-氨基苯基)吡啶-2(1h)-酮
向(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)氨基甲酸叔丁酯(100mg,0.349mmol)在dcm(10ml)中的溶液中加入tfa(39.8mg,0.349mmol),然后在25℃下攪拌2小時。濃縮該混合物,得到5-(4-氨基苯基)吡啶-2(1h)-酮(60mg,0.322mmol,產率92%:es-lcmsm/z187.1(m+h)。
步驟3:4-異氰酰基-2-(三氟甲基)苯甲醛
向4-氨基-2-(三氟甲基)苯甲醛(90mg,0.476mmol)在thf(30ml)中的混合物中加入雙三氯甲基酯(56.5mg,0.190mmol)。然后,在50℃下,攪拌該混合物0.5小時。濃縮該混合物,得到4-異氰酰基-2-(三氟甲基)苯甲醛(100mg,0.465mmol,產率98%)。
步驟4:1-(4-甲酰基-3-(三氟甲基)苯基)-3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲
向5-(4-氨基苯基)吡啶-2(1h)-酮(60mg,0.322mmol)在thf(15ml)中的混合物中加入4-異氰酰基-2-(三氟甲基)苯甲醛(90mg,0.419mmol)、et3n(65.2mg,0.644mmol)。然后,在50℃下攪拌該混合物4小時。濃縮該混合物,并通過制備tlc(dcm:meoh=10∶1)純化殘余物,得到1-(4-甲酰基-3-(三氟甲基)苯基)-3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲(20mg,0.050mmol,產率15.47%):1hnmr(400mhz,cd3od)δ10.20(t,j=2.0hz,1h),8.17(d,j=2.0hz,1h),8.10(d,j=8.4hz,1h),7.95(dd,j=2.8,9.6hz,1h),7.81(dd,j=2.4,8.8hz,1h),7.70(d,j=2.8hz,1h),7.58(dd,j=2.0,6.8hz,2h),7.53(dd,j=2.0,8.4hz,2h),6.63(d,j=7.2hz,1h);es-lcmsm/z402.1(m+h)。
步驟5:4-(4-(3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲基)-2-(三氟甲基)芐基)哌嗪-1-羧酸叔丁酯
在25℃下,攪拌1-(4-甲酰基-3-(三氟甲基)苯基)-3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲(35mg,0.087mmol)、哌嗪-1-羧酸叔丁酯(0.031ml,0.174mmol)、哌嗪-1-羧酸叔丁酯(0.031ml,0.174mmol)在dcm(10ml)中的混合物2小時。然后,向該混合物中分批加入nabh(oac)3(18.48mg,0.087mmol),接著,在25℃下,攪拌12小時。濃縮該混合物,并通過制備tlc純化殘余物,得到4-(4-(3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲基)-2-(三氟甲基)芐基)哌嗪-1-羧酸叔丁酯(20mg,0.035mmol,產率40.1%):es-lcmsm/z572.2(m+h)。
步驟6:1-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-(哌嗪-1-基甲基)-3-(三氟甲基)苯基)脲
在25℃下,攪拌4-(4-(3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲基)-2-(三氟甲基)芐基)哌嗪-1-羧酸叔丁酯(20mg,0.035mmol)和hcl/meoh(4mol/l,10ml,40.0mmol)的混合物2小時。濃縮該混合物,通過制備hplc純化,得到1-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-(哌嗪-1-基甲基)-3-(三氟甲基)苯基)脲二鹽酸鹽(2.48mg,4.56μmol,產率13.02%):1hnmr(400mhz,cd3od)δ:8.27(d,j=8.0hz,1h),8.11(s,1h),8.03(s,1h),7.92(d,j=8.0hz,1h),7.79(d,j=8.4hz,1h),7.60-7.59(m,4h),6.96(d,j=9.2hz,1h),4.35(s,2h),3.56(s,4h),3.39(s,4h);es-lcmsm/z472.2(m+h)。
實施例18::1-(4-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:1-(4-(6-(芐氧基)-4-乙氧基吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向2-(芐氧基)-4-乙氧基-5-碘吡啶(150mg,0.422mmol)在1,4-二噁烷(3ml)和水(1ml)中的混合物中加入1-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(237mg,0.465mmol)、cs2co3(275mg,0.845mmol)和pdcl2(dppf)(30.9mg,0.042mmol)。在微波下,在110℃下于n2氣氛下攪拌該混合物30分鐘。然后,過濾反應殘余物,濃縮濾液,并通過tlc(pe/ea=1:1,rf=0.6)純化,得到黃色固體的1-(4-(6-(芐氧基)-4-乙氧基吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(100mg,0.147mmol,產率34.8%):1hnmr(400mhz,cd3od)δ8.08(t,j=8.4hz,1h),7.94(s,1h),7.78(d,j=2.4hz,1h),7.55(d,j=8.4hz,1h),7.45-7.43(m,2h),7.37-7.35(m,1h),7.32-7.29(m,3h),7.26-7.23(m,1h),6.62(d,j=8.4hz,1h),6.47(s,1h),5.35(s,2h),4.89(d,j=6.4hz,2h),4.62(d,j=7.2hz,2h),4.16-4.10(m,2h),1.72(s,3h),1.38(t,j=6.8hz,3h);es-lcmsm/z612.2(m+h)。
步驟2:1-(4-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向1-(4-(6-(芐氧基)-4-乙氧基吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(100mg,0.164mmol)在meoh(10ml)中的混合物中加入pd/c(20mg,10%)。在h2氣氛下,在25℃下,攪拌該混合物16小時。將反應殘余物過濾并濃縮。通過制備hplc(mecn/h2o作為洗脫液,酸性條件)純化殘余物,得到白色固體的1-(4-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(40.13mg,0.077mmol,產率47.1%):1hnmr(400mhz,cd3od)δ8.11(t,j=8.8hz,1h),7.80(d,j=2.8hz,1h),7.57(dd,j=2.8hz,8.4hz,1h),7.38(s,1h),7.30(dd,j=2.4,8.4hz,1h),7.21(d,j=8.8hz,1h),6.65(d,j=8.8hz,1h),6.01(s,1h),4.92(d,j=6.8hz,2h),4.65(d,j=6.8hz,2h),4.16-4.11(m,2h),1.75(s,3h),1.41(t,j=7.2hz,2h);es-lcmsm/z522.2(m+h)。
實施例19:1-(2-氟-4-(4-氧代-4,5-二氫呋喃并[3,2-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:(e)-3-(呋喃-2-基)丙烯酸
在室溫下,向呋喃-2-甲醛(30g,312mmol)和丙二酸(35.7g,343mmol)在吡啶(300ml)中的混合物中加入哌啶(3.09ml,31.2mmol),并在100℃下,攪拌該混合物16小時。將反應溶液傾倒入水(200ml)中,并用6m鹽酸酸化。通過過濾收集得到的沉淀物,得到(e)-3-(呋喃-2-基)丙烯酸(32g,227mmol,產率72.7%):1hnmr(400mhz,cd3od)δ7.61(d,j=1.6hz,1h),7.42(d,j=15.6hz,1h),6.73(d,j=3.2hz,1h),6.53(dd,j=2.0,3.6hz,1h),6.22(d,j=15.6hz,1h);es-lcmsm/z139.1(m+h)。
步驟2:(e)-3-(呋喃-2-基)丙烯酰基疊氮化物
在冰冷卻下,向(e)-3-(呋喃-2-基)丙烯酸(25g,181mmol)和et3n(30.3ml,217mmol)在thf(50ml)中的混合物中加入dppa(54.8g,199mmol)。在25℃下,攪拌該混合物4小時。將反應溶液傾倒入ea(300ml)和飽和的nahco3水溶液(300ml)的混合物中,并用ea(200ml)萃取該混合物。經無水na2so4干燥萃取物,并在減壓下蒸發溶劑。用meoh洗滌殘余物,得到(e)-3-(呋喃-2-基)丙烯酰基疊氮化物(24g,144mmol,產率80%):1hnmr(400mhz,cdcl3)δ7.53-7.50(m,1h),7.47(s,1h),6.71(d,j=3.2hz,1h),6.50(dd,j=2.0,3.6hz,1h),6.30(d,j=3.6hz,1h)。
步驟3:呋喃并[3,2-c]吡啶-4(5h)-酮
在100℃下,攪拌(e)-3-(呋喃-2-基)丙烯酰基疊氮化物(10g,61.3mmol)在甲苯(100ml)中的混合物30分鐘。蒸發溶劑。將殘余物溶于1,2-二氯苯(90g,613mmol)和碘(0.062g,0.245mmol)中。在180℃下,攪拌該混合物2小時。蒸發溶劑。將殘余物溶于meoh(200ml)中。過濾出沉淀物,濃縮濾液,并用tbme(50ml)洗滌,得到呋喃并[3,2-c]吡啶-4(5h)-酮(5g,31.5mmol,產率51.3%):1hnmr(400mhz,cd3od)δ7.71(d,j=2.0hz,1h),7.32(d,j=7.2hz,1h),6.95(dd,j=1.2,2.4hz,1h),6.75(dd,j=0.8,7.2hz,1h);es-lcmsm/z136.1(m+h)。
步驟4:7-溴呋喃并[3,2-c]吡啶-4(5h)-酮
在0℃下,經10分鐘,向呋喃并[3,2-c]吡啶-4(5h)-酮(5g,37.0mmol)在mecn(50ml)中的混合物中加入nbs(8.56g,48.1mmol)在mecn中的溶液。在0℃下,攪拌得到的懸浮液1小時,并升溫至室溫10分鐘。向該混合物中加入水(250ml)和飽和的nahco3水溶液(10ml)。過濾收集黃白色固體,并干燥,得到7-溴呋喃并[3,2-c]吡啶-4(5h)-酮(1.5g,5.96mmol,產率16.10%):1hnmr(400mhz,cd3od)δ7.82(d,j=2.0hz,1h),7.51(s,1h),7.05(d,j=2.4hz,1h);es-lcmsm/z214.0,215.9(m+h)。
步驟5:1-(2-氟-4-(4-氧代-4,5-二氫呋喃并[3,2-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向7-溴呋喃并[3,2-c]吡啶-4(5h)-酮(250mg,1.168mmol)在1,4-二噁烷(12ml)和水(4ml)中的混合物中加入1-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(656mg,1.285mmol)、pdcl2(dppf)(85mg,0.117mmol)和cs2co3(761mg,2.336mmol)。在微波下,在n2氣氛下,于110℃攪拌該混合物30分鐘。通過制備hplc(mecn/h2o作為洗脫液,酸性條件)純化殘余物,得到白色固體的1-(2-氟-4-(4-氧代-4,5-二氫呋喃并[3,2-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(48.18mg,0.089mmol,產率7.63%):1hnmr(400mhz,cd3od)δ8.20(t,j=8.4hz,1h),7.85(d,j=2.0hz,1h),7.80(d,j=2.4hz,1h),7.61-7.51(m,4h),7.07(d,j=2.0hz,1h),6.62(d,j=8.8hz,1h),4.89(d,j=6.8hz,2h),4.63(d,j=7.2hz,2h),1.72(s,3h);es-lcmsm/z518.0(m+h)。
實施例20:1-(4-(5-環丙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:3-溴-5-環丙氧基吡啶
向5-溴吡啶-3-醇(5g,28.7mmol)在dmf(50ml)中的混合物中加入溴環丙烷(3.82g,31.6mmol)、nai(0.431g,2.87mmol)和k2co3(7.94g,57.5mmol)。在150℃下,攪拌該混合物32小時。將反應物過濾,濃縮,并通過硅膠柱色譜(pe/ea=5:1)純化。將通過tlc(pe/ea=5:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到黃色油狀物的3-溴-5-環丙氧基吡啶(1.5g,5.61mmol,產率19.51%):1hnmr(400mhz,cdcl3)δ8.31-8.28(m,2h),7.52(t,j=2.4hz,1h),3.78-3.75(m,1h),0.84-0.78(m,4h);es-lcmsm/z214.0,216.0(m+h)。
步驟2:3-溴-5-環丙氧基吡啶1-氧化物
向3-溴-5-環丙氧基吡啶(1.5g,7.01mmol)在dcm(50ml)中的混合物中加入m-cpba(1.814g,10.51mmol)。在25℃下,攪拌該混合物16小時。將該混合物分配在dcm(50ml)和飽和的na2so3溶液(50ml×3)之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。得到3-溴-5環丙氧氣基吡啶1-氧化物(1.2g,3.91mmol,產率55.8%):1hnmr(400mhz,cdcl3)δ8.08-8.07(m,1h),8.04-8.03(m,1h),7.16-7.15(m,1h),3.82-3.79(m,1h),0.87-0.81(m,4h);es-lcmsm/z229.9,231.9(m+h)。
步驟3:5-溴-2-氯-3-環丙氧基吡啶
向3-溴-5-環丙氧基吡啶1-氧化物(1.2g,5.22mmol)在dcm(20ml)中的混合物中加入pocl3(9.72ml,104mmol)。在45℃下,攪拌該混合物16小時。將反應物分配在dcm(100ml)和飽和的nahco3溶液(150ml)之間。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=5:1)純化殘余物。將通過tlc(pe/ea=5:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到黃色油狀物的5-溴-2-氯-3-環丙氧基吡啶(1g,3.42mmol,產率65.6%):1hnmr(400mhz,cdcl3)δ8.08(d,j=2.0hz,1h),7.69(d,j=2.0hz,1h),3.84-3.79(m,1h),0.91-0.89(m,4h);es-lcmsm/z247.9,249.9(m+h)。
步驟4:5-溴-3-環丙氧基-2-((4-甲氧基芐基)氧基)吡啶
向5-溴-2-氯-3-環丙氧基吡啶(1g,4.02mmol)在dmf(10ml)中的混合物中加入(4-甲氧基苯基)甲醇(0.612g,4.43mmol)和nah(0.241g,6.04mmol)。在120℃下,攪拌該混合物16小時。蒸發該混合物,并分配在dcm(50ml×2)和水(50ml)之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=5:1)純化殘余物。將通過tlc(pe/ea=5:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到黃色固體的5-溴-3-環丙氧基-2-((4-甲氧基芐基)氧基)吡啶(1.2g,2.399mmol,產率59.6%):1hnmr(400mhz,cdcl3)δ7.77(d,j=2.0hz,1h),7.48(d,j=2.4hz,1h),7.39-7.37(m,2h),6.86(dd,j=2.4,6.8hz,2h),5.34(s,2h),3.79(s,2h),3.72-3.68(m,1h),0.84-0.79(m,4h);es-lcmsm/z350.0,352.0(m+h)。
步驟5:1-(4-(5-環丙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向5-溴-3-環丙氧基-2-((4-甲氧基芐基)氧基)吡啶(180mg,0.514mmol)在1,4-二噁烷(12ml)和水(4ml)中的混合物中加入1-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(289mg,0.565mmol)、cs2co3(335mg,1.028mmol)和pdcl2(dppf)(37.6mg,0.051mmol)。在110℃下,在n2氣氛下,攪拌該混合物16小時。過濾反應物,并蒸發濾液。通過制備tlc(pe/ea=3:1,rf=0.6)純化殘余物,得到黃色油狀物的1-(4-(5-環丙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(180mg,0.275mmol,產率53.6%):1hnmr(400mhz,cdcl3)δ8.14(t,j=8.0hz,1h),7.90(d,j=2.0hz,1h),7.53(dd,j=2.0,4.0hz,3h),7.40(d,j=8.8hz,2h),7.14(s,1h),7.07(d,j=2.8hz,1h),6.86(dd,j=2.0,6.4hz,2h),6.40-6.37(m,1h),5.41(s,2h),4.94(d,j=6.4hz,2h),4.56(d,j=7.2hz,2h),3.78(s,3h),2.17(s,1h),1.71(s,3h),0.85-0.80(m,4h);es-lcmsm/z534.0(m-pmb+h)。
步驟6:1-(4-(5-環丙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向1-(4-(5-環丙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(180mg,0.275mmol)在meoh(10ml)中的混合物加入pd/c(18mg,10%)。在25℃下,在h2氣氛下攪拌該混合物16小時。蒸發反應物,并通過制備hplc(mecn/h2o作為洗脫液,酸性條件)純化,得到白色固體的1-(4-(5-環丙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(46.27mg,0.085mmol,產率30.9%):1hnmr(400mhz,cd3od)δ8.14(t,j=8.8hz,1h),7.79(d,j=2.8hz,1h),7.54(dd,j=2.4hz,9.2hz,2h),7.39-7.32(m,2h),7.28(d,j=2.4hz,1h),6.62(d,j=9.2hz,1h),4.90(d,j=6.4hz,2h),4.62(d,j=7.6hz,2h),3.94-3.89(m,1h),1.72(s,3h),0.89-0.77(m,4h);es-lcmsm/z534.2(m+h)。
實施例21:1-(4-(5-甲氧基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:3-溴-5-甲氧基吡啶1-氧化物
向3-溴-5-甲氧基吡啶(3.6g,19.15mmol)在dcm(50ml)中的混合物中加入m-cpba(3.96g,22.98mmol)。在25℃下,攪拌該混合物16小時。將反應殘余物分配在dcm(100ml)和飽和的na2so3溶液(100ml×2)之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。得到3-溴-5-甲氧基吡啶1-氧化物(4g,14.70mmol,產率77%):1hnmr(400mhz,cdcl3)δ8.02-8.01(m1h),7.92-7.91(m1h),7.03(t,j=1.6hz,1h),3.93(s,3h);es-lcmsm/z204.1,206.1(m+h)。
步驟2:5-溴-2-氯-3-甲氧基吡啶
向3-溴-5-甲氧基吡啶1-氧化物(2g,9.80mmol)在dcm(40ml)中的混合物中加入pocl3(18.27ml,196mmol)。在40℃下,攪拌該混合物16小時。蒸發該混合物,并分配在ea(100ml×2)和飽和的nahco3溶液(200ml)之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=10:1)純化殘余物。將通過tlc(pe/ea=10:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的5-溴-2-氯-3-甲氧基吡啶(1g,4.27mmol,產率43.6%):1hnmr(400mhz,cdcl3)δ8.05(d,j=2.0hz,1h),7.33(d,j=2.0hz,1h),3.93(s,3h);es-lcmsm/z222.0,224.0(m+h)。
步驟3:2-(芐氧基)-5-溴-3-甲氧基吡啶
向5-溴-2-氯-3-甲氧基吡啶(1g,4.50mmol)在苯基甲醇(4.86g,45.0mmol)中的混合物中加入鈉(0.310g,13.49mmol)。在100℃下,攪拌該混合物16小時。將該混合物分配在dcm(100ml×2)和水(80ml)之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=10:1)上純化殘余物。將通過tlc(pe/ea=10:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的2-(芐氧基)-5-溴-3-甲氧基吡啶(1.5g,4.33mmol,產率96%):1hnmr(400mhz,cdcl3)δ7.81(d,j=2.0hz,1h),7.50-7.48(m,2h),7.31-7.29(m,3h),7.15(d,j=2.0hz,1h),5.46(s,2h),3.81(s,3h);es-lcmsm/z294.0,296.0(m+h)。
步驟4:4-(6-(芐氧基)-5-甲氧基吡啶-3-基)苯胺
向2-(芐氧基)-5-溴-3-甲氧基吡啶(1g,3.40mmol)在1,4-二噁烷(30ml)和水(10.0ml)中的混合物中加入(4-氨基苯基)硼酸鹽酸鹽(0.394ml,3.74mmol)、cs2co3(4.43g,13.60mmol)和pdcl2(dppf)(0.249g,0.340mmol)。在110℃下,在n2氣氛下攪拌該混合物16小時。過濾殘余物,蒸發濾液,并通過硅膠柱色譜(pe/ea=5:1)純化。將通過tlc(pe/ea=5:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到4-(6-(芐氧基)-5-甲氧基吡啶-3-基)苯胺(800mg,2.481mmol,產率73.0%):1hnmr(400mhz,cdcl3)δ7.88(d,j=2.0hz,1h),7.51(d,j=7.2hz,2h),7.38-7.30(m,5h),7.22(d,j=2.0hz,1h),6.78-6.73(m,2h),5.51(s,2h),3.92(s,3h),3.74(s,2h);es-lcmsm/z307.0(m+h)。
步驟5:5-(4-氨基苯基)-3-甲氧基吡啶-2(1h)-酮
在80℃下,攪拌4-(6-(芐氧基)-5-甲氧基吡啶-3-基)苯胺(800mg,2.61mmol)在鹽酸(1587μl,52.2mmol)中的混合物16小時。濃縮反應殘余物,得到5-(4-氨基苯基)-3-甲氧基吡啶-2(1h)-酮(500mg,2.312mmol,產率89%):1hnmr(400mhz,cd3od)δ7.67-7.62(m,4h),7.32(d,j=8.4hz,2h),3.84(s,3h);es-lcmsm/z217.2(m+h)。
步驟6:1-(4-(5-甲氧基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向3-(4-異氰酰基-2-(三氟甲基)苯氧基-3-甲基氧雜環丁烷(250mg,0.915mmol)在thf(10ml)中的混合物中加入5-(4-氨基苯基)-3-甲氧基吡啶-2(1h)-酮(218mg,1.007mmol)和et3n(0.255ml,1.830mmol)。在60℃下,攪拌該混合物1小時。然后,濃縮反應殘余物,并通過制備hplc(mecn/h2o作為洗脫液,酸性條件)純化,得到粉紅色固體的1-(4-(5-甲氧基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(131.55mg,0.269mmol,產率29.4%):1hnmr(400mhz,cd3od)δ7.80(d,j=2.8hz,1h),7.58-7.57(m,1h),7.56-7.53(m,4h),7.35(d,j=2.0hz,1h),7.31(d,j=2hz,1h),6.65(d,j=9.2hz,1h),4.93(d,j=6.8hz,2h),4.66(d,j=7.2hz,2h),3.95(s,3h),1.75(s,3h);es-lcmsm/z490.1(m+h)。
實施例22:1-(2-氟-4-(4-氧代-2,3,4,5-四氫呋喃[3,2-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:(e)-3-(呋喃-2-基)丙烯酸
在室溫下,向呋喃-2-甲醛(30g,312mmol)和丙二酸(35.7g,343mmol)在吡啶(300ml)中的混合物中加入哌啶(3.09ml,31.2mmol),并在100℃下,攪拌該混合物16小時。將反應溶液傾倒入水(200ml)中,并用6m鹽酸酸化。通過過濾收集得到的沉淀物,得到(e)-3-(呋喃-2-基)丙烯酸(32g,227mmol,產率72.7%):1hnmr(400mhz,cd3od)δ7.61(d,j=1.6hz,1h),7.42(d,j=15.6hz,1h),6.73(d,j=3.2hz,1h),6.53(dd,j=2.0,3.6hz,1h),6.22(d,j=15.6hz,1h);es-lcmsm/z139.1(m+h)。
步驟2:(e)-3-(呋喃-2-基)丙烯酰基疊氮化物
在冰冷卻下,向(e)-3-(呋喃-2-基)丙烯酸(25g,181mmol)和et3n(30.3ml,217mmol)在thf(50ml)中的混合物中加入dppa(54.8g,199mmol)。在25℃下,攪拌該混合物4小時。將反應溶液傾倒入ea(300ml)和飽和的nahco3水溶液(300ml)的混合物中,并用ea(200ml)萃取該混合物。經無水na2so4干燥萃取物,并在減壓下蒸發溶劑。用meoh洗滌殘余物,得到(e)-3-(呋喃-2-基)丙烯酰基疊氮化物(24g,144mmol,產率80%):1hnmr(400mhz,cdcl3)δ7.53-7.50(m,1h),7.47(s,1h),6.71(d,j=3.2hz,1h),6.50(dd,j=2.0,3.6hz,1h),6.30(d,j=3.6hz,1h)。
步驟3:呋喃并[3,2-c]吡啶-4(5h)-酮
在100℃下,攪拌(e)-3-(呋喃-2-基)丙烯酰基疊氮化物(10g,61.3mmol)在甲苯(100ml)中的混合物30分鐘。蒸發溶劑。將殘余物溶于1,2-二氯苯(90g,613mmol)和碘(0.062g,0.245mmol)中。在180℃下,攪拌該混合物2小時。蒸發溶劑。將殘余物溶于meoh(200ml)中。過濾出沉淀物,濃縮濾液,并用tbme(50ml)洗滌,得到呋喃并[3,2-c]吡啶-4(5h)-酮(5g,31.5mmol,產率51.3%):1hnmr(400mhz,cd3od)δ7.71(d,j=2.0hz,1h),7.32(d,j=7.2hz,1h),6.95(dd,j=1.2,2.4hz,1h),6.75(dd,j=0.8,7.2hz,1h);es-lcmsm/z136.1(m+h)。
步驟4:7-溴呋喃并[3,2-c]吡啶-4(5h)-酮
在0℃下,經10分鐘,向呋喃并[3,2-c]吡啶-4(5h)-酮(5g,37.0mmol)在mecn(50ml)中的混合物中加入nbs(8.56g,48.1mmol)在mecn中的溶液。在0℃下,攪拌得到的懸浮液1小時,并升溫至室溫10分鐘。向該混合物中加入水(250ml)和飽和的nahco3水溶液(10ml)。過濾收集黃白色固體,并干燥,得到7-溴呋喃并[3,2-c]吡啶-4(5h)-酮(1.5g,5.96mmol,產率16.10%):1hnmr(400mhz,cd3od)δ7.82(d,j=2.0hz,1h),7.51(s,1h),7.05(d,j=2.4hz,1h);es-lcmsm/z214.0,215.9(m+h)。
步驟5:1-(2-氟-4-(4-氧代-4,5-二氫呋喃并[3,2-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向7-溴呋喃并[3,2-c]吡啶-1(5h)-酮(250mg,1.168mmol)在1,4-二噁烷(3ml)和水(1ml)中的混合物中加入1-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(656mg,1.285mmol)、pdcl2(dppf)(85mg,0.117mmol)和cs2co3(761mg,2.336mmol)。在微波下,在n2氣氛下于110℃攪拌該混合物30分鐘。過濾該混合物,并濃縮濾液。通過制備tlc(dcm/meoh=15:1,rf=0.6)純化殘余物,得到黃色固體的1-(2-氟-4-(4-氧代-4,5-二氫呋喃并[3,2-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(45mg,0.082mmol,產率7.00%):1hnmr(400mhz,cd3od)δ8.20(t,j=8.8hz,1h),7.84(d,j=2.0hz,1h),7.80(d,j=2.8hz,1h),7.61-7.51(m,4h),7.06(d,j=2.4hz,1h),6.62(d,j=9.2hz,1h),4.89(d,j=6.8hz,2h),4.63(d,j=7.2hz,2h),1.72(s,3h);es-lcmsm/z518.0(m+h)。
步驟6:1-(2-氟-4-(4-氧代-2,3,4,5-四氫呋喃[3,2-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向1-(2-氟-4-(4-氧代-4,5-二氫呋喃并[3,2-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(30mg,0.058mmol)在meoh(10ml)中的混合物中加入pd/c(3mg,0.028mmol)。在25℃下,在h2氣氛下攪拌該混合物48小時。將反應殘余物過濾并濃縮。通過制備hplc(mecn/h2o作為洗脫液,堿性條件)純化殘余物,得到白色固體的1-(2-氟-4-(4-氧代-2,3,4,5-四氫呋喃[3,2-c]吡啶-7-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(17.18mg,0.032mmol,產率55.6%):1hnmr(400mhz,cd3od)δ8.14(t,j=8.4hz,1h),7.81(d,j=2.4hz,1h),7.57-7.56(m,2h),7.45(d,j=12.8hz,1h),7.36(d,j=7.6hz,1h),6.65(d,j=9.2hz,1h),4.92(d,j=6.4hz,2h),4.65(d,j=7.2hz,2h),4.60(s,2h),3.15(t,j=9.2hz,2h),1.75(s,3h);es-lcmsm/z520.0(m+h)。
實施例23:1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:2-甲基-2-(2-(三氟甲基)苯基)丙腈
向2-(2-(三氟甲基)苯基)乙腈(5g,27.0mmol)在dmf(50ml)中的混合物中加入nah(1.620g,67.5mmol)和mei(4.22ml,67.5mmol)。在25℃下,攪拌該混合物16小時。用水(100ml)洗滌該混合物,并用dcm(120ml×2)萃取。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=10:1)純化殘余物。將通過tlc(pe/ea=10:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的2-甲基-2-(2-(三氟甲基)苯基)丙腈(4.8g,19.14mmol,產率70.9%):1hnmr(400mhz,cd3od)δ7.83(dd,j=8.4,14.4hz,1h),7.70(t,j=8.0hz,1h),7.62-7.54(m,1h),1.89(s,6h);es-lcmsm/z214.1(m+h)。
步驟2:2-甲基-2-(4-硝基-2-(三氟甲基)苯基)丙腈
向2-甲基-2-(2-(三氟甲基)苯基)丙腈(4.8g,22.51mmol)在h2so4(22.08g,225mmol)中的混合物中加入硝基過酸鉀(2.73g,27.0mol)。在0℃下,攪拌該混合物15分鐘。用ea(50ml×2)萃取該混合物,并用水(50ml)洗滌,得到有機層。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,濃縮,得到淺黃色油狀物的2-甲基-2-(4-硝基-2-(三氟甲基)苯基)丙腈(5g,17.04mmol,產率76%):1hnmr(400mhz,cd3od)δ8.66(d,j=2.4hz,1h)8.53(dd,j=2.4,9.2hz,1h)8.11(d,j=9.2hz,1h)1.95(s,6h);es-lcmsm/z259.0(m+h)。
步驟3:2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙腈
向2-甲基-2-(4-硝基-2-(三氟甲基)苯基)丙腈(8g,31.0mmol)在meoh(100ml)中的混合物中加入pd/c(800mg,10%)。在25℃下,攪拌該混合物15小時。過濾該混合物并濃縮。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=3:1)純化殘余物。將通過tlc(pe/ea=3:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到紅色油狀物的2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙腈(6.7g,24.95mmol,產率81%):1hnmr(400mhz,cd3od)δ7.39(d,j=8.8hz,1h),7.05(d,j=2.4hz,1h),6.84(dd,j=2.4,8.8hz,1h),1.77(s,6h);es-lcmsm/z229.1(m+h)。
步驟4:1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(100mg,0.253mmol)在1,4-二噁烷(10ml)中的混合物中加入et3n(0.053ml,0.379mmol)和dppa(84mg,0.303mmol)。在25℃下攪拌該混合物15分鐘。然后,向該混合物中加入2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙腈(69.3mg,0.303mmol)。在80℃下,攪拌該混合物2小時。濃縮該混合物,并通過制備tlc(dcm/meoh=20:1,rf=0.6)純化,得到黃色固體的1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(100mg,0.137mmol,產率54.2%):1hnmr(400mhz,cd3od)δ9.09(s,1h),8.66(d,j=2.0hz,1h),8.07(d,j=1.6hz,1h),8.01(d,j=2.0hz,1h),7.77-7.65(m,3h),7.40(d,j=8.8hz,2h),6.90(d,j=8.8hz,2h),5.37(s,2h),4.19-4.14(m,2h),3.78(s,3h),2.57(s,3h),1.84(s,6h),1.43(t,j=7.2hz,3h);es-lcmsm/z621.1(m+h)。
步驟5:1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
向1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(100mg,0.161mmol)在dcm(10ml)中的混合物中加入tfa(1ml,12.98mmol)。在25℃下,攪拌該混合物2小時。向該混合物中加入nh4oh(5ml),然后濃縮反應殘余物。通過制備hplc(酸性條件;儀器∶dc;柱:gemini:c18150*25mm*10ul;流動相a∶水+0.1%hcl;流動相b∶mecn;流速:25ml/min;運行時間∶15min;梯度分布描述:25-55(b%))純化殘余物,得到黃色固體的1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲鹽酸鹽(19.12mg,0.036mmol,產率22.10%):1hnmr(400mhz,cd3od)δ9.08(s,1h),8.10(d,j=2.0hz,1h),8.02(d,j=2.4hz,1h),7.87(d,j=2.0hz,1h),7.76-7.68(m,2h),4.15(q,j=7.2hz,2h),2.57(s,3h),1.84(s,6h),1.48(t,j=7.2hz,3h);es-lcmsm/z501.1(m+h)。
實施例24:1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:2-甲基-2-(2-(三氟甲基)苯基)丙腈
向2-(2-(三氟甲基)苯基)乙腈(10g,54.0mmol)在dmf(100ml)中的混合物中加入mei(3.38ml,54.0mmol)和nah(2.59g,64.8mmol)。在25℃下,攪拌該混合物16小時。將該混合物濃縮,用水洗滌,并用dcm萃取。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=5:1)純化殘余物。將通過tlc(pe/ea=5:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的2-(2-(三氟甲基)苯基)丙腈(8g,34.1mmol,產率63.2%):1hnmr(400mhz,cd3od)δ7.87-7.81(m,1h),7.80-7.72(m,2h),7.61-7.53(m,1h),4.39(q,j=7.2hz,1h),1.68(d,j=7.2hz,3h)。
步驟2:2-甲基-2-(4-硝基-2-(三氟甲基)苯基)丙腈
向2-(2-(三氟甲基)苯基)丙腈(8g,40.2mmol)在h2so4(39.4g,402mmol)中的混合物中加入硝基過酸鉀(4.87g,48.2)。在0℃下,攪拌該混合物15分鐘。用ea(50ml×2)萃取該混合物,并用水(50ml)洗滌,得到有機層。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,濃縮,得到的2-(4-硝基-2-(三氟甲基)苯基)丙腈和2-(4-硝基-2-(三氟甲基)苯基)丙酰胺的淺黃色混合物(7.8g,19.17mmol,產率47.7%)。.tlc(pe/ea=5:1,rf=0.6):1hnmr(400mhz,cd3od)δ8.65-8.58(m,2h),8.15(d,j=8.4hz,1h),4.55(q,j=7.2hz,1h),1.73(d,j=7.2hz,3h)。
步驟3:2-甲基-2-(4-硝基-2-(三氟甲基)苯基)丙腈
向2-(4-硝基-2-(三氟甲基)苯基)丙酰胺(7.8g,29.7mmol)在dcm(100ml)的混合物中加入et3n(8.29ml,59.5mmol)和tfaa(6.30ml,44.6mmol)。在25℃下,攪拌該混合物16小時。用水洗滌該混合物。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。得到2-(4-硝基-2-(三氟甲基)苯基)丙腈(7.5g,26.1mmol,產率88%)。tlc(pe/ea=5:1,rf0.6):1hnmr(400mhz,cd3od)δ8.65-8.58(m,2h),8.15(d,j=8.4hz,1h),4.55(q,j=7.2hz,1h),1.73(d,j=7.2hz,3h)。
步驟4:2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙腈
向2-(4-硝基-2-(三氟甲基)苯基)丙腈(9g,36.9mmol)在meoh(100ml)中的混合物中加入pd/c(90mg,10%)。在h2氣氛下,在25℃下,攪拌該混合物16小時,過濾反應殘余物并濃縮。通過硅膠柱色譜(pe/ea=3:1)純化殘余物。將通過tlc(pe/ea=3:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的2-(4-氨基-2-(三氟甲基)苯基)丙腈(7g,29.4mmol,產率80%):1hnmr(400mhz,cd3od)δ7.44(d,j=8.4hz,1h),6.99(d,j=2.4hz,1h),6.96-6.92(m,1h),4.19(q,j=7.2hz,1h),1.59(d,j=7.2hz,3h);es-lcmsm/z215.1(m+h)。
步驟5:1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
向2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(200mg,0.506mmol)在1,4-二噁烷(10ml)中的混合物中加入et3n(0.106ml,0.759mmol)和dppa(167mg,0.607mmol)。在25℃下攪拌該混合物15分鐘。然后,向該混合物中加入2-(4-氨基-2-(三氟甲基)苯基)丙腈(130mg,0.607mmol)。在80℃下,攪拌該混合物2小時。濃縮該混合物,并通過制備tlc(dcm/meoh=15:1,rf=0.6)純化,得到黃色固體的1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(10mg,0.014mmol,產率2.77%):1hnmr(400mhz,cd3od)δ9.19(s,1h),8.26(s,1h),8.00(s,1h),7.78-7.73(m,2h),7.37(d,j=7.6hz,2h),6.90(d,j=7.6hz,2h),6.47(s,1h),5.30(s,2h),4.31(m,1h),4.14-4.10(m,2h),3.78(s,3h),2.70(s,3h),1.63(d,j=6.8hz,3h),1.34(t,j=7.2hz,3h);es-lcmsm/z607.1(m+h)。
步驟6:1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
向1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(10mg,0.016mmol)在dcm(10ml)中的混合物中加入tfa(1ml,12.98mmol)。在25℃下,攪拌該混合物2小時。濃縮該混合物,并加入nh4oh(0.5ml)。然后,濃縮反應殘余物,并通過制備hplc(柱∶asbc18150*25mm;流動相a∶水+0.1%hcl;流動相b∶mecn;流速:25ml/min;梯度分布描述:32-62(b%))純化,得到黃白色固體的1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲鹽酸鹽(3.14mg,5.91μmol,產率35.9%):1hnmr(400mhz,cd3od)δ9.19(s,1h),8.26(s,1h),8.00(s,1h),7.78-7.73(m,2h),7.37(d,j=8.0hz,2h),6.90(d,j=8.0hz,2h),6.47(s,1h),5.30(s,2h),4.31(m,1h),4.14-4.10(m,2h),3.78(s,3h),2.70(s,3h),1.63(d,j=6.8hz,3h),1.34(t,j=7.2hz,3h);es-lcmsm/z487.1(m+h);tlc(dcm/meoh=10:1,rf=0.4)。
實施例25:1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:2-甲基-2-(2-(三氟甲基)苯基)丙腈
向2-(2-(三氟甲基)苯基)乙腈(10g,54.0mmol)在dmf(100ml)中的混合物中加入mei(3.38ml,54.0mmol)和nah(2.59g,64.8mmol)。在25℃下,攪拌該混合物16小時。將該混合物濃縮,用水洗滌,并用dcm萃取。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=5:1)純化殘余物。將通過tlc(pe/ea=5:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的2-(2-(三氟甲基)苯基)丙腈(8g,34.1mmol,產率63.2%):1hnmr(400mhz,cd3od)δ7.87-7.81(m,1h),7.80-7.72(m,2h),7.61-7.53(m,1h),4.39(q,j=7.2hz,1h),1.68(d,j=7.2hz,3h)。
步驟2:2-甲基-2-(4-硝基-2-(三氟甲基)苯基)丙腈
向2-甲基-2-(2-(三氟甲基)苯基)丙腈(8g,40.2mmol)在h2so4(39.4g,402mmol)中的混合物中加入硝基過酸鉀(4.87g,48.2mmol)。在0℃下,攪拌該混合物15分鐘。用ea(50ml×2)萃取該混合物,并用水(50ml)洗滌,得到有機層。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,濃縮,得到2-(4-硝基-2-(三氟甲基)苯基)丙腈和2-(4-硝基-2-(三氟甲基)苯基)丙酰胺的淺黃色混合物(7.8g,19.17mmol,產率47.7%)。tlc(pe/ea=5:1,rf=0.6):1hnmr(400mhz,cd3od)δ8.65-8.58(m,2h),8.15(d,j=8.4hz,1h),4.55(q,j=7.2hz,1h),1.73(d,j=7.2hz,3h)。
步驟3:2-甲基-2-(4-硝基-2-(三氟甲基)苯基)丙腈
向2-(4-硝基-2-(三氟甲基)苯基)丙酰胺(7.8g,29.7mmol)在dcm(100ml)的混合物中加入et3n(8.29ml,59.5mmol)和tfaa(6.30ml,44.6mmol)。在25℃下,攪拌該混合物16小時。用水洗滌該混合物。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。得到2-(4-硝基-2-(三氟甲基)苯基)丙腈(7.5g,26.1mmol,產率88%)。tlc(pe/ea=5:1,rf0.6):1hnmr(400mhz,cd3od)δ8.65-8.58(m,2h),8.15(d,j=8.4hz,1h),4.55(q,j=7.2hz,1h),1.73(d,j=7.2hz,3h).
步驟4:2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙腈
向2-(4-硝基-2-(三氟甲基)苯基)丙腈(9g,36.9mmol)在meoh(100ml)中的混合物中加入pd/c(90mg,10%)。在h2氣氛下,在25℃下,攪拌該混合物16小時,過濾反應殘余物并濃縮。通過硅膠柱色譜(pe/ea=3:1)純化殘余物。將通過tlc(pe/ea=3:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的2-(4-氨基-2-(三氟甲基)苯基)丙腈(7g,29.4mmol,產率80%):1hnmr(400mhz,cd3od)δ7.44(d,j=8.5hz,1h),6.99(d,j=2.4hz,1h),6.96-6.92(m,1h),4.19(q,j=7.2hz,1h),1.59(d,j=7.2hz,3h);es-lcmsm/z215.1(m+h)。
步驟5:1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(100mg,0.253mmol)在1,4-二噁烷(10ml)中的混合物中加入et3n(0.053ml,0.379mmol)和dppa(84mg,0.303mmol)。在25℃下,攪拌該混合物15分鐘。然后,向該混合物中加入2-(4-氨基-2-(三氟甲基)苯基)丙腈(65.0mg,0.303mmol)。在80℃下,攪拌該混合物2小時。濃縮該混合物,并通過制備tlc(dcm/meoh=20:1,rf=0.6)純化,得到黃色固體的1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(100mg,0.132mmol,產率52.1%):1hnmr(400mhz,cd3od)δ9.09(s,1h),8.67(d,j=2.0hz,1h),8.08(d,j=1.6hz,1h),7.99(s,1h),7.77-7.69(m,3h),7.40(d,j=8.8hz,2h),6.90(d,j=8.8hz,2h),5.38(s,2h),4.19-4.14(m,2h),4.14-4.10(m,1h),3.78(s,3h),2.57(s,3h),1.63(d,j=7.2hz,3h),1.43(t,j=7.2hz,3h);es-lcmsm/z607.1(m+h)。
步驟6:1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
向1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(100mg,0.165mmol)在dcm(10ml)中的混合物中加入tfa(1ml,12.98mmol)。在25℃下,攪拌該混合物2小時。加入nh4oh(5ml),并濃縮混合物。通過制備hplc(酸性條件;柱∶asbc18150*25mm;流動相a∶水+0.1%hcl;流動相b∶mecn;流速:25ml/min;運行時間∶15min;梯度分布描述:36-66(b%))純化殘余物,得到黃色固體的1-(4-(1-氰基乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲鹽酸鹽(18.56mg,0.035mmol,產率21.41%):1hnmr(400mhz,cd3od)δ9.13(s,1h),8.12(d,j=2.4hz,1h),8.01(s,1h),7.87(d,j=2.0hz,1h),7.76-7.71(m,2h),4.31(q,j=7.2hz,1h),4.16(q,j=6.8hz,2h),2.60(s,3h),1.63(d,j=7.2hz,3h),1.48(t,j=7.2hz,3h);es-lcmsm/z487.1(m+h)。
實施例26:1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:2-甲基-2-(2-(三氟甲基)苯基)丙腈
向2-(2-(三氟甲基)苯基)乙腈(5g,27.0mmol)在dmf(50ml)中的混合物中加入nah(1.620g,67.5mmol)和mei(4.22ml,67.5mmol)。在25℃下,攪拌該混合物16小時。將該混合物用水(100ml)洗滌,并用dcm(120ml×2)萃取。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=10:1)上純化殘余物。將通過tlc(pe/ea=10:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的2-甲基-2-(2-(三氟甲基)苯基)丙腈(4.8g,19.14mmol,產率70.9%):1hnmr(400mhz,cd3od)δ7.83(dd,j=8.4,14.4hz,1h),7.70(t,j=8.0hz,1h),7.62-7.54(m,1h),1.89(s,6h);es-lcmsm/z214.1(m+h)。
步驟2:2-甲基-2-(4-硝基-2-(三氟甲基)苯基)丙腈
向2-甲基-2-(2-(三氟甲基)苯基)丙腈(4.8g,22.51mmol)在h2so4(22.08g,225mmol)中的混合物中加入硝基過酸鉀(2.73g,27.0mol)。在0℃下,攪拌該混合物15分鐘。用ea(50ml×2)萃取該混合物,并用水(50ml)洗滌,得到有機層。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,濃縮,得到淺黃色油狀物的2-甲基-2-(4-硝基-2-(三氟甲基)苯基)丙腈(5g,17.04mmol,產率76%):1hnmr(400mhz,cd3od)δ8.66(d,j=2.4hz,1h),8.53(dd,j=2.4,9.2hz,1h),8.11(d,j=9.2hz,1h),1.95(s,6h);es-lcmsm/z259.0(m+h)。
步驟3:2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙腈
向2-甲基-2-(4-硝基-2-(三氟甲基)苯基)丙腈(8g,31.0mmol)在meoh(100ml)中的混合物中加入pd/c(800mg,10%)。在h2氣氛下,在25℃下,攪拌該混合物15小時。過濾該混合物并濃縮。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=3:1)純化殘余物。將通過tlc(pe/ea=3:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到紅色油狀物的2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙腈(6.7g,24.95mmol,產率81%):1hnmr(400mhz,cd3od)δ7.39(d,j=8.8hz,1h),7.05(d,j=2.4hz,1h),6.84(dd,j=2.4,8.8hz,1h),1.77(s,6h);es-lcmsm/z229.1(m+h)。
步驟4:1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
向2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(200mg,0.506mmol)在1,4-二噁烷(10ml)中的混合物中加入et3n(0.106ml,0.759mmol)和dppa(167mg,0.607mmol)。在25℃下攪拌該混合物15分鐘。然后,向該混合物中加入2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙腈(139mg,0.607mmol)。在80℃下,攪拌該混合物2小時。濃縮該混合物,并通過制備tlc(dcm/meoh=15:1,rf=0.6)純化,得到黃色固體的1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(10mg,0.014mmol,產率2.71%):1hnmr(400mhz,cd3od)δ9.19(s,1h),8.27(s,1h),8.00(s.,1h),7.76(d,j=8.4hz,1h),7.71-7.67(m,1h),7.37(d,j=8.0hz,2h),6.90(d,j=8.0hz,2h),6.47(s,1h),5.30(s,2h),4.14-4.10(m,2h),3.78(s,3h),2.57(s,3h),1.84(s,6h),1.34(t,j=7.2hz,3h);es-lcmsm/z501.2(m-pmb+h)。
步驟5:1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
向1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(10mg,0.016mmol)在dcm(10ml)中的混合物中加入tfa(1ml,12.98mmol)。在25℃下,攪拌該混合物2小時。濃縮該混合物,并加入nh4oh(1ml)。通過制備hplc(儀器∶dc;柱:gemini:c18150*25mm*10ul;流動相a∶水+0.1%hcl;流動相b∶mecn;流速:25ml/min;運行時間∶15min;梯度分布描述:30-60(b%))純化殘余物,得到黃白色固體的1-(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲鹽酸鹽(5.81mg,10.28μmol,產率63.8%):1hnmr(400mhz,cd3od)δ9.48(s,1h),8.33(s,1h),8.08(s,1h),7.76-7.71(m,2h),6.13(s,1h),4.32(q,j=6.8hz,2h),2.74(s,3h),1.85(s,6h),1.46(t,j=6.8hz,3h);es-lcmsm/z501.1(m+h)。
實施例27:1-(5'-乙氧基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:5-溴-2-異氰酰基吡啶
向5-溴吡啶-2-胺(900mg,5.20mmol)在thf(20ml)中的混合物中加入三光氣(509mg,1.717mmol)。在60℃下,攪拌該混合物1小時。lcms顯示反應完成。濃縮該混合物,得到5-溴-2-異氰酰基吡啶(912mg,3.97mmol,產率76%)。
步驟2:1-(5-溴吡啶-2-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向5-溴-2-異氰酰基吡啶(500mg,2.51mmol)在thf(20ml)中的混合物中加入et3n(0.700ml,5.03mmol)和4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯胺(621mg,2.51mmol)。在60下,攪拌該混合物12小時。lcms顯示反應完成。濃縮該混合物,并通過柱色譜(pe/ea=2:1,rf0.2)純化,得到1-(5-溴吡啶-2-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(426mg,0.834mmol,產率33.2%)。1hnmr(400mhz,cd3od)8.34(d,j=2.0hz,1h),7.83(dd,j=2.4,8.8hz,2h),7.61(dd,j=2.4,9.2hz,1h),7.25(d,j=8.4hz,1h),6.67(d,j=8.8hz,1h),4.89(d,j=6.8hz,2h),4.63(d,j=7.2hz,2h),1.72(s,3h);es-lcmsm/z446.0(m+h)。
步驟3:1-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
在n2下,向1-(5-溴吡啶-2-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(200mg,0.448mmol)在1,4-二噁烷(3ml)和水(1ml)中的混合物中加入3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(173mg,0.448mmol)、pdcl2(dppf)(32.8mg,0.045mmol)和cs2co3(292mg,0.896mmol)。在微波下,在110℃下攪拌該混合物30分鐘。lcms顯示反應完成。過濾該混合物,濃縮濾液,并通過tlc(dcm/meohc=30:1,rf0.3)純化,得到1-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(112mg,0.157mmol,產率35.0%)。1hnmr(400mhz,cdcl3)8.38(d,j=2.0hz,1h),7.83(d,j=2.0hz,1h),7.75(d,j=2.4hz,2h),7.73(d,j=2.8hz,1h),7.37(d,j=8.4hz,2h),7.12(d,j=2.0hz,1h),6.84-6.82(m,2h),6.76(d,j=8.4hz,1h),6.39(d,j=9.2hz,1h),5.39(s,2h),4.92(d,j=6.4hz,2h),4.52(d,j=7.2hz,2h),4.09(d,j=6.8hz,2h),3.74(s,3h),1.68(s,3h),1.43(t,j=7.2hz,3h);es-lcmsm/z625.1(m+h)。
步驟4:1-(5'-乙氧基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向1-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(100mg,0.160mmol)在meoh(5ml)中的混合物中加入pd/c(17.04mg,0.160mmol)。在h2下,在20℃下攪拌該混合物12小時。lcms顯示反應完成。過濾該混合物,濃縮濾液,并通過hplc純化,得到1-(5'-乙氧基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(31.83mg,0.063mmol,產率39.4%)。1hnmr(400mhz,dmso-d6)11.80(s,1h),10.43(s,1h),9.46(s,1h),8.50(d,j=2.4hz,1h),7.97(dd,j=2.4,8.8hz,1h),7.88(d,j=2.8hz,1h),7.57-7.50(m,2h),7.28(d,j=2.4hz,1h),7.12(d,j=2.4hz,1h),6.69(d,j=8.8hz,1h),4.72(d,j=6.8hz,2h),4.57(d,j=7.2hz,2h),4.02(d,j=6.8hz,2h),1.63(s,3h),1.32(t,j=6.8hz,3h);es-lcmsm/z505.0(m+h)。
實施例28:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲
步驟1:1-(6-乙酰基-5-(三氟甲基)吡啶-3-基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
在20℃下,向2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(0.2g,0.506mmol)在1,4-二噁烷(10ml)中的混合物中加入et3n(0.102g,1.012mmol)、dppa(0.209g,0.759mmol)和1-(5-氨基-3-(三氟甲基)吡啶-2-基)乙酮(0.103g,0.506mmol)。在80℃下,攪拌該混合物2小時。tlc(dcm/meoh=15:1,rf0.3)和lcms顯示反應完成。濃縮該混合物,并通過tlc(dcm/meoh=15:1,rf0.3)純化,得到1-(6-乙酰基-5-(三氟甲基)吡啶-3-基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(45mg,0.075mmol,產率14.91%):1hnmr(400mhz,cd3od)8.55(s.,1h),8.31-8.24(m,1h),8.08(d,j=1.2hz,1h),7.36(d,j=5.6hz,2h),6.87-6.83(m,3h),6.43(s,1h),5.30(s,2h),4.12(d,j=6.6hz,2h),3.76(s,3h),2.64(s,3h),2.40(s,3h),1.33(d,j=1.5hz,3h);es-lcmsm/z597.2(m+h)。
步驟2:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲
在0℃下,向1-(6-乙酰基-5-(三氟甲基)吡啶-3-基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(22mg,0.037mmol)在thf(10ml)中的混合物中加入memgbr(0.111ml,0.111mmol)。攪拌該混合物1小時。tlc(dcm/meoh=15:1,rf0.4)顯示反應完成。用h2o(0.2ml)和hcl水溶液(0.1ml,1n)淬滅反應。過濾該混合物,干燥濾液,在真空中濃縮,并通過tlc(dcm/meoh=10:1,rf0.2)和制備hplc純化殘余物,得到1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲(2.07mg,4.18μmol,產率11.32%):1hnmr(400mhz,cd3od)9.14(s,1h),8.75(d,j=2.4hz,1h),8.40(d,j=2.4hz,1h),7.79(s,1h),5.99(s,1h),4.11(t,j=7.2hz,2h),2.56(s,3h),1.60(s,6h),1.37(t,j=7.2hz,3h);es-lcmsm/z493.1(m+h)。
實施例29:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲
步驟1:1-(6-乙酰基-5-(三氟甲基)吡啶-3-基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
在20℃下,向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(0.2g,0.506mmol)在二噁烷(10ml)中的混合物中加入et3n(0.102g,1.012mmol),、dppa(0.209g,0.759mmol)和1-(5-氨基-3-(三氟甲基)吡啶-2-基)乙酮(0.103g,0.506mmol)。在80℃下,攪拌該混合物2小時。tlc(dcm/meoh=15:1,rf0.3)和lcms顯示反應完成。在真空中濃縮該混合物,并通過tlc(dcm/meoh=15:1,rf0.3)純化殘余物,得到1-(6-乙酰基-5-(三氟甲基)吡啶-3-基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(50mg,0.064mmol,產率12.68%):1hnmr(400mhz,cd3od)8.53(s,1h),8.08(d,j=1.7hz,1h),7.41-7.40(m,2h),7.24(d,j=8.6hz,2h),6.91-6.87(m,3h),5.38(s,2h),4.15(d,j=2.7hz,2h),3.76(s,3h),2.63(s,3h),2.59(s,3h),1.45(d,j=2.0hz,3h);es-lcmsm/z597.1(m+h)。
步驟2:1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲
在20℃下,向1-(6-乙酰基-5-(三氟甲基)吡啶-3-基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(50mg,0.084mmol)在thf(10ml)中的混合物中加入memgbr(0.251ml,0.251mmol)。攪拌該混合物1小時。tlc(dcm/meoh=10:1,rf=0.5)顯示反應完成。用水(0.3ml)淬滅反應。過濾混合物,在真空中濃縮濾液,并通過tlc(dcm/meoh=10:1,rf0.5)純化殘余物,得到1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲(20mg,0.023mmol,產率27.4%):1hnmr(400mhz,cd3od)8.41(t,j=2.3hz,1h),8.07(dd,j=1.8,4.8hz,1h),7.85(d,j=2.0hz,1h),7.40(d,j=8.6hz,1h),7.25(d,j=8.6hz,2h),6.89-6.85(m,3h),5.37(s,2h),4.19-4.12(m,2h),3.80(s,3h),2.59(s,3h),1.59(s,6h),1.49-1.42(m,3h);es-lcmsm/z493.1(m-pmb+h)。
步驟3:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲
在n2下,向1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲(20mg,0.033mmol)在meoh(10ml)中的混合物中加入pd/c(3.47mg,0.033mmol,10%)。在h2氣氛下,攪拌該混合物1小時。lcms和tlc(dcm/meoh=10:1,rf=0.3)顯示反應完成。過濾該混合物,并通過制備hplc純化濾液,得到1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲(3.91mg,7.83μmol,產率23.97%):1hnmr(400mhz,cd3od)9.01(s,1h),8.74(d,j=2.4hz,1h),8.40(d,j=2.4hz,1h),8.07(d,j=2.0hz,1h),7.86(d,j=2.0hz,1h),4.16-4.11(m,2h),2.55(s,3h),1.60(s,6h),1.48(t,j=6.8hz,3h);es-lcmsm/z493.1(m+h)。
實施例30:1-(2-(二氟甲基)-4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲
步驟1:4-溴-2-(二氟甲基)-1-硝基苯
在0℃下,向5-溴-2-硝基苯甲醛(0.5g,2.174mmol)在dcm(20ml)中的溶液中加入dast(0.431ml,3.26mmol)。在室溫下,攪拌得到的混合物。在2小時之后,tlc分析(pe/ea=3/1)顯示起始物質消失。將該混合物傾倒入冰中。用dcm(50ml)萃取得到的混合物。將有機層干燥并濃縮,得到4-溴-2-(二氟甲基)-1-硝基苯(0.5g,1.936mmol,產率89%),其∶1hnmr(400mhz,cd3od)δ8.12-8.09(m,1h),8.04-8.03(m,1h),7.96-7.93(m,1h),7.51-7.24(m,1h)。
步驟2:4-溴-2-(二氟甲基)苯胺
向4-溴-2-(二氟甲基)-1-硝基苯(0.5g,1.984mmol)和鋅(1.297g,19.84mmol)在meoh(30ml)中的溶液中加入nh4cl(1.061g,19.84mmol)。在25℃下,攪拌得到的混合物過夜。在tlc分析(pe/ea=3/1)顯示起始物質消失之后,過濾該混合物。濃縮濾液,得到殘余物,將其溶于ea(60ml)中,并用h2o(30ml)和鹽水(30ml)洗滌。將有機層經na2so4干燥,過濾并濃縮。通過制備tlc(pe/ea=3/1)純化殘余物,得到黃色固體的4-溴-2-(二氟甲基)苯胺(0.26g,0.713mmol,產率36.0%):1hnmr(400mhz,cdcl3)δ7.35(s,1h),7.34-7.31(m,1h),6.69-6.41(m,1h),6.61(d,j=8.4hz,1h),4.07(brs,2h);es-lcmsm/z221.9,224.0(m+h)。
步驟3:1-(4-溴-2-(二氟甲基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲
向4-溴-2-(二氟甲基)苯胺(100mg,0.450mmol)在thf(10ml)中的溶液中加入三光氣(46.8mg,0.158mmol)。在70℃下,攪拌得到的混合物。在30分鐘之后,lcms分析顯示起始物質消失。在真空下除去溶劑,得到4-溴-2-(二氟甲基)-1-異氰酰基苯(110mg,0.417mmol,產率93%)。向4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯胺(153mg,0.532mmol)、et3n(0.124ml,0.887mmol)和dmap(10.84mg,0.089mmol)在thf(10ml)中的溶液中加入4-溴-2-(二氟甲基)-1-異氰酰基苯(110mg,0.444mmol)在thf(10ml)中的溶液。在70℃下,攪拌得到的混合物。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。通過制備tlc(dcm/meoh=10/1)純化殘余物,得到固體的1-(4-溴-2-(二氟甲基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲(130mg,0.172mmol,產率38.9%):1hnmr(400mhz,cd3od)δ7.86(s,1h),7.75(d,j=8.8hz,1h),7.67-7.63(m,4h),7.03-6.76(m,1h),3.67(s,2h),3.20-3.18(m,2h),2.96(m,8h),1.30(m,3h);es-lcmsm/z535.1,537.1(m+h)。
步驟4:1-(2-(二氟甲基)-4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲
在110℃下,攪拌3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(72.0mg,0.187mmol)、1-(4-溴-2-(二氟甲基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲(100mg,0.187mmol)、pdcl2(dppf)-dcm加合物(15.25mg,0.019mmol)和cs2co3(122mg,0.374mmol)在1,4-二噁烷(3ml)和水(3.00ml)中的溶液15分鐘。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物溶于dcm(60ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。將有機層經na2so4干燥,過濾并濃縮。通過制備tlc(dcm/meoh=10/1)純化殘余物,得到1-(2-(二氟甲基)-4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲(60mg,0.063mmol,產率33.8%):1hnmr(400mhz,cd3od)δ7.95-7.88(m,3h),7.75(m,2h),7.67-7.50(m,2h),7.46(d,j=2.0hz,1h),7.41-7.39(m,1h),6.96-6.90(m,3h),5.36(s,2h),4.17-4.15(m,2h),3.79(s,3h),3.66-3.65(m,2h),3.56-3.55(m,2h),2.70-2.61(m,8h),1.42(t,j=7.0hz,3h),1.17(t,j=7.2hz,3h);es-lcmsm/z714.3(m+h)。
步驟5:1-(2-(二氟甲基)-4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲
在25℃下,攪拌在hcl中的1-(2-(二氟甲基)-4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲(60mg,0.084mmol)在meoh(10ml,175mmol)中的溶液。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。通過制備hplc純化殘余物,得到白色固體的1-(2-(二氟甲基)-4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲二鹽酸鹽(21.83mg,0.033mmol,產率39.0%):1hnmr(400mhz,cd3od)δ8.04(s,1h),7.95(d,j=8.0hz,1h),7.83(m,1h),7.75-7.73(m,3h),7.52-7.50(m,2h),7.10-5.83(m,1h),4.24-4.19(m,4h),3.72-3.26(m,8h),3.12(m,2h),1.49(t,j=6.8hz,3h),1.37(t,j=7.2hz,3h);es-lcmsm/z594.2(m+h)。
實施例31:1-(4-((5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲
步驟1:5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-醇
在0℃下,向3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(2g,5.19mmol)和nahco3(3.05g,36.3mmol)在丙酮(60ml)和水(60ml)中的溶液中滴加二水合物(3.12g,26.0mmol)過夜。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物溶于dcm(100ml)中,并用h2o(30ml)和鹽水(30ml)洗滌。將有機層經na2so4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=3/1)純化殘余物,得到黃色固體的5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-醇(1.3g,4.72mmol,91%yield):1hnmr(400mhz,cd3od)δ7.35-7.32(m,2h),7.22(d,j=2.4hz,1h),6.89-6.87(m,2h),6.78(d,j=2.4hz,1h),5.19(s,2h),4.04-3.98(m,2h),3.77(s,3h),1.37(t,j=7.0hz,3h);es-lcmsm/z276.1(m+h)。
步驟2:3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4-硝基苯氧基)吡啶
在70℃下,攪拌5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-醇(0.3g,1.090mmol)、1-氟-4-硝基苯(0.161g,1.144mmol)和k2co3(0.301g,2.179mmol)在mecn(30ml)中的溶液過夜。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物溶于dcm(60ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。經na2so4干燥有機層,過濾并濃縮。通過硅膠柱色譜(pe/ea=5/1)純化殘余物,得到黃色固體的3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4-硝基苯氧基)吡啶(0.39g,0.924mmol,產率85%):1hnmr(400mhz,cd3od)δ8.23(d,j=9.2hz,2h),7.54(d,j=2.4hz,1h),7.38(d,j=8.4hz,2h),7.11-7.07(m,3h),6.90(d,j=8.4hz,2h),5.33(s,2h),4.06-4.01(m,2h),3.79(s,3h),1.38(t,j=7.0hz,3h);es-lcmsm/z397.1(m+h)。
步驟3:4-((5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)氧基)苯胺
向3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4-硝基苯氧基)吡啶(390mg,0.981mmol)和鋅(642mg,9.81mmol)在甲醇(80ml)中的溶液中加入nh4cl(525mg,9.81mmol)。在25℃下,攪拌得到的混合物。在lcms分析顯示起始物質消失之后。過濾該混合物。濃縮濾液,將其溶于dcm(60ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。將有機層經na2so4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=2/1)純化殘余物,得到4-((5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)氧基)苯胺(250mg,0.646mmol,產率65.9%):1hnmr(400mhz,cd3od)δ7.36-7.34(m,2h),7.27(d,j=2.4hz,1h),6.91-6.89(m,3h),6.79(dd,j=6.8,2.4hz,2h),6.77-6.71(m,2h),5.25(s,2h),4.00-3.95(m,2h),3.78(s,3h),1.35(t,j=7.0hz,3h);es-lcmsm/z367.0(m+h)。
步驟4:1-(4-((5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)氧基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲
向4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯胺(60mg,0.209mmol)在thf(10ml)中的溶液中加入三光氣(21.69mg,0.073mmol)。在70℃下,攪拌得到的混合物。在30分鐘之后,tlc分析(pe/ea=3/1)顯示起始物質消失。在真空下除去溶劑,得到褐色油狀物的1-乙基-4-(4-異氰酰基-2-(三氟甲基)芐基)哌嗪(65mg,0.197mmol,產率94%)。向4-((5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)氧基)苯胺(50mg,0.136mmol)和et3n(44mg,0.4mmol)在thf(10ml)中的溶液中加入1-乙基-4-(4-異氰酰基-2-(三氟甲基)芐基)哌嗪(64.1mg,0.205mmol)在thf(10ml)中的溶液。在70℃下,攪拌得到的混合物。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。用h2o洗滌殘余物。通過制備tlc純化殘余物,得到白色固體的1-(4-((5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)氧基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲(50mg,0.070mmol,產率51.2%):1hnmr(400mhz,cd3od)δ7.85(d,j=2.0hz,1h),7.66-7.64(m,2h),7.42-7.36(m,5h),6.99-6.95(m,3h),6.89(dd,j=6.8,2.0hz,2h),5.29(s,2h),4.03-3.98(m,2h),3.79(s,3h),3.69(s,2h),3.31-2.65(m,8h),1.37(t,j=7.0hz,3h),1.27(t,j=7.2hz,3h);es-lcmsm/z680.1(m+h)。
步驟5:1-(4-((5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲
在25℃下,攪拌在hcl中的1-(4-((5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)氧基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲(50mg,0.074mmol)在meoh(5ml,20.00mmol)中的溶液。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。通過制備hplc純化殘余物,得到無色油狀物的1-(4-((5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲二鹽酸鹽(34.97mg,0.054mmol,產率74.0%):1hnmr(400mhz,cd3od)δ8.02(d,j=2.4hz,1h),7.83(d,j=8.8hz,1h),7.74-7.71(m,1h),7.46-7.44(dd,j=6.8,2.0hz,2h),7.08(d,j=2.8hz,1h),7.01(dd,j=6.8,2.4hz,2h),6.91(d,j=2.8hz,1h),4.25(s,2h),4.09-4.04(m,2h),3.70-3.47(m,8h),3.30-3.19(m,2h),1.44-1.36(m,6h);es-lcmsm/z560.2(m+h)。
實施例32:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲
步驟1:1-乙基-4-(5-氟-2-(三氟甲基)芐基)哌嗪
在20℃下,攪拌5-氟-2-(三氟甲基)苯甲醛(2g,10.41mmol)和1-乙基哌嗪(1.783g,15.62mmol)在dcm(60ml)中的溶液。在2小時之后,加入nabh(oac)3(6.62g,31.2mmol)。在20℃下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后。將該混合物溶于h2o(30ml)中,并用nahco3水溶液調節至ph8。將有機層用鹽水洗滌,并經na2so4干燥。在過濾之后,濃縮濾液,通過柱色譜(dcm/meoh=0至20/1)純化,得到黃色油狀物的1-乙基-4-(5-氟-2-(三氟甲基)芐基)哌嗪(3g,8.74mmol,產率84%):1hnmr(400mhz,cd3od)δ7.78-7.75(m,1h),7.64-7.62(m,1h),7.21-7.18(m,1h),3.80(s,2h),3.24(br.s.,4h),3.13(m,2h),2.77(br.s.,4h),1.34(t,j=7.4hz,3h);es-lcmsm/z291.1(m+h)。
步驟2:1-乙基-4-(5-氟-4-硝基-2-(三氟甲基)芐基)哌嗪
向1-乙基-4-(5-氟-2-(三氟甲基)芐基)哌嗪(3g,10.33mmol)在h2so4(6ml,113mmol)中的溶液中加入硝酸(0.716g,11.37mmol)。在室溫下,攪拌得到的混合物過夜。在50℃下,攪拌該混合物2小時。在tlc分析(pe/ea=10/1)顯示起始物質消失之后,將該混合物用naoh水溶液調節至ph8,并用ea(50ml×2)萃取。將有機層用h2o(50ml)和鹽水(50ml)洗滌。在經na2so4干燥并過濾之后,濃縮濾液,得到黃色油狀物的1-乙基-4-(5-氟-4-硝基-2-(三氟甲基)芐基)哌嗪(2.2g,6.56mmol,產率63.5%):1hnmr(400mhz,cd3od)δ8.39(d,j=7.2hz,1h),7.92(d,j=12.8hz,1h),3.75(s,2h),2.60-2.47(m,10h),1.14-1.10(m,3h);es-lcmsm/z336.1(m+h)。
步驟3:4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯胺
向1-乙基-4-(5-氟-4-硝基-2-(三氟甲基)芐基)哌嗪(2.2g,6.56mmol)和鋅(4.29g,65.6mmol)在meoh(100ml)中的溶液中分批加入nh4cl(3.51g,65.6mmol)。在20℃下,攪拌得到的混合物12小時。在lcms分析顯示起始物質消失之后。過濾該混合物。濃縮濾液,通過制備hplc(流動相a∶含有0.05%nh3.h2o溶液的水/流動相b:mecn/流速∶80ml/min/檢測:uv220nm/254nm/柱∶phenomenexgeminic18250*50mm,10um/柱溫∶rt/梯度分布描述:40-70(b%))純化得到黃色固體的4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯胺(0.7g,2.265mmol,產率34.5%):1hnmr(400mhz,cd3od)δ7.31(d,j=12.8hz,1h),7.10(d,j=8.4hz,1h),3.51(s,2h),2.74-2.15(m,10h),1.10(t,j=7.4hz,3h);es-lcmsm/z306.1(m+h)。
步驟4:1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲
在70℃下,在n2氣氛下,攪拌2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(300mg,0.759mmol)、4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯胺(232mg,0.759mmol)、dppa(313mg,1.138mmol)和et3n(0.159ml,1.138mmol)在1,4-二噁烷(10ml)中的溶液12小時。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物分配在ea(30ml)和h2o(20ml)之間,用ea(30ml×2)萃取。將合并的有機層用鹽水(20ml)洗滌,經na2so4干燥,過濾并濃縮,得到產物,通過制備tlc(dcm/meoh=15/1,rf=0.4)純化,得到褐色固體的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲(200mg,0.272mmol,產率35.9%):1hnmr(400mhz,cd3od)δ9.20(s,1h),8.66(s,1h),8.61(d,j=7.6hz,1h),8.07(s,1h),7.58(d,j=12.0hz,1h),7.41(d,j=8.8hz,2h),6.92(d,j=8.4hz,2h),5.38(s,2h),4.16(m,2h),3.79(s,3h),3.67(s,2h),3.18(m,3h),3.04-2.87(m,4h),2.83-2.52(m,7h),1.44(t,j=6.8hz,3h),1.27-1.20(m,3h);es-lcmsm/z578.2(m+h-pmb)。
步驟5:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲
在25℃下,攪拌在tfa中的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲(200mg,0.287mmol)在dcm(5ml,3.72mmol)中的溶液。在0.5小時之后,lcms分析顯示起始物質消失。在真空下除去溶劑。將殘余物溶于mecn中,并用nh3.h2o調節至ph8。濃縮該混合物,通過制備hplc(儀器∶gilsongx281/柱∶gemini150*25mm*5um/柱溫∶30℃/流動相∶a∶含有0.05%氨水溶液的水b∶mecn/流速∶25ml/min/梯度分布描述:40-70(b%))純化。在冷凍干燥之后,得到白色固體的1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲(40mg,0.069mmol,產率24.16%):1hnmr(400mhz,cd3od)δ9.17(s,1h),8.61(d,j=8.0hz,1h),8.08(s,1h),7.88(s,1h),7.63(d,j=12.4hz,1h),4.17(m,2h),3.66(s,2h),2.78-2.38(m,13h),1.51(t,j=7.0hz,3h),1.14(t,j=7.4hz,3h);es-lcmsm/z578.3(m+h)。
實施例33:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲
步驟1:4,6-二甲基-5-硝基嘧啶-2-醇
在0℃下,向4,6-二甲基嘧啶-2-醇(3g,24.17mmol)在氨基磺酸(10ml,24.17mmol)中的溶液中加入硝酸(1.620ml,36.2mmol)。在室溫下,攪拌得到的混合物過夜。在0℃下,向該混合物中加入naoh水溶液以調節至ph8。過濾該混合物。濃縮濾液。將該混合物懸浮在meoh(200ml)中,并過濾。濃縮濾液,通過柱色譜(dcm/meoh=30/1至10/1)純化,得到黃色固體的4,6-二甲基-5-硝基嘧啶-2-醇(1.6g,8.99mmol,產率37.2%):1hnmr(400mhz,cd3od)δ2.51(s,6h);es-lcmsm/z170.1(m+h)。
步驟2:2-氯-4,6-二甲基-5-硝基嘧啶
向,6-二甲基-5-硝基嘧啶-2-醇(0.5g,2.96mmol)在pocl3(5ml,53.8mmol)中的溶液中加入n,n-二甲基苯胺(0.036g,0.296mmol)。在60℃下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物加入到冰水中,并用na2co3水溶液調節至ph8。過濾該混合物。將濾餅干燥,并通過柱色譜(pe/ea=3/1)純化,得到2-氯-4,6-二甲基-5-硝基嘧啶(130mg,0.606mmol,產率20.52%):1hnmr(400mhz,cd3od)δ2.54(s,6h);es-lcmsm/z188.1(m+h)。
步驟3:2-氯-4,6-二甲基嘧啶-5-胺
向2-氯-4,6-二甲基-5-硝基嘧啶(130mg,0.693mmol)和鋅(45.3mg,0.693mmol)在meoh(20ml)中的溶液中加入nh4cl(37.1mg,0.693mmol)。在25℃下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后。過濾該混合物。濃縮濾液,通過柱色譜(pe/ea=3/1至1/1)純化,得到白色固體的2-氯-4,6-二甲基嘧啶-5-胺(80mg,0.508mmol,產率73.2%):1hnmr(400mhz,cd3od)δ2.33(s,6h)。
步驟4:1-(2-氯-4,6-二甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲
向2-氯-4,6-二甲基嘧啶-5-胺(50mg,0.317mmol)在thf(10ml)中的溶液中加入三光氣(33.0mg,0.111mmol)。在70℃下,攪拌得到的混合物。在lcms分析顯示起始物質消失之后。在真空下除去溶劑,得到2-氯-5-異氰酰基-4,6-二甲基嘧啶(50mg,0.257mmol,產率81%)。向4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯胺(94mg,0.327mmol)和et3n(0.114ml,0.817mmol)在thf(10ml)中的溶液中加入2-氯-5-異氰酰基-4,6-二甲基嘧啶(50mg,0.272mmol)在thf(10ml)中的溶液。.在70℃下,攪拌得到的混合物。在lcms分析顯示起始物質消失之后,在真空下除去溶劑。將殘余物溶于dcm(60ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。經na2so4干燥有機層,過濾并濃縮。通過制備hplc(dcm/meoh=10/1)純化殘余物,得到白色固體的1-(2-氯-4,6-二甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲(80mg,0.167mmol,產率61.2%):1hnmr(400mhz,cd3od)δ7.88(s,1h),7.39(d,j=8.0hz,1h),6.99(d,j=2.8hz,1h),3.75(s,2h),3.04(m,8h),2.49(m,8h),1.37(m,3h);es-lcmsm/z471.0(m+h)。
步驟5:1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4,6-二甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲
在110℃下,攪拌3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(40.9mg,0.106mmol)、1-(2-氯-4,6-二甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲(50mg,0.106mmol)、pdcl2(dppf)-dcm加合物(8.67mg,10.62μmol)和cs2co3(69.2mg,0.212mmol)在1,4-二噁烷(3ml)和水(1ml)中的溶液。在lcms分析顯示起始物質消失之后。將該混合物溶于ea(60ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。經na2so4干燥有機層,過濾并濃縮。通過制備tlc(dcm/meoh=10/1)純化殘余物,得到白色固體的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4,6-二甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲(20mg,0.024mmol,產率22.77%):1hnmr(400mhz,cd3od)δ8.71(d,j=2.0hz,1h),8.12(d,j=1.6hz,1h),7.85(s,1h),7.66(m,2h),7.40(d,j=8.4hz,2h),6.91(d,j=8.4hz,2h),5.39(s,2h),4.19-4.14(m,2h),3.78(s,3h),3.66(s,2h),2.81-2.62(m,10h),2.53(s,6h),1.43(t,j=7.0hz,3h),1.21(t,j=7.2hz,3h);es-lcmsm/z694.2(m+h)。
步驟6:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲
在20℃下,攪拌在hcl中的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4,6-二甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲(40mg,0.058mmol)在meoh(10ml,175mmol)中的溶液。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。通過制備hplc純化殘余物,得到呈黃色固體的1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲三鹽酸鹽(7.79mg,10.92μmol,產率18.94%):1hnmr(400mhz,cd3od)δ8.19(s,1h),7.98(s,1h),7.91(d,j=2.0hz,1h),7.81-7.77(m,2h),4.19-4.13(m,4h),3.68-3.47(m,8h),2.95(m,2h),2.55(s,6h),1.49(t,j=7.2hz,3h),1.36(d,j=7.2hz,3h);es-lcmsm/z574.2(m+h)。
實施例34:1-(4-(4-乙氧基-2-氧代-1,2-二氫嘧啶-5-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:5-溴-2-氯-4-乙氧基嘧啶
將新切的鈉(0.202g,8.78mmol)加入到etoh(50ml)中。在25℃下,攪拌得到的混合物。在鈉消失之后,向該混合物中加入5-溴-2,4-二氯嘧啶(2g,8.78mmol)。在25℃下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后。在真空下除去溶劑,得到白色固體的5-溴-2-氯-4-乙氧基嘧啶(2g,6.22mmol,產率70.9%):1hnmr(400mhz,cd3od)δ8.51(s,1h),4.54-4.49(m,2h),1.42(t,j=7.0hz,3h);es-lcmsm/z236.9,238.9(m+h)。
步驟2:5-溴-4-乙氧基-2-((4-甲氧基芐基)氧基)嘧啶
向(4-甲氧基苯基)甲醇(0.640g,4.63mmol)在dmf(30ml)中的溶液中加入nah(0.202g,5.05mmol)。在室溫下,攪拌得到的混合物。在30分鐘之后,加入5-溴-2-氯-4-乙氧基嘧啶(1g,4.21mmol)。在90℃下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物溶于dcm(60ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。經na2so4干燥有機層,過濾并濃縮。通過硅膠柱色譜純化殘余物,得到5-溴-4-乙氧基-2-((4-甲氧基芐基)氧基)嘧啶(180mg,0.425mmol,產率10.08%):1hnmr(400mhz,cd3od)δ8.36(s,1h),7.39(d,j=8.8hz,2h),6.93(d,j=8.4hz,2h),5.34(s,2h),4.55-4.50(m,2h),3.81(s,3h),1.43(t,j=7.2hz,3h);es-lcmsm/z338.9,340.9(m+h)。
步驟3:1-(4-(4-乙氧基-2-((4-甲氧基芐基)氧基)嘧啶-5-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
在微波上,在110℃下,攪拌5-溴-4-乙氧基-2-((4-甲氧基芐基)氧基)嘧啶(100mg,0.295mmol)、(3-氟-4-(3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲基)苯基)硼酸(126mg,0.295mmol)、pdcl2(dppf)(21.57mg,0.029mmol)和cs2co3(192mg,0.590mmol)在1,4-二噁烷(9ml)和水(3ml)中的溶液15分鐘。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物溶于dcm(60ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。經na2so4干燥有機層,過濾并濃縮。通過制備tlc(pe/ea=2/1)純化殘余物,得到油狀物的1-(4-(4-乙氧基-2-((4-甲氧基芐基)氧基)嘧啶-5-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(70mg,0.086mmol,產率29.2%):1hnmr(400mhz,cd3od)δ8.29(s,1h),8.13(s,1h),7.78(s,1h),7.54(m,1h),7.40-7.31(m,4h),6.92(m,2h),6.62(m,1h),5.38(s,2h),4.89(m,2h),4.63-4.53(m,4h),3.79(s,3h),1.72(s,3h),1.39(m,3h);es-lcmsm/z643.1(m+h)。
步驟4:1-(4-(4-乙氧基-2-氧代-1,2-二氫嘧啶-5-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
在25℃下,攪拌在tfa中的1-(4-(4-乙氧基-2-((4-甲氧基芐基)氧基)嘧啶-5-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(40mg,0.062mmol)在dcm(5ml,7.44mmol)中的溶液。在lcms分析顯示起始物質消失之后。用k2co3水溶液調節該混合物至ph8。在真空下除去溶劑。將殘余物溶于meoh并過濾。將濾液用制備hplc純化以得到呈白色固體的1-(4-(4-乙氧基-2-氧代-1,2-二氫嘧啶-5-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(18mg,0.034mmol,產率55.3%):1hnmr(400mhz,cd3od)δ8.12(t,j=8.4hz,1h),7.82-7.79(m,2h),7.58-7.55(m,1h),7.33(dd,j=12.4,2.0hz,1h),7.27-7.24(m,1h),6.64(d,j=8.8hz,1h),4.93-4.91(m,2h),4.65(d,j=7.6hz,2h),4.52-4.47(m,2h),1.75(s,3h),1.39(t,j=7.2hz,3h);es-lcmsm/z523.2(m+h)。
實施例35:1-(4-(2-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:3-溴-6-氯-2-乙氧基吡啶
將新切的鈉(0.101g,4.41mmol)加入到etoh(50ml)中。在室溫下,攪拌得到的混合物。在固體溶解之后,加入3-溴-2,6-二氯吡啶(1g,4.41mmol)。在70℃下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物溶于dcm(60ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。經na2so4干燥有機層,過濾并濃縮。通過硅膠柱色譜(pe/ea=2020/1)純化殘余物,得到3-溴-2-氯-6-乙氧基吡啶、3-溴-2,6-二乙氧基吡啶和3-溴-6-氯-2-乙氧基吡啶的白色固體混合物(930mg,3.85mmol,產率87%):1hnmr(400mhz,cd3od)δ7.85(d,j=1.2hz,1h),6.88(d,j=8.0hz,1h),4.42-4.36(m,2h),1.39(t,j=7.2hz,3h);es-lcmsm/z235.9,237.9(m+h)。
步驟2:3-溴-2-乙氧基-6-((4-甲氧基芐基)氧基)吡啶
在0℃下,向(4-甲氧基苯基)甲醇(257mg,1.861mmol)在dmf(20ml)中的溶液中加入nah(135mg,3.38mmol)。在室溫下,攪拌得到的混合物。在0.5小時之后,加入3-溴-6-氯-2-乙氧基吡啶(400mg,1.691mmol)。在80℃下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物溶于dcm(60ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。經na2so4干燥有機層,過濾并濃縮。通過硅膠柱色譜和手性hplc純化殘余物,得到白色固體的3-溴-2-乙氧基-6-((4-甲氧基芐基)氧基)吡啶(100mg,0.296mmol,產率17.48%):1hnmr(400mhz,cdcl3)δ7.61(d,j=8.4hz,1h),7.33(d,j=8.8hz,2h),6.88(dd,j=6.8,2.0hz,2h),6.23(d,j=8.0hz,1h),5.24(s,2h),4.44-4.39(m,2h),3.79(s,3h),1.41(t,j=7.0hz,3h);es-lcmsm/z338.0,340.0(m+h)。
步驟3:1-(4-(2-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
在微波上,在110℃下,攪拌3-溴-2-乙氧基-6-((4-甲氧基芐基)氧基)吡啶(30mg,0.089mmol)、(3-氟-4-(3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲基)苯基)硼酸(45.6mg,0.106mmol)、pdcl2(dppf)-dcm加合物(7.24mg,8.87μmol)和cs2co3(57.8mg,0.177mmol)在1,4-二噁烷(3ml)和水(1ml)中的溶液15分鐘。在lcms分析顯示起始物質消失之后。將該混合物用ea(20ml)萃取,并用h2o(10ml)和鹽水(10ml)洗滌。將有機層經na2so4干燥,過濾并濃縮。通過制備tlc(pe/ea=3/1)純化殘余物,得到白色固體的1-(4-(2-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(30mg,0.044mmol,產率49.5%):1hnmr(400mhz,cd3od)δ8.03(t,j=8.6hz,1h),7.77(d,j=2.4hz,1h),7.64(d,j=8.0hz,1h),7.55-7.52(m,1h),7.39-7.33(m,3h),7.29(d,j=8.8hz,1h),6.91-6.89(m,2h),6.61(d,j=8.8hz,1h),6.41(d,j=8.0hz,1h),5.31(s,2h),4.89-4.88(m,2h),4.62(d,j=7.2hz,2h),4.44-4.39(m,2h),3.78(s,3h),1.72(s,3h),1.35(t,j=7.0hz,3h);es-lcmsm/z642.2(m+h)。
步驟4:1-(4-(2-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
在25℃下,攪拌在tfa中的1-(4-(2-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(30mg,0.047mmol)在dcm(5ml,3.72mmol)中的溶液。在lcms分析顯示起始物質消失之后,用na2co3水溶液調節該混合物至ph7。在真空下除去溶劑。將殘余物溶于meoh(5ml)中,過濾,并通過制備hplc純化,得到白色固體的1-(4-(2-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(3mg,5.70μmol,產率12.20%):1hnmr(400mhz,cd3od)δ8.02(t,j=8.6hz,1h),7.77(d,j=2.8hz,1h),7.59(d,j=8.4hz,1h),7.54(dd,j=8.8,2.8hz,1h),7.36(dd,j=12.8,2.0hz,1h),7.27(d,j=8.4hz,1h),6.61(d,j=9.2hz,1h),6.26(d,j=8.4hz,1h),4.90-4.88(m,2h),4.62(d,j=7.2hz,2h),4.38-4.33(m,2h),1.72(s,3h),1.34(t,j=7.2hz,3h);es-lcmsm/z522.0(m+h)。
實施例36:1-(2-氟-4-(5-氟-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:5-溴-3-氟吡啶-2-醇
在80℃下,攪拌5-溴-3-氟-2-甲氧基吡啶(300mg,1.456mmol)在hbr水溶液(5ml,48%)中的溶液。在tlc分析(dcm/meoh=10/1)顯示起始物質消失之后。在真空下除去溶劑,得到黃白色固體的5-溴-3-氟吡啶-2-醇(0.2g,1.042mmol,產率71.5%):1hnmr(400mhz,cd3od)δ7.57(dd,j=10.0,2.4hz,1h),7.46(d,j=2.4,1.6hz,1h);es-lcmsm/z192.0;193.9(m+h)。
步驟2:1-(2-氟-4-(5-氟-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
在微波上,在110℃下,攪拌1-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(300mg,0.588mmol)、5-溴-3-氟吡啶-2-醇(135mg,0.705mmol)、pdcl2(dppf)-dcm加合物(48.0mg,0.059mmol)和cs2co3(575mg,1.764mmol)在1,4-二噁烷(6ml)和水(2ml)中的溶液15分鐘。在lcms分析顯示起始物質消失之后。將該混合物溶于h2o(20ml)中,并用ea(30ml)萃取。將有機層經na2so4干燥,并濃縮。通過制備tlc(dcm/meoh=10/1)和制備hplc(中性條件)純化,得到白色固體的1-(2-氟-4-(5-氟-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(8mg,0.016mmol,產率2.75%):1hnmr(400mhz,cd3od)δ8.18(t,j=8.4hz,1h),7.84-7.80(m,2h),7.58-7.55(m,2h),7.43-7.39(m,1h),7.36-7.34(m,1h),6.65(d,j=9.2hz,1h),4.93-4.88(m,2h),4.66(d,j=7.2hz,1h),1.75(s,3h);es-lcmsm/z496.0(m+h)。
實施例37:1-(2-氟-4-(4-氟-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:(4-氟吡啶-2-基)氨基甲酸叔丁酯
在80℃下,在n2下,攪拌二環己基(2',4',6'-三異丙基-[1,1'-二苯基]-2-基)膦(0.072g,0.152mmol)、2-氯-4-氟吡啶(1g,7.60mmol)、氨基甲酸叔丁基酯(4.45g,38.0mmol)、pd2(dba)3(0.070g,0.076mmol)和cs2co3(12.39g,38.0mmol)在thf(80ml)中的溶液過夜。在lcms分析顯示起始物質消失之后。將該混合物用h2o(100ml)洗滌,并用ea(100ml)萃取。將有機層干燥并濃縮,通過柱色譜純化,得到呈淺黃色固體的(4-氟吡啶-2-基)氨基甲酸叔丁酯(1.3g,5.55mmol,產率73.1%):1hnmr(400mhz,cd3od)δ8.20-8.16(m,1h),7.65(dd,j=12.0,2.4hz,1h),6.81-6.77(m,1h),1.52(s,9h);es-lcmsm/z213.1(m+h)。
步驟2:4-氟吡啶-2-胺
在25℃下,攪拌在hcl中的(4-氟吡啶-2-基)氨基甲酸叔丁酯(0.7g,3.30mmol)在meoh(50ml,200mmol)中的溶液。在tlc分析顯示起始物質消失之后。在真空下除去溶劑,得到固體的4-氟吡啶-2-胺鹽酸鹽(0.5g,3.20mmol,產率97%):1hnmr(400mhz,cd3od)δ7.96(t,j=6.6hz,1h),6.83-6.78(m,1h),6.74-6.71(m,1h);es-lcmsm/z134.9(m+na)。
步驟3:5-溴-4-氟吡啶-2-胺
向4-氟吡啶-2-胺(0.6g,4.04mmol)在mecn(20ml)中的懸浮液中加入et3n(0.563ml,4.04mmol)。所述固體都溶解。然后,加入nbs(0.719g,4.04mmol)。在25℃下,攪拌得到的混合物過夜。lcms分析顯示僅50%的產物。加入nbs(0.719g,4.04mmol)。在25℃下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物溶于dcm(100ml)中,并用h2o(50ml)和鹽水(50ml)洗滌。將有機層經na2so4干燥,過濾并濃縮。通過制備tlc(pe/ea=3/1)純化殘余物,得到黃白色固體的5-溴-4-氟吡啶-2-胺(0.3g,1.319mmol,產率32.7%):1hnmr(400mhz,cdcl3)δ8.11(d,j=9.6hz,1h),6.26(d,j=10.0hz,1h),4.55(brs,2h);es-lcmsm/z192.9(m+h)。
步驟4:5-溴-4-氟吡啶-2-醇
將5-溴-4-氟吡啶-2-胺(100mg,0.524mmol)與50%h3po2水溶液(691mg,5.24mmol)和水(3ml)混合。將該混合物冷卻至約2℃,并加入nano2(43.3mg,0.628mmol)在水(1ml)中的溶液,同時強力攪拌以保持溫度低于5℃。在較低溫度下,攪拌該混合物30分鐘,然后在室溫下再攪拌12小時。在lcms分析顯示起始物質消失之后。將得到的沉淀物過濾,并用水洗滌。將濾餅干燥并濃縮,得到黃色油狀物的5-溴-4-氟吡啶-2-醇(80mg,0.417mmol,產率80%):1hnmr(400mhz,cd3od)δ7.77(d,j=8.8hz,1h),6.31(d,j=10.8hz,1h);es-lcmsm/z191.9,193.9(m+h)。
步驟5:1-(2-氟-4-(4-氟-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
在110℃下,攪拌5-溴-4-氟吡啶-2-醇(40mg,0.208mmol)、(3-氟-4-(3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲基)苯基)硼酸(107mg,0.250mmol)、cs2co3(136mg,0.417mmol)和pdcl2(dppf)(15.24mg,0.021mmol)在1,4-二噁烷(3ml)和水(1ml)中的溶液15分鐘。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物溶于ea(20ml)中,并用h2o(10ml)和鹽水(10ml)洗滌。將有機層經na2so4干燥,過濾并濃縮。通過制備tlc(dcm/meoh=10/1)純化殘余物,得到1-(2-氟-4-(4-氟-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(2.88mg,5.81μmol,產率2.79%):1hnmr(400mhz,cd3od)δ8.17(t,j=8.4hz,1h),7.78(d,j=2.4hz,1h),7.64(d,j=9.6hz,1h),7.55-7.52(m,1h),7.30-7.21(m,2h),6.62(d,j=8.8hz,1h),6.30(d,j=12.8hz,1h),4.89(d,j=6.4hz,2h),4.62(d,j=7.6hz,2h),1.72(s,3h);es-lcmsm/z496.1(m+h)。
實施例38:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(三氟甲基)苯基)脲
步驟1:1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(三氟甲基)苯基)脲
向2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(100mg,0.253mmol)和et3n(0.053ml,0.379mmol)在1,4-二噁烷(5ml)中的溶液中加入dppa(84mg,0.303mmol)。在10分鐘之后,加入3-(三氟甲基)苯胺(61.1mg,0.379mmol)。在60℃下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。通過制備tlc(dcm/meoh=20/1)純化殘余物,得到白色固體的1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(三氟甲基)苯基)脲(10mg,0.018mmol,產率7.14%):1hnmr(400mhz,cd3od)δ1hnmr(400mhz,cd3od)δ9.21(s,1h),8.27(s,1h),7.93(br.s.,1h),7.63(m,1h),7.49(t,j=8.0hz,1h),7.38(d,j=8.8hz,2h),7.32(d,j=8.4hz,1h),6.91(d,j=8.8hz,2h),6.48(s,1h),5.31(s,2h),4.14(m,2h),3.79(s,3h),2.58(s,3h),1.35(t,j=7.0hz,3h);es-lcmsm/z554.1(m+h)。
步驟2:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(三氟甲基)苯基)脲
25℃下,攪拌在hcl中的1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(三氟甲基)苯基)脲(10mg,0.018mmol)在meoh(2ml,8.00mmol)中的溶液。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。通過制備hplc(儀器∶db/柱∶asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b:mecn/流速:25ml/min/梯度分布描述:30-60(b%))純化殘余物。在冷凍干燥之后,得到黃色固體的1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(三氟甲基)苯基)脲鹽酸鹽(3mg,6.23μmol,產率34.5%):1hnmr(400mhz,cd3od)δ9.52(s,1h),8.37(s,1h),7.98(s,1h),7.63(d,j=8.0hz,1h),7.51(t,j=8.0hz,1h),7.36(d,j=7.6hz,1h),6.14(s,1h),4.34(m,2h),2.75(s,3h),1.47(t,j=6.8hz,3h);es-lcmsm/z434.1(m+h)。
實施例39:1-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)-3-(4-甲基-2-(7-氧代-6,7-二氫呋喃并[2,3-c]吡啶-4-基)嘧啶-5-基)脲
步驟1:1-(6-乙酰基-5-(三氟甲基)吡啶-3-基)-3-(2-氯-4-甲基嘧啶-5-基)脲
向2-氯-4-甲基嘧啶-5-胺(65mg,0.453mmol)在thf(5ml)中的溶液中加入三光氣(53.7mg,0.181mmol)。在50℃下,攪拌得到的混合物。在30分鐘之后,lcms分析顯示起始物質消失。在真空下除去溶劑,得到2-氯-5-異氰酰基-4-甲基嘧啶(70mg,0.397mmol,產率88%)。向1-(5-氨基-3-(三氟甲基)吡啶-2-基)乙酮(75mg,0.367mmol)和et3n(0.154ml,1.102mmol)在thf(5ml)中的溶液中加入2-氯-5-異氰酰基-4-甲基嘧啶(68.5mg,0.404mmol)在thf(5ml)中的溶液。在50℃下,攪拌得到的混合物。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物溶于ea中,并用h2o洗滌。將有機層干燥并濃縮,通過制備tlc(dcm/meoh=20/1)純化,得到黃色固體的1-(6-乙酰基-5-(三氟甲基)吡啶-3-基)-3-(2-氯-4-甲基嘧啶-5-基)脲(50mg,0.134mmol,產率36.4%):1hnmr(400mhz,cd3od)δ9.03(s,1h),8.83(d,j=2.4hz,1h),8.52(s,1h),2.64(s,3h),2.52(s,3h);es-lcmsm/z374.0(m+h)。
步驟2:1-(6-乙酰基-5-(三氟甲基)吡啶-3-基)-3-(2-(7-(芐氧基)呋喃并[2,3-c]吡啶-4-基)-4-甲基嘧啶-5-基)脲
在微波上,在110℃下,攪拌7-(芐氧基)-4-(4,4,5,5-四甲基-1,3-二氧戊環-2-基)呋喃并[2,3-c]吡啶(56.4mg,0.161mmol)、1-(6-乙酰基-5-(三氟甲基)吡啶-3-基)-3-(2-氯-4-甲基嘧啶-5-基)脲(60mg,0.161mmol)、pdcl2(dppf)(11.75mg,0.016mmol)和cs2co3(105mg,0.321mmol)在1,4-二噁烷(9ml)和水(3ml)中的溶液15分鐘。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物溶于ea(30ml)中,并用h2o(10ml)和鹽水(10ml)洗滌。將有機層經na2so4干燥,過濾并濃縮。通過制備tlc(pe/ea=1/1)純化殘余物,得到褐色固體的1-(6-乙酰基-5-(三氟甲基)吡啶-3-基)-3-(2-(7-(芐氧基)呋喃并[2,3-c]吡啶-4-基)-4-甲基嘧啶-5-基)脲(60mg,0.107mmol,產率66.4%):1hnmr(400mhz,cd3od)δ9.18(s,1h),8.97-8.92(m,2h),8.56(d,j=8.0hz,1h),8.03(s,1h),7.81(s,1h),7.56(d,j=7.6hz,2h),7.42-7.35(m,3h),5.66(s,2h),2.68(s,3h),2.18(s,3h);es-lcmsm/z563.0(m+h)。
步驟3:1-(2-(7-(芐氧基)呋喃并[2,3-c]吡啶-4-基)-4-甲基嘧啶-5-基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲
在20℃下,向1-(6-乙酰基-5-(三氟甲基)吡啶-3-基)-3-(2-(7-(芐氧基)呋喃并[2,3-c]吡啶-4-基)-4-甲基嘧啶-5-基)脲(60mg,0.107mmol)在thf(5ml)中的溶液中加入甲基氯化鎂(0.356ml,1.067mmol)。在lcms分析顯示起始物質消失之后。用飽和的nh4cl淬滅該混合物。過濾該混合物。濃縮濾液,通過制備tlc(dcm/meoh=20/1)純化,得到1-(2-(7-(芐氧基)呋喃并[2,3-c]吡啶-4-基)-4-甲基嘧啶-5-基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲(30mg,0.051mmol,產率47.8%):1hnmr(400mhz,cd3od)δ9.15(s,1h),8.92(s,1h),8.76(d,j=2.0hz,1h),8.41(d,j=2.4hz,1h),7.99(s,1h),7.78(d,j=2.0hz,1h),7.53(d,j=7.2hz,2h),7.38-7.29(m,3h),5.62(s,2h),2.63(s,3h),1.60(s,6h);es-lcmsm/z579.1(m+h)。
步驟4:1-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)-3-(4-甲基-2-(7-氧代-6,7-二氫呋喃并[2,3-c]吡啶-4-基)嘧啶-5-基)脲
在20℃下,在h2氣氛下,攪拌1-(2-(7-(芐氧基)呋喃并[2,3-c]吡啶-4-基)-4-甲基嘧啶-5-基)-3-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)脲(15mg,0.026mmol)和pd/c(10mg,10%)在meoh(5ml)中的溶液。在0.5小時之后,tlc分析(dcm/meoh=20/1)顯示起始物質消失之后。過濾該混合物。濃縮濾液,通過制備hplc(在中性條件下)純化,得到白色固體的1-(6-(2-羥基丙烷-2-基)-5-(三氟甲基)吡啶-3-基)-3-(4-甲基-2-(7-氧代-6,7-二氫呋喃并[2,3-c]吡啶-4-基)嘧啶-5-基)脲(3.29mg,6.74μmol,產率26.0%)。1hnmr(400mhz,cd3od)δ9.08(s,1h),8.77(br.s.,1h),8.41(br.s.,1h),8.34(s,1h),8.06(s,1h),7.82(s,1h),2.61(s,3h),1.61(s,6h);es-lcmsm/z489.1(m+h)。
實施例40:1-(2-氟-4-(2-甲基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
在微波上,在110℃下,攪拌5-溴-6-甲基吡啶-2-醇(17.69mg,0.094mmol)、1-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(40mg,0.078mmol)、pdcl2(dppf)(5.74mg,7.84μmol)和cs2co3(51.1mg,0.157mmol)在1,4-二噁烷(1.5ml)和水(0.5ml)中的溶液15分鐘。在lcms分析顯示起始物質消失之后。將該混合物溶于ea(20ml)中,并用h2o(10ml)洗滌。將合并的有機萃取物用鹽水(10ml)洗滌,經na2so4干燥,過濾并濃縮。通過制備hplc純化殘余物。在冷凍干燥之后,得到白色固體的1-(2-氟-4-(2-甲基-6-氧代-1,6-二氫吡啶-3-基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(10.21mg,0.020mmol,產率26.1%):1hnmr(400mhz,cd3od)δ8.13(t,j=8.6hz,1h),7.78(d,j=2.4hz,1h),7.55-7.50(m,2h),7.14-7.06(m,2h),6.62(d,j=8.8hz,1h),6.42(d,j=9.2hz,1h),4.89-4.88(m,2h),4.62(d,j=7.2hz,2h),2.28(s,3h),1.72(s,3h);es-lcmsm/z492.1(m+h)。
實施例41:1-(5-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-3-甲基吡嗪-2-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲
步驟1:3-(4-(3-(5-溴-3-甲基吡嗪-2-基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯
向5-溴-3-甲基吡嗪-2-胺(200mg,1.064mmol)在thf(30ml)中的溶液中加入三光氣(110mg,0.372mmol)。在70℃下,攪拌得到的混合物。在lcms分析顯示起始物質消失之后。在真空下除去溶劑,得到5-溴-2-異氰酰基-3-甲基吡嗪(220mg,0.977mmol,產率92%)。向3-(4-氨基-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯(270mg,0.934mmol)在thf(20ml)中的溶液中加入nah(112mg,2.80mmol)。在室溫下,攪拌得到的混合物。在30分鐘之后,加入5-溴-2-異氰酰基-3-甲基吡嗪(200mg,0.934mmol)在thf(20ml)中的溶液。在70℃下,攪拌得到的混合物。在2小時之后,lcms分析顯示起始物質消失。在真空下除去溶劑。將殘余物溶于ea(60ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。將有機層經na2so4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=3/1)純化殘余物,得到白色固體的3-(4-(3-(5-溴-3-甲基吡嗪-2-基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯(330mg,0.357mmol,產率38.2%):1hnmr(400mhz,cd3od)δ8.33(s,1h),7.98(s,1h),7.63(d,j=7.2hz,1h),7.24(d,j=8.8hz,1h),4.18-4.13(m,2h),3.08(d,j=8.0hz,2h),2.54(s,3h),1.26-1.22(m,3h),1.16(s,6h);es-lcmsm/z503.0,505.0(m+h)。
步驟2:3-(4-(3-(5-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-3-甲基吡嗪-2-基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯
在微波上,在110℃下,攪拌3-(4-(3-(5-溴-3-甲基吡嗪-2-基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯(240mg,0.477mmol)、3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(184mg,0.477mmol)、pdcl2(dppf)(34.9mg,0.048mmol)和cs2co3(311mg,0.954mmol)在1,4-二噁烷(9ml)和水(3ml)中的溶液15分鐘。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物溶于ea(60ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。將有機層經na2so4干燥,過濾并濃縮。通過制備tlc(dcm/meoh=40/1)純化殘余物,得到黃色固體的3-(4-(3-(5-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-3-甲基吡嗪-2-基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯(160mg,0.192mmol,產率40.2%):1hnmr(400mhz,cd3od)8.69(br.s.,1h),8.34(br.s.,1h),7.82(d,j=2.0hz,2h),7.55(d,j=8.4hz,2h),7.40(d,j=8.4hz,1h),7.21(d,j=8.4hz,2h),6.91(d,j=8.8hz,1h),5.39(s,2h),4.18-4.14(m,4h),3.78(s,3h),3.07(s,3h),2.56(s,2h),1.24(t,j=7.0hz,6h),1.16(s,6h);es-lcmsm/z682.2(m+h)。
步驟3:1-(5-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-3-甲基吡嗪-2-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲
在0℃下,向3-(4-(3-(5-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-3-甲基吡嗪-2-基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯(80mg,0.117mmol)在thf(10ml)中的溶液中加入lah(8.91mg,0.235mmol)。在室溫下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后。用h2o和naoh(10%)淬滅該混合物。在真空下除去溶劑。將殘余物溶于dcm(40ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。經na2so4干燥有機層,過濾并濃縮。通過制備tlc(dcm/meoh=40/1)純化殘余物,得到淺黃色固體的混合物1-(5-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-3-甲基吡嗪-2-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲(40mg,0.054mmol,產率46.3%):1hnmr(400mhz,cd3od)8.63(s,1h),8.29(d,j=1.6hz,1h),7.91(s,1h),7.78(s,1h),7.67(d,j=6.0hz,1h),7.43-7.38(m,3h),6.89(d,j=8.8hz,2h),5.38(s,2h),4.20-4.14(m,2h),3.78(s,3h),3.42-3.33(m,2h),2.78(s,2h),2.64(s,3h),1.44(t,j=7.0hz,3h),0.84(s,6h);es-lcmsm/z640.2(m+h)。
步驟4:1-(5-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-3-甲基吡嗪-2-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲
在20℃下,攪拌在hcl中的1-(5-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-3-甲基吡嗪-2-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲(40mg,0.063mmol)在meoh(10ml,175mmol)中的溶液。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。通過制備hplc純化殘余物,得到呈黃色固體的1-(5-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-3-甲基吡嗪-2-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲鹽酸鹽(7.06mg,0.013mmol,產率20.31%):1hnmr(400mhz,cd3odanddmso-d6)8.68(s,1h),8.03(s,1h),7.82(s,1h),7.78(m,1h),7.63(s,1h),7.59(m,1h),4.20-4.14(m,2h),3.50(s,2h),2.83(s,2h),2.09(s,3h),1.53(m,3h),0.89(s,6h);es-lcmsm/z520.1(m+h)。
實施例42:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(三氟甲基)苯基)脲
步驟1:1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(三氟甲基)苯基)脲
向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(100mg,0.253mmol)和et3n(0.053ml,0.379mmol)在1,4-二噁烷(5ml)中的溶液中加入dppa(84mg,0.303mmol)。在10分鐘之后,加入3-(三氟甲基)苯胺(61.1mg,0.379mmol)。在60℃下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。通過制備tlc(dcm/meoh=20/1)純化殘余物,得到白色固體的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(三氟甲基)苯基)脲(60mg,0.108mmol,產率42.9%):1hnmr(400mhz,cd3od)δ9.14(s,1h),8.71(d,j=2.0hz,1h),8.12(d,j=2.0hz,1h),7.96(br.s.,1h),7.65(d,j=8.0hz,1h),7.51(m,1h),7.44(d,j=8.8hz,2h),7.27(m,1h),6.94(m,2h),5.42(s,2h),4.21-4.16(m,2h),3.82(s,3h),2.61(s,3h),1.49-1.45(m,3h);es-lcmsm/z554.1(m+h)。
步驟2:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(三氟甲基)苯基)脲
在25℃下,攪拌在tfa中的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(三氟甲基)苯基)脲(60mg,0.108mmol)在dcm(5ml,37.2mmol)中的溶液。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。通過制備hplc(儀器∶db/column:asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:38-68(b%))純化殘余物。在冷凍干燥之后,得到黃色固體的1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(三氟甲基)苯基)脲鹽酸鹽(17mg,0.036mmol,產率33.0%):1hnmr(400mhz,cd3od)δ9.13(s,1h),8.12(d,j=2.0hz,1h),7.94(s,1h),7.87(d,j=2.0hz,1h),7.61(d,j=8.4hz,1h),7.49(m,1h),7.32(d,j=7.2hz,1h),4.17(m,2h),2.60(s,3h),1.49(t,j=7.2hz,3h);es-lcmsm/z434.0(m+h)。
實施例43:1-(4-氰基-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:1-(4-氰基-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(300mg,0.759mmol)和et3n(0.159ml,1.138mmol)在1,4-二噁烷(10ml)中的溶液中加入dppa(251mg,0.910mmol)。在10分鐘之后,加入4-氨基-2-(三氟甲基)芐腈(212mg,1.138mmol)。在60℃下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。通過柱色譜(用dcm至dcm/meoh=20/1洗脫)純化殘余物。將通過tlc(dcm/meoh=20/1,rf=0.4)發現包含產物的所有級分合并,并在真空中濃縮,并通過制備tlc(dcm/meoh=20/1)再純化殘余物,得到褐色固體的1-(4-氰基-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(40mg,0.069mmol,產率9.11%):1hnmr(400mhz,cd3od)δ9.09(s,1h),8.69(d,j=2.0hz,1h),8.17(s,1h),8.10(s,1h),7.90-7.88(m,1h),7.82-7.80(m,1h),7.41(d,j=8.4hz,2h),6.91(d,j=8.8hz,2h),5.39(s,2h),4.19-4.15(m,2h),3.79(s,3h),2.58(s,3h),1.44(t,j=7.0hz,3h),lcmsm/z579.1(m+h)。
步驟2:1-(4-氰基-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
在25℃下,攪拌在tfa中的1-(4-氰基-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(40mg,0.069mmol)在dcm(3ml,2.232mmol)中的溶液。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。通過制備hplc(儀器∶db/柱∶asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:38-68(b%))純化殘余物。在冷凍干燥之后,得到黃色固體的1-(4-氰基-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲鹽酸鹽(18mg,0.036mmol,產率52.2%):1hnmr(400mhz,dmso-d6)δ11.91(br.s.,1h),9.96(s,1h),8.91(s,1h),8.64(s,1h),8.17(s,1h),8.04(d,j=8.4hz,1h),7.91(br.s.,1h),7.80(d,j=8.8hz,1h),7.57(s,1h),4.03-3.98(m,2h),2.43(br.s.,3h),1.34(t,j=7.0hz,3h);es-lcmsm/z459.0(m+h)。
實施例44:1-(4-氰基-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:1-(4-氰基-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
向2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(200mg,0.506mmol)和et3n(0.106ml,0.759mmol)在1,4-二噁烷(10ml)中的溶液中加入dppa(167mg,0.607mmol)。在10分鐘之后,加入4-氨基-2-(三氟甲基)芐腈(141mg,0.759mmol)。在60℃下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。通過制備tlc(dcm/meoh=20/1)純化殘余物,得到褐色固體的1-(4-氰基-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(30mg,0.052mmol,產率10.25%):1hnmr(400mhz,cd3od)δ8.12-8.08(m,2h),7.39-7.36(m,3h),6.92-6.86(m,4h),6.44(s,1h),5.28(s,2h),4.10-4.07(m,2h),3.78(s,3h),2.40(s,3h),1.34-1.31(m,3h);lcmsm/z579.1(m+h)。
步驟2:1-(4-氰基-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
在25℃下,攪拌在hcl中的1-(4-氰基-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(40mg,0.069mmol)在meoh(2ml,8.00mmol)中的溶液。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。通過制備hplc純化殘余物(儀器∶db/柱∶asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:28-58(b%))。在冷凍干燥之后,得到黃色固體的1-(4-氰基-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲鹽酸鹽(8mg,0.016mmol,產率23.38%)。1hnmr(400mhz,cd3od)δ9.43(s,1h),8.30(s,1h),8.21(s,1h),7.92(d,j=8.8hz,1h),7.82(d,j=10.4hz,1h),6.14(s,1h),4.31(m,2h),2.72(s,3h),1.46(t,j=7.2hz,3h);es-lcmsm/z459.1(m+h)。
實施例45:1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(嗎啉代甲基)-3-(三氟甲基)苯基)脲
步驟1:(4-氨基-2-(三氟甲基)苯基)(嗎啉代甲基)甲酮
在25℃下,攪拌4-氨基-2-(三氟甲基)苯甲酸(1g,4.87mmol)、嗎啉(0.637g,7.31mmol)、edc(1.402g,7.31mmol)、hobt(1.120g,7.31mmol)和diea(2.55ml,14.62mmol)在dcm(60ml)中的溶液。在2小時之后,lcms分析顯示起始物質消失。在真空下除去溶劑,并通過柱色譜(dcm/meoh=20/1)純化殘余物,得到無色油狀物的(4-氨基-2-(三氟甲基)苯基)(嗎啉代甲基)甲酮(1.3g,4.59mmol,產率94%):1hnmr(400mhz,cd3od)δ7.06(d,j=8.4hz,1h),6.96(d,j=2.0hz,1h),6.87-6.85(m,1h),3.74-3.66(m,6h),3.58-3.53(m,2h);es-lcmsm/z275.1(m+h)。
步驟2:4-(嗎啉代甲基)-3-(三氟甲基)苯胺
向(4-氨基-2-(三氟甲基)苯基)(嗎啉代)甲酮(0.8g,2.92mmol)在thf(50ml)中的溶液中加入bh3·thf(8.75ml,8.75mmol)。在70℃下,攪拌得到的混合物過夜。在lcms分析顯示起始物質消失之后。用meoh淬滅該混合物,并在70℃下攪拌過夜。在真空下除去溶劑,得到淺黃色油狀物的4-(嗎啉代甲基)-3-(三氟甲基)苯胺(0.8g,1.784mmol,產率61.2%):1hnmr(400mhz,cd3od)δ7.86(d,j=8.4hz,1h),7.46(d,j=2.4hz,1h),7.36(d,j=8.0hz,1h),4.48(s,2h),4.04-4.01(m,2h),3.88-3.81(m,2h),3.45-3.40(m,2h),3.34-3.28(m,2h);es-lcmsm/z261.1(m+h)。
步驟3:1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(嗎啉代甲基)-3-(三氟甲基)苯基)脲
向4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯胺(100mg,0.271mmol)和et3n(0.038ml,0.271mmol)在無水thf(20ml)中的溶液中加入三光氣(28.2mg,0.095mmol)。在70℃下,在n2氣氛下,攪拌得到的混合物。在30分鐘之后,tlc分析(pe/ea=3/1)顯示起始物質消失。在真空下除去溶劑,得到3-乙氧基-5-(3-氟-4-異氰酰基苯基)-2-((4-甲氧基芐基)氧基)吡啶(100mg,0.254mmol,產率93%)。在n2氣氛下,在80℃下,向4-(嗎啉代甲基)-3-(三氟甲基)苯胺(117mg,0.394mmol)和et3n(0.110ml,0.789mmol)在thf(20ml)中的溶液中滴加3-乙氧基-5-(3-氟-4-異氰酰基苯基)-2-((4-甲氧基芐基)氧基)吡啶(100mg,0.263mmol)在thf(20ml)中的溶液。在lc-ms分析顯示起始物質消失之后。過濾該混合物。濃縮濾液,通過制備tlc(dcm/meoh=15/1)和制備hplc純化,得到粉紅色固體的1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(嗎啉代甲基)-3-(三氟甲基)苯基)脲鹽酸鹽(23.07mg,0.040mmol,產率15.13%):1hnmr(400mhz,cd3od)δ8.16(t,j=8.4hz,1h),8.08(d,j=2.0hz,1h),7.81(dd,j=8.6,2.2hz,1h),7.75(d,j=8.8hz,1h),7.43(dd,j=8.4,2.0hz,1h),7.40-7.35(m,3h),4.49(s,2h),4.19-4.13(m,2h),4.07-4.04(m,2h),3.84-3.78(m,2h),3.49-3.46(m,2h),3.36-3.33(m,2h),1.46(t,j=7.0hz,3h);es-lcmsm/z535.2(m+h)。
實施例46:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(化合物a)
向2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(100mg,0.253mmol)在1,4-二噁烷(30ml)中的混合物中加入et3n(0.38.4mg,0.379mmol)和dmap(3.09mg,0.025mmol),并在25℃下,攪拌該混合物15分鐘。然后,加入dppa(104mg,0.379mmol),并攪拌該混合物15分鐘。加入5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-胺(49.1mg,0.253mmol),并在80℃下攪拌該混合物3小時。濃縮該混合物,并通過制備tlc(dcm/meoh=15:1,rf=0.5)純化殘余物,得到1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(20mg),向其中加入tfa(20ml,10%在dcm),并在25℃下攪拌該混合物1小時。濃縮該混合物,并通過制備hplc(儀器∶gilsongx281;柱:gemini150*25mm*5um;流動相a∶水(0.05%氨水溶液);流動相b∶mecn;梯度∶36-66(b%);流速:25ml/min;運行時間∶10min)純化殘余物,得到白色固體的1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(1.83mg,3.92μmol,產率1.551%):1hnmr(400mhz,cd3od)δ9.18(s,1h),7.78(s,1h),6.74(s,1h),5.99(s,1h),4.11(q,j=6.8hz,2h),2.56(s,3h),1.58(s,6h),1.36(t,j=7.2hz,3h);es-lcms(m/z):467.1(m+h)。
實施例47:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲
步驟1:1-(4-(3-((叔丁基二甲基甲硅烷基)氧基)-2,2-二甲基丙基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
在20℃下,在n2下,向2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(0.2g,0.506mmol)在二噁烷(5ml)中的溶液中一次性加入et3n(0.106ml,0.759mmol)和dppa(0.167g,0.607mmol)。在室溫下,攪拌該反應混合物30分鐘。向該混合物中加入4-(3-((叔丁基二甲基甲硅烷基)氧基)-2,2-二甲基丙基)-3-(三氟甲基)苯胺(0.146g,0.405mmol)在1ml的1,4-二噁烷(1ml)中的溶液。將該反應溶液加熱至100℃,同時攪拌3小時。在真空下濃縮該溶液,并通過制備tlc(dcm/meoh=20:1,rf=0.5)純化殘余物,得到淺黃色固體的1-(4-(3-((叔丁基二甲基甲硅烷基)氧基)-2,2-二甲基丙基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(40mg,0.053mmol,產率10.5%):1hnmr(400mhz,cdcl3)δ9.09(s,1h),8.39(br.s.,1h),7.57-7.55(m,1h),7.51(s,1h),7.44-7.40(m,1h),7.34-7.32(m,2h),6.85-6.82(m,2h),6.24(s,1h),5.28(s,2h),4.04-4.01(m,2h),3.75(s,3h),3.21(s,2h),2.70(s,2h),2.48(s,3h),1.31(t,j=6.9hz,3h),0.87(s,9h),0.74(s,6h),0.01(s,6h);es-lcmsm/z754.3(m+h)。
步驟2:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲
向在20℃下,在n2下,攪拌的1-(4-(3-((叔丁基二甲基甲硅烷基)氧基)-2,2-二甲基丙基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(40mg,0.053mmol)在dcm(3ml)中的溶液中一次性加入在meoh中的hcl(0.5ml,2.000mmol)。在20℃下,攪拌該反應混合物1小時。然后,濃縮該溶液。通過制備hplc(儀器∶dc/柱∶asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:12-42(b%))純化殘余物,得到白色固體的1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲鹽酸鹽(10.12mg,0.018mmol,產率34.2%)。tlc(dcm/meoh=5:1,rf=0.4):1hnmr(400mhz,cd3od)δ9.47(s,1h),8.30(s,1h),7.90(d,j=2.2hz,1h),7.59-7.57(m,1h),7.45-7.43(m,1h),6.12(s,1h),4.33-4.28(m,2h),3.33-3.31(m,2h),2.78(s,2h),2.73(s,3h),1.46(t,j=7.1hz,3h),0.84(s,6h);es-lcmsm/z520.1(m+h)。
實施例48:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲
步驟1:1-(4-(3-((叔丁基二甲基甲硅烷基)氧基)-2,2-二甲基丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
向在20℃下,在n2氣氛下攪拌的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(0.1g,0.253mmol)在1,4-二噁烷(5ml)中的溶液中一次性加入et3n(0.053ml,0.379mmol)和dppa(0.084g,0.303mmol)。在室溫下,攪拌反應混合物30分鐘。向該溶液中加入4-(3-((叔丁基二甲基甲硅烷基)氧基)-2,2-二甲基丙基)-3-(三氟甲基)苯胺(0.091g,0.253mmol)在1ml的1,4-二噁烷中的溶液。將反應溶液加熱至100℃并攪拌,持續3小時。然后,在真空下濃縮該溶液,并通過制備tlc(dcm/meoh=20:1,rf=0.6)純化殘余物,得到淺黃色固體的1-(4-(3-((叔丁基二甲基甲硅烷基)氧基)-2,2-二甲基丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(80mg,0.106mmol,產率42.0%):1hnmr(400mhz,cdcl3)δ8.91(s,1h),8.71(s,1h),7.95(s,1h),7.48(s,1h),7.38(d,j=7.3hz,2h),6.88(br.s.,1h),6.80(d,j=7.3hz,1h),6.44(br.s.,1h),5.42(s,2h),4.13-4.10(m,2h),3.72(s,3h),3.21(s,2h),2.70(s,2h),2.43(s,3h),1.40(t,j=6.7hz,3h),0.86(s,9h),0.74(s,6h),0.00(s,6h)。
步驟2:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲
向在20℃下,在n2氣氛下攪拌的1-(4-(3-((叔丁基二甲基甲硅烷基)氧基)-2,2-二甲基丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(80mg,0.106mmol)在在dcm(2ml)中的溶液中一次性加入在meoh中的hcl(0.5ml,2.000mmol)。在20℃下,攪拌反應混合物1小時。然后,濃縮溶液。通過制備hplc純化殘余物(柱∶asbc18150*25mm;流動相a∶水+0.1%hcl;流動相b∶mecn;流速:25ml/min;梯度分布描述:34-64(b%)),得到黃色固體的1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲鹽酸鹽(29.96mg,0.052mmol,產率49.3%)。tlc(dcm/meoh=5:1,rf=0.4):1hnmr(400mhz,cd3od)δ9.10(s,1h),8.10(s,1h),7.88-7.82(m,2h),7.58(d,j=8.8hz,1h),7.42(d,j=8.6hz,1h),4.16-4.13(m,2h),3.33-3.31(m,2h),2.77(s,2h),2.58(s,3h),1.48(t,j=7.1hz,3h),0.84(s,6h);es-lcmsm/z520.1(m+h)。
實施例49:1-(4-((5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-醇
在15分鐘期間,向在0℃下,在空氣中攪拌的3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(1.1g,2.86mmol)和nahco3(1.679g,19.99mmol)在丙酮(15ml)和水(5.00ml)中的溶液中滴加h2o2(0.971g,8.57mmol)。在20℃下,攪拌反應混合物12小時。向該溶液中加入飽和的nahso3溶液。將合并有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過制備tlc(pe/ea=1:1,rf=0.6)純化殘余物,得到淺黃色固體的5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-醇(0.6g,1.744mmol,產率61.1%):1hnmr(400mhz,cdcl3)δ7.39-7.37(m,2h),7.30(d,j=2.4hz,1h),6.87-6.84(m,2h),6.70(d,j=2.4hz,1h),5.38(br,1h),5.31(s,2h),4.03-4.01(m,2h),3.78(s,3h),1.44(t,j=7.0hz,3h);es-lcmsm/z276.1(m+h)。
步驟2:3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4-硝基苯氧基)吡啶
向在20℃下,在n2下攪拌的1-氟-4-硝基苯(141mg,0.999mmol)和5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-醇(250mg,0.908mmol)在mecn(20ml)中的溶液中一次性加入cs2co3(888mg,2.72mmol)。在80℃下,攪拌反應混合物12小時。過濾該混合物,在真空中濃縮濾液,并通過硅膠柱色譜(pe/ea=3:1)純化殘余物。將通過tlc(pe/ea=3:1,rf0.5)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4-硝基苯氧基)吡啶(250mg,0.378mmol,產率41.7%):1hnmr(400mhz,cdcl3)δ8.20(d,j=9.2hz,2h),7.57(d,j=2.4hz,1h),7.44(d,j=8.8hz,2h),7.00(d,j=9.2hz,2h),6.91(d,j=8.8hz,2h),6.82(d,j=2.4hz,1h),5.40(s,2h),4.03-4.01(m,2h),3.80(s,3h),1.44(t,j=7.0hz,3h);es-lcmsm/z397.1(m+h)。
步驟3:3-(4-異氰酰基-2-(三氟甲基)苯氧基)-3-甲基氧雜環丁烷
向在20℃下,在n2下攪拌的4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯胺(100mg,0.405mmol)在thf(6ml)中的溶液中一次性加入三光氣(42.0mg,0.142mmol)。在60℃下,攪拌該反應混合物2小時。步驟4:5-(4-氨基苯氧基)-3-乙氧基吡啶-2(1h)-酮
在室溫下,攪拌3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4-硝基苯氧基)吡啶(250mg,0.631mmol)和pd/c(6.71mg,0.063mmol,10%)在meoh(15ml)中的混合物。使用h-
步驟5:1-(4-((5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向在40℃下,在n2下攪拌的5-(4-氨基苯氧基)-3-乙氧基吡啶-2(1h)-酮(100mg,0.406mmol)、dmap(2.480mg,0.020mmol)和et3n(0.170ml,1.218mmol)在thf(15ml)中的溶液中一次性加入3-(4-異氰酰基-2-(三氟甲基)苯氧基)-3-甲基氧雜環丁烷(222mg,0.812mmol)。在40℃下,攪拌反應混合物1小時。在真空中濃縮該溶液,并通過制備hplc(mecn/h2o作為洗脫液,堿性條件)純化殘余物,得到黃白色固體的1-(4-((5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)氧基)苯基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(126.16mg,0.234mmol,產率57.5%):1hnmr(400mhz,cd3od)δ7.75(d,j=2.4hz,1h),7.53-7.50(m,1h),7.40-7.36(m,2h),6.96(dd,j=2.0hz,6.8hz,2h),6.83(d,j=2.4hz,1h),6.74(d,j=2.8hz,1h),6.61(d,j=8.8hz,1h),4.89-4.83(m,2h),4.63(d,j=7.2hz,2h),4.00-3.97(m,2h),1.71(s,3h),1.42(t,j=7.0hz,3h);es-lcmsm/z520.1(m+h)。
實施例50:1-(5'-乙氧基-6-甲基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲鹽酸鹽
步驟1:3-溴-5-乙氧基吡啶
在室溫下,向5-溴吡啶-3-醇(45g,259mmol)在dmf(400ml)中的混合物中加入k2co3(71.5g,517mmol)和eti(48.4g,310mmol)。在70℃下,攪拌該混合物12小時。lcms和tlc(pe/ea=5:1,rf0.4)顯示反應完成。過濾該混合物,在真空中濃縮濾液,并通過柱純化殘余物,得到3-溴-5-乙氧基吡啶(30g,135mmol,產率52.2%):1hnmr(400mhz,cd3od)δ8.18(d,j=2.8hz,2h),7.59(d,j=2.4hz,1h),4.11(d,j=7.2hz,2h),1.40(t,j=7.2hz,3h);es-lcmsm/z204(m+2h)。
步驟2:3-溴-5-乙氧基吡啶1-氧化物
向3-溴-5-乙氧基吡啶(28g,139mmol)在dcm(500ml)中的混合物中加入m-cpba(28.7g,166mmol)。在20℃下,攪拌該混合物10小時。lcms和tlc(dcm/meoh=40:1,rf0.4)顯示反應完成。用naso3和飽和的nahco3溶液洗滌該混合物。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮,得到3-溴-5-乙氧基吡啶1-氧化物(30g,128mmol,產率92%):1hnmr(400mhz,cd3od)δ8.16(d,j=3.2hz,1h),8.05(d,j=3.6hz,1h),7.47(d,j=3.2hz,1h),4.12(d,j=7.2hz,2h),1.38(t,j=7.2hz,3h);es-lcmsm/z220(m+2h)。
步驟3:5-溴-2-氯-3-乙氧基吡啶
向3-溴-5-甲氧基吡啶1-氧化物(28g,128mmol)在dcm(300ml)中的混合物中加入pocl3(168ml,1798mmol)。在40℃下,攪拌該混合物12小時。lcms和tlc(pe/ea=5:1,rf0.6)顯示反應完成。濃縮該混合物,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=10:1)純化,得到5-溴-2-氯-3-乙氧基吡啶(26g,106mmol,產率82%):1hnmr(400mhz,cd3od)δ8.00(d,j=2.0hz,1h),7.65(d,j=2.0hz,1h),4.16(d,j=7.2hz,2h),1.43(t,j=7.2hz,3h);es-lcmsm/z238(m+2h)。
步驟4:2-(芐氧基)-5-溴-3-乙氧基吡啶
向5-溴-2-氯-3-乙氧基吡啶(700mg,2.96mmol)在苯基甲醇(10ml)中的混合物中加入鈉(340mg,14.80mmol)。在100℃下,攪拌該混合物3小時。lcms顯示反應完成。用水稀釋該混合物,并用ea萃取該混合物,在真空中濃縮,并通過硅膠柱色譜(pe/ea=5:1)純化殘余物,得到2-(芐氧基)-5-溴-3-乙氧基吡啶(751mg,2.193mmol,產率74.1%):1hnmr(400mhz,cdcl3)δ7.74(d,j=6.8hz,1h),7.46(d,j=2.0hz,2h),7.36-7.24(m,3h),7.13(d,j=2.4hz,1h),5.43(s,2h),4.07(d,j=6.8hz,2h),1.44(t,j=6.8hz,3h);es-lcmsm/z309(m+2h)。
步驟5:2-(芐氧基)-3-乙氧基-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶
向在20℃下,在n2下攪拌的2-(芐氧基)-5-溴-3-乙氧基吡啶(1.5g,4.87mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-雙(1,3,2-二氧雜硼雜環戊烷)(1.483g,5.84mmol)和koac(0.955g,9.73mmol)在1,4-二噁烷(15ml)中的溶液中一次性加入pdcl2(dppf)(0.178g,0.243mmol)。在100℃下,攪拌該反應混合物3小時。在真空中濃縮該溶液,并通過硅膠柱色譜(pe/ea=5:1)純化殘余物。將通過tlc(pe/ea=5:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的2-(芐氧基)-3-乙氧基-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(1.2g,1.858mmol,產率38.2%):1hnmr(400mhz,cdcl3)δ8.10(s,1h),7.48(d,j=7.6hz,2h),7.35-7.26(m,4h),5.50(s,2h),4.13-4.08(m,2h),1.48(t,j=7.0hz,3h),1.32(s,12h);es-lcmsm/z356.2(m+h)。
步驟6:6'-(芐氧基)-5'-乙氧基-6-甲基-5-硝基-2,3'-二吡啶
向在20℃下,在n2下攪拌的2-(芐氧基)-3-乙氧基-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(491mg,1.382mmol)、6-溴-2-甲基-3-硝基吡啶(250mg,1.152mmol)和cs2co3(938mg,2.88mmol)在1,4-二噁烷(6ml)和水(2.000ml)中的溶液中一次性加入pdcl2(dppf)(42.1mg,0.058mmol)。將反應容器密封,并在cemdiscover中使用初始100w加熱至110℃15分鐘。在冷卻之后,在真空中濃縮反應物,并通過tlc(dcm:meoh=10:1,rf=0.5)純化殘余物,得到期望的產物6'-(芐氧基)-5'-乙氧基-6-甲基-5-硝基-2,3'-二吡啶(250mg,0.643mmol,產率55.8%):1hnmr(400mhz,cdcl3)δ8.36-8.34(m,2h),7.87(d,j=2.0hz,1h),7.69(d,j=8.4hz,1h),7.50-7.48(m,2h),7.38-7.29(m,3h),5.55(s,2h),4.24-4.19(m,2h),2.93(s,3h),1.50(t,j=7.0hz,3h);es-lcmsm/z366.1(m+h)。
步驟7:5-氨基-5'-乙氧基-6-甲基-[2,3'-聯吡啶]-6'(1'h)-酮
在室溫下,攪拌6'-(芐氧基)-5'-乙氧基-6-甲基-5-硝基-2,3'-二吡啶(250mg,0.684mmol)和10%pd/c(7.28mg,0.068mmol)在meoh(15ml)中的混合物。使用h-cube(設定:20℃,流速)和作為催化劑的10%pd/c氫化反應。tlc顯示混合物完成。過濾該混合物,并在真空中濃縮濾液,得到黃色油狀物的5-氨基-5'-乙氧基-6-甲基-[2,3'-聯吡啶]-6'(1'h)-酮(150mg,0.605mmol,產率88%):1hnmr(400mhz,cdcl3)δ7.27(d,j=2.8hz,2h),7.10(d,j=8.0hz,1h),6.91(d,j=8.4hz,1h),4.04-3.99(m,2h),3.86(br,2h),2.32(s,3h),1.38(t,j=7.0hz,3h);es-lcmsm/z246.1(m+h)。
步驟8:3-(4-異氰酰基-2-(三氟甲基)苯氧基)-3-甲基氧雜環丁烷
向在20℃下,在n2下攪拌的4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯胺(50mg,0.202mmol)在thf(6ml)中的溶液中一次性加入三光氣(21.01mg,0.071mmol)。在60℃下,攪拌該反應混合物2小時。
步驟9:1-(5'-乙氧基-6-甲基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲鹽酸鹽
向在40℃下,在n2下攪拌的5-氨基-5'-乙氧基-6-甲基-[2,3'-聯吡啶]-6'(1'h)-酮(40mg,0.163mmol)、dmap(0.996mg,8.15μmol)和et3n(0.068ml,0.489mmol)在thf(10ml)中的溶液中一次性加入3-(4-異氰酰基-2-(三氟甲基)苯氧基)-3-甲基氧雜環丁烷(66.8mg,0.245mmol)。在40℃下,攪拌反應混合物1小時。在真空中濃縮溶液,并通過制備hplc(mecn/h2o作為洗脫液,酸性條件)純化殘余物,得到黃色固體的1-(5'-乙氧基-6-甲基-6'-氧代-1',6'-二氫-[2,3'-聯吡啶]-5-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲鹽酸鹽(41.7mg,0.074mmol,產率45.2%):1hnmr(400mhz,cd3od)δ8.97(d,j=8.8hz,1h),8.00(d,j=8.8hz,1h),7.85(d,j=2.8hz,1h),7.72(d,j=2.4hz,1h),7.,58(dd,j=2.4hz,8.8hz,1h),7.37(d,j=2.0hz,1h),6.65(d,j=9.2hz,1h),4.89-4.88(m,2h),4.64(d,j=7.6hz,2h),4.18-4.12(m,2h),2.77(s,3h),1.72(s,3h),1.50(t,j=7.0hz,3h);es-lcmsm/z519.2(m+h)。
實施例51:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-羥基丙烷-2-基)-3-(三氟甲基)苯基)脲
步驟1:4-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶
在1分鐘期間,向在-70℃下,在n2下攪拌的5-溴-4-乙氧基-2-((4-甲氧基芐基)氧基)吡啶(5.5g,16.26mmol)在thf(40ml)中的溶液中分批加入n-buli(7.81ml,19.52mmol)。在-70℃下,攪拌反應混合物1小時。然后,在-70℃下,向該溶液中加入在thf(1ml)中的4-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(1.7g,4.41mmol,產率27.1%)同時攪拌。在-70℃下,攪拌該溶液1小時。向該溶液中加入飽和的nh4cl溶液。然后,濃縮該溶液,并分配在ea和水之間。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=5:1)純化殘余物。將通過tlc(pe/ea=5:1,rf=0.4)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的4-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(1.7g,4.41mmol,產率27.1%):1hnmr(400mhz,cdcl3)δ8.28(s,1h),7.37(d,j=8.4hz,2h),6.88(d,j=8.6hz,2h),6.13(s,1h),5.30(s,2h),4.00(q,j=6.8hz,2h),3.80(s,3h),1.40(t,j=6.9hz,3h),1.32(s,12h);es-lcmsm/z386.2(m+h)。
步驟2:2-氯-4-甲基嘧啶-5-胺
向在20℃下,在n2下攪拌的2,4-二氯-6-甲基-5-硝基嘧啶(20g,96mmol)和nh4cl(51.4g,962mmol)在meoh(600ml)中的溶液中一次性加入鋅(62.9g,962mmol)。在70℃下,攪拌該反應混合物50小時。過濾該混合物,并在真空中濃縮濾液,并通過硅膠柱色譜(dcm/meoh=30:1)純化殘余物。將通過tlc(ea/ea=1=1:1,rf0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的2-氯-4-甲基嘧啶-5-胺(1.8g,12.54mmol,產率13.04%):1hnmr(400mhz,cd3od-d4)δ7.92(s,1h),2.33(s,3h);es-lcmsm/z144.1(m+1)。
步驟3:2-氯-5-異氰酰基-4-甲基嘧啶
向在20℃下,在n2下攪拌的2-氯-4-甲基嘧啶-5-胺(250mg,1.741mmol)在thf(8ml)中的溶液中一次性加入三光氣(181mg,0.609mmol)。在60℃下,攪拌該反應混合物30分鐘。es-lcmsm/z202.1(m+32)。
步驟4:1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-氯-4-甲基嘧啶-5-基)脲
向在40℃下,在n2下攪拌的1-(4-氨基-2-(三氟甲基)苯基)乙酮二鹽酸鹽(300mg,1.087mmol)、dmap(398mg,3.26mmol)和et3n(7.57μl,0.054mmol)在thf(6ml)中的溶液中一次性加入2-氯-5-異氰酰基-4-甲基嘧啶(240mg,1.413mmol)。在40℃下,攪拌反應混合物1小時。然后,濃縮該溶液,并通過制備tlc(pe/ea=1:1,rf0.2)純化殘余物,得到淺黃色固體的1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-氯-4-甲基嘧啶-5-基)脲(30mg,0.080mmol,產率7.41%):1hnmr(400mhz,cd3od-d4)δ9.05(s,1h),7.97(s,1h),7.79-7.69(m,2h),2.56(s,3h),2.51(s,3h);es-lcmsm/z373.1(m+h)。
步驟5:1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
向在20℃下,在n2下攪拌的(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)硼酸(73.2mg,0.241mmol)、1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-氯-4-甲基嘧啶-5-基)脲(90mg,0.241mmol)和cs2co3(197mg,0.604mmol)在1,4-二噁烷(3ml)和水(1.000ml)中的溶液中一次性加入pdcl2(pph3)2(8.47mg,0.012mmol)。將反應容器密封,并在cemdiscover中使用初始模式加熱至110℃20分鐘。在冷卻之后,濃縮反應溶液,并分配在ea和水之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過制備tlc(dcm/meoh=10:1,rf=0.6)純化殘余物,得到褐色固體的1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(30mg,0.050mmol,產率20.86%):1hnmr(400mhz,cdcl3)δ9.12(s,1h),8.45(s,1h),8.21(br.s.,1h),7.77(d,j=8.5hz,1h),7.66(s,1h),7.50(d,j=8.5hz,1h),7.38(d,j=8.5hz,2h),7.30(br.s.,1h),6.89(d,j=8.5hz,2h),6.32(s,1h),5.33(s,2h),4.10(q,j=6.9hz,2h),3.81(s,3h),2.59(s,3h),2.50(s,3h),1.37(t,j=7.0hz,3h);es-lcmsm/z596.1(m+h)。
步驟6:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-羥基丙烷-2-基)-3-(三氟甲基)苯基)脲
向在20℃下,在n2下攪拌的1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(50mg,0.084mmol)在dcm(10ml)中的溶液中一次性加入memgbr(0.168ml,0.504mmol)。在20℃下,攪拌反應混合物1小時。向該溶液中加入飽和的nh4cl溶液。濃縮該混合物。通過制備tlc(dcm/meoh=10:1,rf=0.4)純化殘余物,得到淺黃色固體的不純的產物。將其通過制備hplc(mecn/h2o作為洗脫液,酸性條件)純化,得到白色固體的1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-羥基丙烷-2-基)-3-(三氟甲基)苯基)脲(4.18mg,8.28μmol,產率9.87%)。tlc(dcm/meoh=10:1,rf=0.4):1hnmr(400mhz,cd3od-d4)δ9.16(s,1h),7.88(s,1h),7.77(s,1h),7.66(s,2h),5.99(s,1h),4.11(q,j=7.0hz,2h),2.55(s,3h),1.61(s,6h),1.36(t,j=6.9hz,3h);es-lcmsm/z492.(m+1)。
實施例52:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲
步驟1:1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲
向在20℃下,在n2下攪拌的2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(0.2g,0.506mmol)在1,4-二噁烷(3ml)中的溶液中一次性加入et3n(0.106ml,0.759mmol)和dppa(0.167g,0.607mmol)。在室溫下,攪拌該反應混合物30分鐘。向該混合物中,加入3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯胺(0.122g,0.506mmol)在1ml的1,4-二噁烷中的溶液。將該反應溶液加熱至100℃,同時攪拌3小時。在真空中濃縮該溶液,并通過制備tlc(dcm/meoh=10:1,rf=0.5)純化殘余物,得到黃白色固體的1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲(60mg,0.095mmol,產率18.7%):1hnmr(400mhz,cd3od)δ9.18(s,1h),9.15(s,1h),8.39(s,1h),8.25(s,1h),8.04(s,1h),7.81(s,1h),7.54(s,1h),7.25-7.23(m,2h),6.87-6.85(m,2h),6.48(s,1h),5.31(s,2h),4.13-4.10(m,2h),3.79(s,3h),2.82(s,3h),2.59(s,3h),1.40-1.36(m,3h);es-lcmsm/z634.2(m+h)。
步驟2:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲
向在20℃下,在n2下攪拌的1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲(70mg,0.110mmol)在dcm(5ml)中的溶液中一次性加入在meoh中的hcl(0.5ml,2.000mmol)。在20℃下,攪拌該反應混合物1小時。然后,濃縮溶液。通過制備hplc(儀器∶dc/柱∶asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:32-62(b%))純化殘余物,得到黃白色固體的1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲二鹽酸鹽(17.58mg,0.030mmol,產率27.0%)。tlc(dcm/meoh=5:1,rf=0.4):1hnmr(400mhz,cd3od)δ9.49(s,1h),9.47-9.44(m,1h),8.41(s,1h),8.18(s,1h),8.06(s,1h),7.88(s,1h),7.75(s,1h),6.18(s,1h),4.35(d,j=7.2hz,2h),2.79(s,3h),2.45(s,3h),1.48(t,j=6.9hz,3h);es-lcmsm/z514.2(m+h)。
實施例53:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲
步驟1:4,6-二甲基-2-氧代-1,2,5,6-四氫嘧啶-5-羧酸乙酯
在350ml耐壓燒瓶中,將3-氧代丁酸乙酯(16.27g,125mmol)、乙醛(5.51g,125mmol)、脲(7.51g,125mmol)和冰acoh(1ml,17.47mmol)在etoh(35ml)中的混合物加熱至90℃過夜。用水稀釋該混合物。通過過濾收集沉淀,用水洗滌并風干,得到白色固體的4,6-二甲基-2-氧代-1,2,3,4-四氫嘧啶-5-羧酸乙酯(12g,60.5mmol,產率48.4%):1hnmr(400mhz,dmso-d6)δ8.95(br.s.,1h),7.18(br.s.,1h),4.13-3.95(m,3h),2.12(s,3h),1.16(t,j=7.0hz,3h),1.06(d,j=6.4hz,3h);lcmsm/z199.0(m+h)。
步驟2:4,6-二甲基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯
向在0℃下,在n2下攪拌的硝酸(12ml,17.66mmol)中分批加入4,6-二甲基-2-氧代-1,2,3,4-四氫嘧啶-5-羧酸乙酯(3.5g,17.66mmol)。在0℃下,攪拌該反應混合物10分鐘。將該反應溶液傾倒入60g的冰水中,然后用ea萃取。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮。得到4,6-二甲基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯(2.6g,13.25mmol,產率75%)。tlc(pe/ea=5:1,rf=0.6):1hnmr(400mhz,cdcl3)δ13.71-13.48(m,1h),4.36(q,j=7.1hz,2h),2.56(s,6h),1.38(t,j=7.1hz,3h);es-lcmsm/z197.1(m+h)。
步驟3:2-氯-4,6-二甲基嘧啶-5-羧酸乙酯
向在20℃下,在n2下攪拌的pocl3(10.42ml,122mmol)和diea(33ml,189mmol)的溶液中慢慢地加入4,6-二甲基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯(2.4g,12.23mmol)。在80℃下,攪拌該反應混合物2小時。然后,濃縮該溶液,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=10:1)純化殘余物。將通過tlc(pe/ea=10:1,rf=0.7)發現包含產物的所有級分合并,并濃縮,得到黃色油狀物的2-氯-4,6-二甲基嘧啶-5-羧酸乙酯(1.6g,7.45mmol,產率60.9%):1hnmr(400mhz,cdcl3)δ4.43(q,j=6.8hz,2h),2.54(s,6h),1.40(t,j=7.1hz,3h);es-lcmsm/z215.1(m+h)。
步驟4:2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4,6-二甲基嘧啶-5-羧酸乙酯
向在20℃下,在n2下攪拌的3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(2.51g,6.52mmol)、2-氯-4,6-二甲基嘧啶-5-羧酸乙酯(1.4g,6.52mmol)和cs2co3(4.25g,13.04mmol)在1,4-二噁烷(15ml)和水(5.00ml)中的溶液中一次性加入pdcl2(dppf)(0.477g,0.652mmol)。在110℃下,加熱該反應容器2小時。然后,將溶液濃縮,并分配在ea和水之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜tlc(pe/ea=10:1,5:1)純化殘余物。將通過tlc(pe/ea=2:1,rf0.5)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4,6-二甲基嘧啶-5-羧酸乙酯(1.7g,3.89mmol,產率59.6%):1hnmr(400mhz,cdcl3)δ8.86-8.82(m,1h),8.08-8.04(m,1h),7.48-7.42(m,2h),6.87(d,j=8.6hz,2h),5.49(s,2h),4.43(s,2h),4.23-4.15(m,2h),3.79(s,3h),2.58(s,6h),1.52-1.45(m,3h),1.41(t,j=7.1hz,3h);lcmsm/z438.2(m+h)。
步驟5:2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-羧酸
向在20℃下,在n2下攪拌的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4,6-二甲基嘧啶-5-羧酸乙酯(500mg,1.143mmol)在thf(5ml)中的溶液中一次性加入naoh(2.5ml,6.25mmol)。在100℃下,攪拌該反應混合物12小時。然后,濃縮溶液,并用濃hcl中和至ph=7.0,同時攪拌。然后過濾,并用水(10ml)洗滌濾餅。在真空中干燥濾餅,得到黃白色固體的2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-羧酸(300mg,1.037mmol,產率91%)。tlc(dcm/meoh=10:1,rf0.4):1hnmr(400mhz,cd3od)δ8.16(d,j=2.0hz,1h),7.87(d,j=2.0hz,1h),4.18-4.12(m,2h),2.59-2.56(m,6h),1.47(t,j=6.9hz,3h);lcmsm/z290.2(m+h)。
步驟6:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲
向在20℃下,在n2下攪拌的2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-羧酸(150mg,0.519mmol)、3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯胺(125mg,0.519mmol)和et3n(79mg,0.778mmol)在1,4-二噁烷(5ml)中的溶液中一次性加入dppa(171mg,0.622mmol)。將該反應混合物加熱至80℃1小時。然后,濃縮溶液。通過制備hplc(儀器∶dc/柱∶asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:15-55(b%))純化殘余物,得到黃白色固體的1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲二鹽酸鹽(11.53mg,3.67%)。tlc(dcm/meoh=5:1,rf=0.4):1hnmr(400mhz,cd3od)δ9.44-9.40(m,1h),8.27-8.23(m,1h),8.20(s,1h),7.92(s,2h),7.84(s,1h),7.69(s,1h),4.17(d,j=6.8hz,2h),2.57(s,6h),2.44(s,3h),1.48(t,j=6.9hz,3h);es-lcmsm/z528.2(m+h)。
實施例54:1-(4-氯-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:1-(4-氯-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
在20℃下,在n2下,向2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(200mg,0.506mmol)在1,4-二噁烷(5ml)中的溶液中一次性加入et3n(0.106ml,0.759mmol)和dppa(167mg,0.607mmol)。在室溫下,攪拌該反應混合物30分鐘。向該溶液中,加入4-氯-3-(三氟甲基)苯胺(79mg,0.405mmol)在1ml的1,4-二噁烷中的溶液。將該反應溶液加熱至100℃3小時,同時攪拌。在真空中濃縮該溶液,并通過制備tlc(dcm/meoh=20:1,rf=0.5)純化殘余物,得到黃白色固體的1-(4-氯-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(25mg,0.043mmol,產率8.41%):1hnmr(400mhz,cd3od)δ9.18(s,1h),8.27(s,1h),8.00(s,1h),7.92(br.s.,1h),7.85(s,1h),7.39-7.26(m,2h),6.92-6.90(m,2h),6.48(s,1h),5.30(s,2h),4.17-4.15(m,2h),3.79(s,3h),2.58(s,3h),1.42-1.39(m,3h);es-lcmsm/z588.1(m+h)。
步驟2:1-(4-氯-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
向在20℃下,在n2下攪拌的1-(4-氯-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(25mg,0.043mmol)在dcm(2ml)中的溶液中一次性加入在meoh中的hcl(0.5ml,2.000mmol)。在20℃下,攪拌反應混合物1小時。然后,濃縮溶液。通過制備hplc(儀器∶dc/柱∶asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:33-63(b%))純化殘余物,得到黃白色固體的1-(4-氯-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲鹽酸鹽(6.15mg,0.012mmol,產率28.5%)。tlc(dcm/meoh=5:1,rf=0.4):1hnmr(400mhz,cd3od)δ9.50(s,1h),8.39(s,1h),8.07(d,j=2.2hz,1h),7.68-7.62(m,1h),7.55(d,j=8.6hz,1h),6.15(s,1h),4.34(q,j=6.8hz,2h),2.75(s,3h),1.47(t,j=6.9hz,3h);es-lcmsm/z468(m+h)。
實施例55:1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:(6-(芐氧基)-4-乙氧基吡啶-3-基)硼酸
在1分鐘期間,向在-70℃下,在n2氣氛下攪拌的2-(芐氧基)-4-乙氧基-5-碘吡啶(500mg,1.408mmol)在thf(12ml)中的溶液中分批加入n-buli(0.619ml,1.549mmol)。在-70℃下,攪拌反應混合物1小時。然后,在-70℃下,向該溶液中慢慢地加入在thf(1ml)中的2-異丙氧基-4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷(288mg,1.549mmol),同時攪拌。在-70℃下,攪拌該溶液1小時。向該混合物中加入飽和的nh4cl溶液。然后,濃縮該溶液,并分配在ea和水之間。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮。得到(6-(芐氧基)-4-乙氧基吡啶-3-基)硼酸(300mg,1.099mmol,產率78%)。tlc(pe/ea=2:1,rf=0.4):1hnmr(400mhz,cdcl3)δ8.21(br.s.,1h),7.46-7.22(m,5h),6.15(br.s.,1h),5.26(br.s.,2h),4.02(d,j=6.8hz,2h),1.41(t,j=6.7hz,3h);es-lcmsm/z274.1(m+1)。
步驟2:2-氯-4-甲基嘧啶-5-胺
向在20℃下,在n2氣氛下攪拌的2,4-二氯-6-甲基-5-硝基嘧啶(20g,96mmol)和20(51.4g,962mmol)在meoh(600ml)中的溶液中一次性加入鋅(62.9g,962mmol)。在70℃下,攪拌反應混合物50小時。過濾該混合物,在真空中濃縮濾液,并通過硅膠柱色譜(dcm/meoh=30:1)純化殘余物。將通過tlc(pe/ea=1=1:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的2-氯-4-甲基嘧啶-5-胺(1.8g,12.54mmol,產率13.04%):1hnmr(400mhz,cd3od)δ7.92(s,1h),2.33(s,3h);es-lcmsm/z144.1(m+h)。
步驟3:2-氯-5-異氰酰基-4-甲基嘧啶
向在20℃下,在n2氣氛下攪拌的2-氯-4-甲基嘧啶-5-胺(250mg,1.741mmol)在thf(8ml)中的溶液中一次性加入三光氣(181mg,0.609mmol)。在60℃下,攪拌該反應混合物30分鐘。es-lcmsm/z202.1(m+32)。
步驟4:1-(2-氯-4-甲基嘧啶-5-基)-3-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)脲
向在40℃下,在n2氣氛下攪拌的4-((二甲基氨基)甲基)-3-(三氟甲基)苯胺二鹽酸鹽(200mg,0.687mmol)、dmap(252mg,2.061mmol)和et3n(4.79μl,0.034mmol)在thf(6ml)中的溶液中一次性加入2-氯-5-異氰酰基-4-甲基嘧啶(175mg,1.030mmol)。在40℃下,攪拌反應混合物1小時。然后,濃縮該溶液,并通過制備tlc(pe/ea=1:1,rf0.2)純化殘余物,得到淺黃色固體的1-(2-氯-4-甲基嘧啶-5-基)-3-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)脲(210mg,0.542mmol,產率79%):1hnmr(400mhz,cd3od)δ9.05(s,1h),8.08(s,1h),7.83-7.78(m,1h),7.71(d,j=8.4hz,1h),4.31(br.s.,2h),2.83-2.77(m,6h),2.53(s,3h);es-lcmsm/z388.1(m+h)。
步驟5:1-(2-(6-(芐氧基)-4-乙氧基吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)脲
向在20℃下,在n2氣氛下攪拌的(6-(芐氧基)-4-乙氧基吡啶-3-基)硼酸(127mg,0.464mmol)、1-(2-氯-4-甲基嘧啶-5-基)-3-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)脲(150mg,0.387mmol)和cs2co3(315mg,0.967mmol)在1,4-二噁烷(9ml)和水(3.00ml)中的溶液中一次性加入pdcl2(pph3)2(13.58mg,0.019mmol)。將反應容器密封,并在cemdiscover中使用初始模式加熱至110℃20分鐘。在冷卻之后,將溶液濃縮,并分配在ea和水之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜tlc(pe/ea=1:1)純化殘余物。將通過tlc(pe/ea=1:1,rf=0.3)發現包含產物的所有級分合并,并濃縮,得到褐色固體的1-(2-(6-(芐氧基)-4-乙氧基吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)脲(30mg,0.052mmol,產率13.36%):1hnmr(400mhz,cdcl3)δ10.11(br.s.,1h),9.31(s,1h),8.62(br.s.,1h),8.45(s,1h),8.15(d,j=8.4hz,1h),7.46(d,j=7.5hz,2h),7.41-7.34(m,2h),7.32(d,j=7.3hz,1h),6.33(s,1h),5.41(s,2h),4.30(s,2h),4.09(q,j=7.1hz,2h),2.81(s,6h),2.72(s,3h),1.37(t,j=6.9hz,3h);es-lcmsm/z581.0(m+h)。
步驟6:1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
向在20℃下,在n2氣氛下攪拌的1-(2-(6-(芐氧基)-4-乙氧基吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)脲(30mg,0.052mmol)在meoh(10ml)中的溶液中一次性加入pd/c(3mg,在水中10%)。在20℃下,攪拌反應混合物12小時。過濾該混合物,在真空中濃縮濾液,并通過制備(mecn/h2o作為洗脫液,酸性條件)純化殘余物,得到淺黃色固體的1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲二鹽酸鹽(10.86mg,0.019mmol,產率36.5%)。tlc(dcm/meoh=10:1,rf0.3):1hnmr(400mhz,cd3od)δ9.49(s,1h),8.38(s,1h),8.17(d,j=2.0hz,1h),7.88-7.84(m,1h),7.73(d,j=8.4hz,1h),6.16(s,1h),4.47(s,2h),4.34(q,j=6.9hz,2h),2.93(s,6h),2.76(s,3h),1.47(t,j=7.1hz,3h);es-lcmsm/z491.1(m+h)。
實施例56:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-乙基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲
步驟1:6-乙基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯
攪拌脲(7.5g,125mmol)、3-氧代戊酸乙酯(19.80g,137mmol)在三乙氧基甲烷(20.36g,137mmol)中的溶液28小時,同時在80℃下,在n2氣氛下蒸餾出etoh。然后,將該混合物冷卻至20℃,并加入etoh(50ml),向上述混合中加入在etoh(50ml)中的naoet(12.75g,187mmol),并在80℃下攪拌該混合物2小時,將該混合物冷卻至20℃,接著加入水(100ml),在20-30℃下加入acoh(10ml),然后過濾該混合物,用水(150ml)洗滌固體,干燥,得到6-乙基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯(12g,61.2mmol,產率49.0%)。1hnmr(400mhz,dmso-d6)δ8.67(s,1h),4.20(q,j=7.1hz,2h),2.87(q,j=7.3hz,2h),1.25(t,j=7.1hz,3h),1.12(t,j=7.5hz,3h);lcmsm/z197.0(m+h)。
步驟2:2-氯-4-乙基嘧啶-5-羧酸乙酯
在室溫下,將4-乙基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯(2.4g,12.23mmol)溶于pocl3(28.1g,183mmol)中。將該反應混合物加熱至80℃2小時。在真空中濃縮該溶液,并通過硅膠柱色譜(pe/ea=10:1)純化殘余物。將通過tlc(pe/ea=10:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的2-氯-4-乙基嘧啶-5-羧酸乙酯(0.7g,3.26mmol,產率26.7%):1hnmr(400mhz,cdcl3)δ8.98(s,1h),4.48-4.38(m,2h),3.19-3.13(m,2h),1.42-1.38(m,3h),1.32-1.28(m,3h)。
步驟3:2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-乙基嘧啶-5-羧酸乙酯
向在20℃下,在n2下攪拌的3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(0.897g,2.329mmol)、2-氯-4-乙基嘧啶-5-羧酸乙酯(0.5g,2.329mmol)和cs2co3(1.518g,4.66mmol)在1,4-二噁烷(9ml)和水(3.00ml)中的溶液中一次性加入pdcl2(dppf)(0.170g,0.233mmol)。在110℃下,加熱反應容器2小時。然后,將溶液濃縮,并分配在ea和水之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=10:1,5:1)純化殘余物。將通過tlc(pe/ea=2:1,rf0.5)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-乙基嘧啶-5-羧酸乙酯(0.7g,1.600mmol,產率68.7%):1hnmr(400mhz,cdcl3)δ9.12(s,1h),8.92(s,1h),8.11(s,1h),7.45(d,j=8.1hz,2h),6.88(d,j=8.1hz,3h),5.50(s,2h),4.40(d,j=7.1hz,2h),4.20(d,j=7.1hz,2h),3.79(s,3h),3.20-3.18(m,2h),1.48(t,j=6.8hz,3h),1.41(t,j=7.1hz,3h),1.36(t,j=7.5hz,3h);lcmsm/z438.2(m+h)。
步驟4:2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-乙基嘧啶-5-羧酸
向在20℃下,在n2下攪拌的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-乙基嘧啶-5-羧酸乙酯(0.7g,1.600mmol)在meoh(5ml)中的溶液中一次性加入naoh(5ml,12.50mmol)。在80℃下,攪拌該反應混合物12小時。然后,濃縮該溶液,并用濃hcl中和至ph=7.0,同時攪拌。然后過濾,并用水(10ml)洗滌濾餅。在真空中干燥濾餅,得到黃白色固體的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-乙基嘧啶-5-羧酸(0.5g,1.221mmol,產率76%)。tlc(dcm/meoh=10:1,rf0.4):1hnmr(400mhz,cd3od)δ8.8-8.77(m,1h),8.76-8.72(m,1h),8.14(d,j=1.7hz,1h),7.41(d,j=8.6hz,2h),6.91(d,j=8.6hz,2h),5.39(s,2h),4.17-4.13(m,2h),3.78(s,3h),3.16-3.11(m,2h),1.43(t,j=7.0hz,3h),1.34(t,j=7.6hz,3h);lcmsm/z410.1(m+h)。
步驟5:1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-乙基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲
向在20℃下,在n2下攪拌的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-乙基嘧啶-5-羧酸(150mg,0.366mmol)、3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯胺(88mg,0.366mmol)和et3n(55.6mg,0.550mmol)在1,4-二噁烷(10ml)中的溶液中一次性加入dppa(121mg,0.440mmol)。在80℃下,攪拌反應混合物2小時。然后,濃縮該溶液。通過制備tlc(dcm/meoh=10:1,rf=0.5)純化殘余物,得到黃白色固體的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-乙基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲(50mg,0.077mmol,產率21.07%)。tlc(dcm/meoh=10:1,rf=0.4):1hnmr(400mhz,cd3od)δ9.07(s,1h),8.74-8.72(m,1h),8.12(d,j=9.3hz,2h),7.98(br.s.,1h),7.77-7.75(m,1h),7.50(br.s.,1h),7.41(d,j=8.6hz,2h),7.35(s,1h),6.92(d,j=8.8hz,2h),5.40(s,2h),4.17(d,j=7.1hz,2h),3.79(s,3h),2.91(d,j=7.5hz,2h),2.26(s,3h),1.42(td,j=7.3,14.6hz,6h);es-lcmsm/z648.3(m+h)。
步驟6:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-乙基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲
向在20℃下,在n2下攪拌的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-乙基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲(50mg,0.077mmol)在dcm(5ml)中的溶液中一次性加入在meoh中的hcl(1ml,4.00mmol)。在20℃下,攪拌反應混合物1小時。然后,濃縮溶液。通過制備hplc(儀器∶dc/柱:asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:25-55(b%))純化殘余物,得到黃白色固體的1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-乙基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲二鹽酸鹽(10.25mg,0.017mmol,產率21.67%)。tlc(dcm/meoh=5:1,rf=0.4):1hnmr(400mhz,dmso-d6)δ11.95-11.87(m,1h),10.44(br.s.,1h),9.56(br.s.,1h),8.98(d,j=3.4hz,1h),8.10-7.87(m,4h),7.74(br.s.,1h),7.59(s,1h),5.73(s,1h),4.03-3.98(m,2h),2.85-2.80(m,2h),2.32(s,3h),1.34(t,j=6.8hz,3h),1.25(t,j=7.5hz,3h);es-lcmsm/z528.2(m+h)。
實施例57:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲
步驟1:1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲
向在20℃下,在n2氣氛下攪拌的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(0.2g,0.506mmol)在1,4-二噁烷(4ml)中的溶液中一次性加入et3n(0.106ml,0.759mmol)和dppa(0.167g,0.607mmol)。攪拌該反應混合物15分鐘。向該混合物中加入3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯胺(0.122g,0.506mmol)在1ml的1,4-二噁烷中的溶液,并加熱到100℃2小時。在旋轉蒸發器上除去溶劑。通過制備tlc(dcm:meoh=10:1,rf=0.5)純化殘余物,得到黃白色固體的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲(70mg,0.110mmol,產率21.84%):1hnmr(400mhz,cd3od)δ9.10(s,1h),8.66(s,1h),8.22(s,1h),8.07(s,1h),7.98(s,1h),7.78(s,1h),7.50(s,1h),7.39(d,j=4.2hz,3h),6.90(d,j=8.6hz,2h),5.37(s,2h),4.19-4.13(m,2h),3.78(s,3h),2.59(s,3h),2.29(s,3h),1.43(t,j=6.9hz,3h);lcmsm/z634.2(m+h)。
步驟2:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲
向在20℃下,在n2下攪拌的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲(70mg,0.110mmol)在dcm(5ml)中的溶液中一次性加入在meoh中的hcl(0.5ml,2.000mmol)。在20℃下,攪拌反應混合物1小時。然后,濃縮溶液。通過制備hplc(儀器∶dc;柱∶gemini:c18150*25mm*10ul;流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/運行時間:15min/梯度分布描述:18-48(b%))純化殘余物,得到黃白色固體的1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(4-甲基-1h-咪唑-1-基)-5-(三氟甲基)苯基)脲二鹽酸鹽(39.06mg,0.065mmol,產率58.5%)。tlc(dcm/meoh=10:1,rf=0.4):1hnmr(400mhz,dmso-d6)δ10.95(br.s.,1h),9.64(s,1h),9.27(s,1h),9.05(s,1h),8.07(s,1h),8.02(s,1h),7.96(br.s.,1h),7.89(s,1h),7.74(s,1h),7.56(s,1h),4.02-3.97(m,2h),2.52(s,3h),2.33(s,3h),1.33(t,j=6.8hz,3h);es-lcmsm/z514.1(m+h)。
實施例58:1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
向在20℃下,在n2氣氛下攪拌的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(0.2g,0.506mmol)在1,4-二噁烷(5ml)中的溶液中一次性加入et3n(0.106ml,0.759mmol)和dppa(0.167g,0.607mmol)。在室溫下,攪拌該反應混合物30分鐘。向該混合物中加入4-((二甲基氨基)甲基)-3-(三氟甲基)苯胺(0.088g,0.405mmol)在1ml的1,4-二噁烷中的溶液,并加熱至100℃3小時。除去溶劑,并通過制備tlc(dcm/meoh=10:1,rf=0.4)純化殘余物,得到淺黃色固體的1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(110mg,0.180mmol,產率35.6%)。1hnmr(400mhz,cd3od)δ8.67(d,j=1.8hz,1h),8.08(d,j=1.8hz,1h),7.97(s,1h),7.67(d,j=8.8hz,1h),7.40(d,j=8.6hz,2h),7.24(d,j=7.2hz,2h),6.91(d,j=8.6hz,2h),5.38(s,2h),4.16(q,j=7.1hz,2h),4.08(br.s.,2h),3.78(s,3h),2.57(s,3h),2.44(s,6h),1.29(t,j=7.3hz,3h);es-lcmsm/z611.1(m+h)。
步驟2:1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
向在20℃下,在n2氣氛下攪拌的1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(110mg,0.180mmol)在dcm(2ml)中的溶液中一次性加入在meoh中的hcl(0.5ml,2.000mmol)。在20℃下,攪拌反應混合物1小時。然后,濃縮溶液。通過制備hplc(柱∶asbc18150*25mm/流動相a∶水+0.1%hcl)/流動相b∶mecn/流速:25ml/min/運行時間∶15min/梯度分布描述:15-45(b%))純化殘余物,得到黃色固體的1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲二鹽酸鹽(21.34mg,0.037mmol,產率20.5%)。tlc(dcm/meoh=5:1,rf=0.4):1hnmr(400mhz,cd3od)δ9.12(s,1h),8.12(dd,j=2.1,5.4hz,2h),7.90-7.83(m,2h),7.70(d,j=8.6hz,1h),4.46(s,2h),4.18-4.15(m,2h),2.93(s,6h),2.61(s,3h),1.48(t,j=6.9hz,3h);es-lcmsm/z491.2(m+h)。
實施例59:1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-基)脲
步驟1:4,6-二甲基-2-氧代-1,2,5,6-四氫嘧啶-5-羧酸乙酯
在350ml的耐壓燒瓶中,將3-氧代丁酸乙酯(16.27g,125mmol)、乙醛(5.51g,125mmol)、脲(7.51g,125mmol)和冰acoh(1ml,17.47mmol)在etoh(35ml)中的混合物加熱至90℃過夜。用水稀釋該混合物。通過過濾收集沉淀,用水洗滌并風干,得到白色固體的4,6-二甲基-2-氧代-1,2,3,4-四氫嘧啶-5-羧酸乙酯(12g,60.5mmol,產率48.4%):1hnmr(400mhz,dmso-d6)δ8.95(br.s.,1h),7.18(br.s.,1h),4.13-3.95(m,3h),2.12(s,3h),1.16(t,j=7.0hz,3h),1.06(d,j=6.4hz,3h);lcmsm/z202.1(m+h)。
步驟2:4,6-二甲基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯
向在0℃下,在n2下攪拌的硝酸(12ml,17.66mmol)中分批加入4,6-二甲基-2-氧代-1,2,3,4-四氫嘧啶-5-羧酸乙酯(3.5g,17.66mmol)。在0℃下,攪拌該反應混合物10分鐘。將該反應溶液傾倒入60g的冰水中,然后用ea萃取。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮。得到4,6-二甲基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯(2.6g,13.25mmol,產率75%)。tlc(pe/ea=5:1,rf=0.6):1hnmr(400mhz,cdcl3)δ13.71-13.48(m,1h),4.36(q,j=7.1hz,2h),2.56(s,6h),1.38(t,j=7.1hz,3h);es-lcmsm/z197.1(m+h)。
步驟3:2-氯-4,6-二甲基嘧啶-5-羧酸乙酯
向在20℃下,在n2下攪拌的pocl3(10.42ml,122mmol)和diea(33ml,189mmol)的溶液中慢慢地加入4,6-二甲基-2-氧代-1,2-二氫嘧啶-5-羧酸乙酯(2.4g,12.23mmol)。在80℃下,攪拌該反應混合物2小時。然后,濃縮該溶液,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=10:1)純化殘余物。將通過tlc(pe/ea=10:1,rf=0.7)發現包含產物的所有級分合并,并濃縮,得到黃色油狀物的2-氯-4,6-二甲基嘧啶-5-羧酸乙酯(1.6g,7.45mmol,產率60.9%):1hnmr(400mhz,cdcl3)δ4.43(q,j=6.8hz,2h),2.54(s,6h),1.40(t,j=7.1hz,3h);es-lcmsm/z215.2(m+h)。
步驟4:2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4,6-二甲基嘧啶-5-羧酸乙酯
向在20℃下,在n2下攪拌的3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(2.51g,6.52mmol)、2-氯-4,6-二甲基嘧啶-5-羧酸乙酯(1.4g,6.52mmol)和cs2co3(4.25g,13.04mmol)在1,4-二噁烷(15ml)和水(5.00ml)中的溶液中一次性加入pdcl2(dppf)(0.477g,0.652mmol)。在110℃下,加熱該反應容器2小時。然后,將溶液濃縮,并分配在ea和水之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜tlc(pe/ea=10:1,5:1)純化殘余物。將通過tlc(pe/ea=2:1,rf0.5)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4,6-二甲基嘧啶-5-羧酸乙酯(1.7g,3.89mmol,產率59.6%):1hnmr(400mhz,cdcl3)δ8.86-8.82(m,1h),8.08-8.04(m,1h),7.48-7.42(m,2h),6.87(d,j=8.6hz,2h),5.49(s,2h),4.43(s,2h),4.23-4.15(m,2h),3.79(s,3h),2.58(s,6h),1.52-1.45(m,3h),1.41(t,j=7.2hz,3h);lcmsm/z438.2(m+h)。
步驟5:2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-羧酸
向在20℃下,在n2下攪拌的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4,6-二甲基嘧啶-5-羧酸乙酯(500mg,1.143mmol)在thf(5ml)中的溶液中一次性加入naoh(2.5ml,6.25mmol)。在100℃下,攪拌反應混合物12小時。然后,將該溶液濃縮,并用濃hcl中和至ph=7.0,同時攪拌。接著,過濾溶液,并用水(10ml)洗滌濾餅。在真空中干燥濾餅,得到黃白色固體的2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-羧酸(300mg,1.037mmol,產率91.0%)。tlc(dcm/meoh=10:1,rf0.4):1hnmr(400mhz,cd3od)δ8.16(d,j=2.0hz,1h),7.87(d,j=2.0hz,1h),4.18-4.12(m,2h),2.59-2.56(m,6h),1.47(t,j=6.9hz,3h);lcmsm/z290.1(m+h)。
步驟6:1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-基)脲
向在20℃下,在n2下攪拌的2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-羧酸(150mg,0.519mmol)、4-((二甲基氨基)甲基)-3-(三氟甲基)苯胺(113mg,0.519mmol)和et3n(79mg,0.778mmol)在1,4-二噁烷(8ml)中的溶液中一次性加入dppa(171mg,0.622mmol)。將反應混合物加熱至80℃2小時。然后,濃縮溶液。通過制備hplc(儀器∶dc/柱:asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:15-55(b%))純化殘余物,得到黃色固體的1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4,6-二甲基嘧啶-5-基)脲二鹽酸鹽(14.17mg,0.024mmol,產率4.72%)。tlc(dcm/meoh=5:1,rf=0.4):1hnmr(400mhz,cd3od)δ8.23(d,j=2.2hz,1h),8.10(d,j=2.0hz,1h),7.92(d,j=2.0hz,1h),7.87(dd,j=2.0,8.4hz,1h),7.71(d,j=8.4hz,1h),4.46(s,2h),4.18(q,j=7.2hz,2h),2.92(s,6h),2.59(s,6h),1.48(t,j=7.0hz,3h);es-lcmsm/z505.3(m+h)。
實施例60:1-(4-氯-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:1-(4-氯-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
向在20℃下,在n2下攪拌的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(100mg,0.253mmol)在1,4-二噁烷(5ml)中的溶液中一次性加入et3n(0.053ml,0.379mmol)和dppa(84mg,0.303mmol)。在室溫下,攪拌反應混合物30分鐘。向該混合物中加入4-氯-3-(三氟甲基)苯胺(39.6mg,0.202mmol)在1ml的1,4-二噁烷(1ml)中的溶液。將該反應溶液加熱至100℃3小時,同時攪拌。在真空中濃縮該溶液,并通過制備tlc(pe/ea=5:1,rf=0.6)純化殘余物,得到黃白色固體的1-(4-氯-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(70mg,0.088mmol,產率34.8%)。1hnmr(400mhz,cd3od)δ8.68(s,1h),8.49(s,1h),8.09(s,1h),8.01-7.98(m,1h),7.65(s,1h),7.51-7.48(m,1h),7.41-7.38(m,2h),6.92-6.89(m,2h),5.39(s,2h),4.16-4.13(m,2h),3.78(s,3h),2.57(s,3h),1.44-1.41(m,3h);es-lcmsm/z588.0(m+h)。
步驟2:1-(4-氯-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
向在20℃下,在n2氣氛下攪拌的1-(4-氯-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(70mg,0.088mmol)在dcm(2ml)中的溶液中一次性加入在meoh中的hcl(0.5ml,2.000mmol)。在20℃下,攪拌反應混合物1小時。然后,濃縮溶液。通過制備hplc(柱∶asbc18150*25mm/流動相a∶水+0.1%hcl)/流動相b∶mecn/流速:25ml/min/運行時間∶15min/梯度分布描述:40-70(b%))純化殘余物,得到黃色固體的1-(4-氯-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲鹽酸鹽(35.11mg,0.069mmol,產率78%)。tlc(dcm/meoh=5:1,rf=0.4).1hnmr(400mhz,cd3od)δ9.11(s,1h),8.11(d,j=2.2hz,1h),8.03(d,j=2.4hz,1h),7.86(d,j=2.0hz,1h),7.64(dd,j=2.4,8.8hz,1h),7.52(d,j=8.8hz,1h),4.16(q,j=7.0hz,2h),2.59(s,3h),1.48(t,j=7.1hz,3h);es-lcmsm/z467.9(m+h)。
實施例61:2-(4-(3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙酰胺
步驟1:2-(4-(3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙酰胺
在20℃下,在n2下攪拌的2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(0.2g,0.506mmol)在二噁烷(5ml)中的溶液中一次性加入et3n(0.106ml,0.759mmol)和dppa(0.167g,0.607mmol)。在室溫下,攪拌反應混合物30分鐘。向該混合物中加入2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙酰胺(0.125g,0.506mmol)在1ml的1,4-二噁烷中的溶液。將反應溶液加熱至100℃3小時,同時攪拌。在真空中濃縮該溶液,并通過制備tlc(dcm/meoh=10:1,rf=0.5)純化殘余物,得到淺黃色固體的2-(4-(3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙酰胺(25mg,0.039mmol,產率7.74%):1hnmr(400mhz,cd3od)δ9.17(s,1h),8.27(s,1h),7.93-7.92(m,1h),7.77(s,1h),7.66(s,1h),7.40-7.37(m,2h),6.93-6.90(m,2h),6.48(s,1h),5.31(s,2h),4.14-4.12(m,2h),3.77(s,3h),2.56(s,3h),1.61(s,6h),1.37-1.35(m,3h);es-lcmsm/z639.2(m+h)。
步驟2:2-(4-(3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙酰胺
向在20℃下,在n2下攪拌的2-(4-(3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙酰胺(25mg,0.039mmol)在dcm(3ml)中的溶液中一次性加入在meoh中的hcl(0.5ml,2.000mmol)。在20℃下,攪拌反應混合物1小時。然后,濃縮溶液。通過制備hplc(儀器∶dc/柱:asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:20-50(b%))純化殘余物,得到黃白色固體的2-(4-(3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙酰胺鹽酸鹽(9.34mg,0.017mmol,產率43.0%)。tlc(dcm/meoh=5:1,rf=0.4):1hnmr(400mhz,cd3od)δ9.53(s,1h),8.40(s,1h),7.98(s,1h),7.68(s,2h),6.15(s,1h),4.35(q,j=6.9hz,2h),2.76(s,3h),1.62(s,6h),1.48(t,j=7.1hz,3h)es-lcmsm/z519.1(m+h)。
實施例62:1-(5'-乙氧基-4-甲基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
步驟1:5-溴-2-異氰酰基-4-甲基吡啶
向在20℃下,在n2下攪拌的5-溴-4-甲基吡啶-2-胺(500mg,2.67mmol)在thf(6ml)中的溶液中一次性加入三光氣(278mg,0.936mmol)。在60℃下,攪拌反應混合物2小時。步驟2:1-(5-溴-4-甲基吡啶-2-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向在40℃下,在n2下攪拌的4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯胺(453mg,1.831mmol)、dmap(11.18mg,0.092mmol)和et3n(0.765ml,5.49mmol)在thf(8ml)中的溶液中一次性加入5-溴-2-異氰酰基-4-甲基吡啶(500mg,1.831mmol)。在40℃下,攪拌反應混合物1小時。在真空中濃縮該溶液,并通過制備hplc(mecn/h2o作為洗脫液,酸性條件)純化殘余物,得到黃色固體的1-(5-溴-4-甲基吡啶-2-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(500mg,0.880mmol,產率48.1%):1hnmr(400mhz,dmso-d6)δ9.92(s,1h),9.38(s,1h),8.32(s,1h),7.91(d,j=2.8hz,1h),7.62(s,1h),7.52-7.49(m,1h),6.70(d,j=8.8hz,1h),4.73(d,j=6.8hz,2h),4.58(d,j=7.2hz,2h),2.31(s,3h),1.63(s,3h);es-lcmsm/z(m+h)459.8,461.9。
步驟3:1-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-4-甲基-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
向在20℃下,在n2下攪拌的3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(126mg,0.326mmol)、1-(5-溴-4-甲基吡啶-2-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(150mg,0.326mmol)和cs2co3(265mg,0.815mmol)在dmf(12ml)中的溶液中一次性加入pdcl2(dppf)(11.92mg,0.016mmol)。將反應容器密封,并在cemdiscover中使用初始100w加熱至130℃30分鐘。在冷卻之后,在真空中濃縮反應物,并通過tlc(dcm:meoh=10:1,rf=0.7)純化殘余物,得到黃白色固體的1-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-4-甲基-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(70mg,0.068mmol,產率20.85%):1hnmr(400mhz,cdcl3)δ8.13(br,1h),8.02(s,1h),7.79(d,j=2.0hz,1h),7.52-7.59(m,2h),7.41-7.39(m,2h),6.92(d,j=2.0hz,1h),6.86-6.84(m,2h),6.68(s,1h),6.38(d,j=9.2hz,1h),5.39(s,2h),4.92(d,j=6.8hz,2h),4.52(d,j=7.2hz,2h),4.06-4.01(m,2h),3.42(s,3h),2.22(s,3h),1.68(s,3h),1.39(t,j=7.0hz,3h);es-lcmsm/z639.2(m+h)。
步驟4:1-(5'-乙氧基-4-甲基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲
在室溫下,向化合物1-(5'-乙氧基-6'-((4-甲氧基芐基)氧基)-4-甲基-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(70mg,0.110mmol)中加入在dcm中的tfa(3ml,4.46mmol)。在20℃下,攪拌反應混合物1小時。然后,將溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過制備hplc(mecn/h2o作為洗脫液,堿性條件)純化殘余物,得到白色固體的1-(5'-乙氧基-4-甲基-6'-氧代-1',6'-二氫-[3,3'-聯吡啶]-6-基)-3-(4-((3-甲基氧雜環丁烷-3-基)氧基)-3-(三氟甲基)苯基)脲(26mg,0.049mmol,產率44.8%)。tlc(dcm/meoh=10:1,rf0.3):1hnmr(400mhz,cdcl3)δ8.07(s,1h),7.75-7.70(m,3h),6.95(s,1h),6.70-6.67(m,2h),6.44(d,j=8.8hz,1h),4.98(d,j=6.8hz,2h),4.58(d,j=6.8hz,2h),4.09-4.04(m,2h),2.30(s,3h),1.74(s,3h),1.53(t,j=7.2hz,3h);es-lcmsm/z519.2(m+h)。
實施例63:2-(4-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙酰胺
步驟1:2-(4-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙酰胺
向在20℃下,在n2氣氛下攪拌的2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(0.2g,0.506mmol)在1,4-二噁烷(4ml)中的溶液中一次性加入et3n(0.106ml,0.759mmol)和dppa(0.167g,0.607mmol)。攪拌反應混合物15分鐘。向該混合物中加入2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙酰胺(0.125g,0.506mmol)在1ml的1,4-二噁烷中的溶液,并加熱至100℃2小時。在旋轉蒸發器上除去溶劑。通過制備tlc(dcm∶meoh=10:1,rf=0.5)純化殘余物,得到黃色固體的2-(4-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙酰胺(0.15g,0.235mmol,產率46.4%):1hnmr(400mhz,cd3od)δ9.05(s,1h)8.63(s,1h),8.00(s,1h),7.63(s,1h),7.58-7.53(m,2h),7.42-7.40(m,2h),6.94-6.92(m,2h),5.38(s,2h),4.15-4.11(m,2h),3.78(s,3h),2.50(s,3h),1.47(s,6h),1.35-1.33(m,3h);lcmsm/z:639.8(m+h)。
步驟2:2-(4-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙酰胺
向在20℃下,在n2氣氛下攪拌的2-(4-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙酰胺(150mg,0.235mmol)在dcm(5ml)中的溶液中一次性加入在meoh中的hcl(0.5ml,2.000mmol)。在20℃下,攪拌反應混合物1小時。然后,濃縮溶液。通過制備hplc(儀器∶dc/柱∶asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:17-47(b%))純化殘余物,得到黃白色固體的2-(4-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙酰胺鹽酸鹽(69.57mg,0.121mmol,產率51.6%)。tlc(dcm/meoh=5:1,rf=0.4):1hnmr(400mhz,cd3od)δ9.26(s,1h),8.19(d,j=2.0hz,1h),7.95(s,1h),7.88(d,j=2.0hz,1h),7.67(s,2h),4.19(q,j=6.9hz,2h),2.66(s,3h),1.62(s,6h),1.50(t,j=6.9hz,3h);es-lcmsm/z519.1(m+h)。
實施例64:1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲
步驟1:2-(3-氟-4-異氰酰基(isocyanato)苯基)-4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷(dioxaborolane)
向2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯胺(450mg,1.898mmol)在thf(10ml)中的混合物中加入三光氣(225mg,0.759mmol)。在60℃下,攪拌該混合物1小時。lcms顯示反應完成。將該混合物濃縮,得到2-(3-氟-4-異氰酰基苯基)-4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷(478mg,1.733mmol,產率91%)。
步驟2:3-(4-(3-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯
向2-(3-氟-4-異氰酰基苯基)-4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷(415mg,1.578mmol)在thf(20ml)中的混合物中加入et3n(0.440ml,3.16mmol)和3-(4-氨基-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯(456mg,1.578mmol)。在60℃下,攪拌該混合物12小時。lcms顯示反應完成。在真空中濃縮該混合物,并通過柱(pe/ea=3:1,rf0.2)純化殘余物,得到3-(4-(3-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯(857mg,1.341mmol,產率85%)。1hnmr(400mhz,cdcl3)8.18(d,j=8.0hz,1h),7.67(d,j=2.0hz,1h),7.54(d,j=4.4hz,1h),7.48-7.45(m,1h),7.20(d,j=2.8hz,1h),7.12(d,j=8.8hz,1h),4.22-4.16(m,2h),3.08(s,2h),1.32(s,12h),1.29-1.25(m,3h);1.23(s,6h),es-lcmsm/z553.1(m+h)。
步驟3:3-(4-(3-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸酯
在n2下,向3-(4-(3-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸酯(150mg,0.272mmol)在1,4-二噁烷(3ml)和水(1ml)中的混合物中加入5-溴-3-乙氧基-2-((4-甲氧基芐基)氧基)吡啶(100mg,0.296mmol)、pdcl2(dppf)(19.87mg,0.027mmol)和cs2co3(177mg,0.543mmol)。在微波照射下,在110℃下,攪拌該混合物30分鐘。lcms顯示反應完成。過濾該混合物,在真空中濃縮濾液,并通過tlc純化殘余物,得到3-(4-(3-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯(104mg,0.133mmol,產率49.1%)。1hnmr(400mhz,cdcl3)8.11-8.05(m,1h),7.85(d,j=6.4hz,2h),7.65-7.60(m,1h),7.37-7.34(m,4h),7.17(d,j=8.4hz,2h),6.88-6.85(m,2h),5.46(s,2h),4.15-4.09(m,4h),3.76(s,3h),3.05(s,2h),1.40-1.39(m,3h),1.38-1.37(m,3h),1.25(s,6h);es-lcmsm/z564.2(m-pmb+h)。
步驟4:1-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲
在n2下,向3-(4-(3-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)脲基)-2-(三氟甲基)苯基)-2,2-二甲基丙酸乙酯(80mg,0.117mmol)在thf(10ml)中的混合物中加入lah(4.44mg,0.117mmol)。在20℃下,在h2下,攪拌該混合物1小時。lcms顯示反應完成。在真空中濃縮該混合物,并通過tlc(pe/ea=2:1,rf0.2)純化殘余物,得到1-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲(30mg,0.042mmol,產率35.8%)。1hnmr(400mhz,cdcl3)8.11-8.07(m,1h),7.80(d,j=2.0hz,1h),7.56(d,j=7.6hz,2h),7.37-7.32(m,3h),7.18-7.14(m,2h),7.11-7.10(m,1h),6.99-6.77(m,2h),5.36(s,2h),4.07-4.02(m,2h),3.70(s,3h),3.66(d,j=8.0hz,2h),3.00(s,2h),1.38-1.34(m,3h),1.22(s,6h);es-lcmsm/z522.0(m-pmb+h)。
步驟5:1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲
在n2下,向1-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲(30mg,0.047mmol)在meoh(5ml)中的混合物中加入pd/c(4.98mg,0.047mmol)。在20℃下,在h2下,攪拌該混合物1小時。lcms顯示反應完成。在真空中濃縮該混合物,并通過制備hplc純化殘余物,得到1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-(3-羥基-2,2-二甲基丙基)-3-(三氟甲基)苯基)脲(2.79mg,5.26μmol,產率11.24%):1hnmr(400mhz,cd3od)8.15-8.13(m,1h),7.84(d,j=2.0hz,1h),7.54(d,j=2.4hz,1h),7.39-7.35(m,3h),7.32-7.25(m,2h),4.14(d,j=7.2hz,2h),3.34(s,2h),2.76(s,2h),1.48(d,j=6.8hz,3h),0.84(s,6h);es-lcmsm/z522.2(m+h)。
實施例65:1-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)-3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲
步驟1:4-((1-甲基-1h-吡唑-4-基)甲基)-3-(三氟甲基)苯胺
在微波下,將5-溴吡啶-2-胺(2g,11.56mmol)、(4-硝基苯基)硼酸(1.930g,11.56mmol)、pdcl2(dppf)(0.423g,0.578mmol)、cs2co3(7.53g,23.12mmol)在1,4-二噁烷(30ml)和水(5ml)中的混合物加熱至100℃1小時。然后,濃縮該混合物,得到殘余物,將其用dcm(20ml×2)萃取,經na2so4干燥,濃縮,得到殘余物,經由柱色譜純化,得到5-(4-硝基苯基)吡啶-2-胺(1g,4.65mmol,產率40.2%);es-lcmsm/z216.1(m+1)。
步驟2:5-(4-硝基苯基)吡啶-2(1h)-酮
在0℃下,向5-(4-硝基苯基)吡啶-2-胺(1g,4.65mmol)在h2so4(33.2ml,3.5m,116mmol)中的混合物中加入nano2(20.10ml,2m,40.2mmol)。在攪拌該混合物2小時之后,將該混合物傾入到冰水中,并用dcm(200ml×2)萃取,經na2so4干燥,濃縮,得到5-(4-硝基苯基)吡啶-2(1h)-酮(800mg,3.70mmol,產率80%):1hnmr(400mhz,cd3od)δ8.30-8.27(dd,j=8.8,2.8hz,2h),8.02(dd,j=9.2,2.8hz,1h),7.89(m,1h),7.80-7.77(m,2h),6.68-6.65(m,1h);es-lcmsm/z217.1(m+h)。
步驟3:1-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)-3-(4-((1-甲基-1h-吡唑-4-基)甲基)-3-(三氟甲基)苯基)脲
向4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯胺(80mg,0.278mmol)在thf(10ml)中的混合物中加入三光氣(27.3mg,0.092mmol),然后將混合物加熱至70℃30分鐘,濃縮該混合物,得到1-乙基-4-(4-異氰酰基-2-(三氟甲基)芐基)哌嗪(84mg,0.268mmol,產率96%)。
步驟4:5-(4-氨基苯基)吡啶-2(1h)-酮
在h2氣氛下,于20psi下攪拌5-(4-硝基苯基)吡啶-2(1h)-酮(800mg,3.70mmol)、鎳(21.72mg,0.370mmol)在meoh(20ml)中的混合物過夜。然后,過濾該混合物,并濃縮濾液,得到5-(4-氨基苯基)吡啶-2(1h)-酮(400mg,2.148mmol,產率58.1%):1hnmr(400mhz,cd3od)δ7.88-7.85(dd,j=8.8,2.8hz,1h),7.58-7.57(d,j=2.8hz,1h),7.25(d,j=8.4hz,1h),6.79-6.77(d,j=2.0hz,1h),6.62-6.59(d,j=10.2hz,1h);es-lcmsm/z187.1(m+h)。
步驟5:1-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)-3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲
攪拌5-(4-氨基苯基)吡啶-2-醇(50mg,0.269mmol)、5-(4-氨基苯基)吡啶-2-醇(50mg,0.269mmol)、et3n(0.075ml,0.537mmol)在thf(10ml)中的混合物過夜。然后,濃縮該混合物,得到殘余物,通過制備hplc純化,得到1-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)-3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲二鹽酸鹽(119.55mg,0.209mmol,產率78%):1hnmr(400mhz,cd3od)δ8.60(dd,j=9.2,2.4hz,1h),8.41-8.40(d,j=2.0hz,1h),8.17-8.16(d,j=2.0hz,1h),8.05-8.03(m,1h),7.85-7.83(m,1h),7.66(s,4h),7.32-7.29(m,1h),4.64(m,2h),3.88-3.70(m,8h),3.40-3.34(m,2h),1.43(t,j=7.20hz,3h);es-lcmsm/z500.1(m+h)。
實施例66:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(1-(羥基甲基)環丙基)-3-(三氟甲基)苯基)脲鹽酸鹽
步驟1:1-(2-(三氟甲基)苯基)環丙腈
將2-(2-(三氟甲基)苯基)乙腈(7g,37.8mmol)、n-芐基-n,n-二乙基乙烷氯化銨(0.172g,0.756mmol)、1-溴-2-氯乙烷(8.13g,56.7mmol)的溶液加熱至50℃。然后,在50℃下,向上述混合物中分批加入在水(10ml)中的naoh(9.07g,227mmol),在該溫度下攪拌得到的混合物16小時。將該混合物冷卻至25℃,傾入150ml的水中,用dcm(150ml×2)萃取。將合并的有機層用鹽水(100ml)洗滌,經無水na2so4干燥,過濾并在減壓下濃縮,得到1-(2-(三氟甲基)苯基)環丙腈(8g,36.0mmol,產率95%):1hnmr(400mhz,meod-d4)δ7.76(d,j=7.7hz,1h),7.66(q,j=7.7hz,2h),7.60-7.54(m,1h),1.77-1.73(m,2h),1.52-1.47(m,2h);es-lcmsm/z212(m+1)。
步驟2:1-(4-硝基-2-(三氟甲基)苯基)環丙腈
在0℃下,向1-(2-(三氟甲基)苯基)環丙腈(8.5g,40.2mmol)在h2so4(40ml)中的溶液中分批加入硝基過酸鉀(4.07g,40.2mmol),在該溫度下攪拌得到的混合物20分鐘。將該混合物傾倒入100ml的冰/水中,用dcm(100ml×2)萃取。將合并的有機層用鹽水(50ml)洗滌,經無水na2so4干燥,過濾并在減壓下濃縮,得到1-(4-硝基-2-(三氟甲基)苯基)環丙腈(9g,26.0mmol,產率64.6%):1hnmr(400mhz,meod-d4)δ8.57(d,j=2.2hz,1h),8.49(dd,j=2.3,8.5hz,1h),7.99(d,j=8.6hz,1h),1.89-1.82(m,2h),1.63-1.57(m,2h)。
步驟3:1-(4-硝基-2-(三氟甲基)苯基)環丙烷甲醛
在-78℃下,向1-(4-硝基-2-(三氟甲基)苯基)環丙腈(8g,31.2mmol)在dcm(100ml)中的溶液中分批加入dibal-h,在該溫度下攪拌得到的混合物2小時。將該混合物傾入50ml的2nhcl溶液中,用dcm(150ml×2)萃取。將合并的有機層用鹽水(50ml)洗滌,經無水na2so4干燥,過濾并在減壓下濃縮,得到1-(4-硝基-2-(三氟甲基)苯基)環丙烷甲醛(8g,24.69mmol,產率79%):1hnmr(400mhz,meod-d4)δ8.85(s,1h),8.54(d,j=2.2hz,1h),8.45(dd,j=2.3,8.5hz,1h),7.77(d,j=8.6hz,1h),1.84-1.77(m,2h),1.65-1.56(m,2h);es-lcmsm/z202(m+1)。
步驟4:1-(4-氨基-2-(三氟甲基)苯基)環丙烷甲醛
在25℃下,在h2氣氛下,攪拌1-(4-硝基-2-(三氟甲基)苯基)環丙烷甲醛(8g,30.9mmol)、pd/c(3.28g,30.9mmol)在meoh(100ml)中的混合物2小時。然后,過濾該混合物,濃縮濾液,并通過硅膠柱色譜(20%ea:80%pe,80g硅膠柱)純化。將通過tlc(ea:pe=1:2,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的1-(4-氨基-2-(三氟甲基)苯基)環丙烷甲醛(3.5g,12.22mmol,產率39.6%):1hnmr(400mhz,meod-d4)δ9.01(s,1h),7.14(d,j=8.4hz,1h),7.02-6.96(m,1h),6.82(dd,j=2.1,8.3hz,1h),1.58(br.s.,2h),1.38(d,j=2.9hz,2h);es-lcmsm/z230(m+1)。
步驟5:(1-(4-氨基-2-(三氟甲基)苯基)環丙基)甲醇
在25℃下,向1-(4-氨基-2-(三氟甲基)苯基)環丙烷甲醛(4g,17.45mmol)在meoh(50ml)中的溶液中分批加入nabh4(1.321g,34.9mmol),在該溫度下攪拌得到的混合物2小時。濃縮該混合物,加入20ml的水,用dcm(50ml×2)萃取。將合并的有機層用鹽水(50ml)洗滌,經無水na2so4干燥,過濾并在減壓下濃縮,得到(1-(4-氨基-2-(三氟甲基)苯基)環丙基)甲醇(3.1g,12.07mmol,產率69.1%):1hnmr(400mhz,meod-d4)δ7.29(d,j=8.4hz,1h),6.93(d,j=2.4hz,1h),6.79(dd,j=2.2,8.4hz,1h),3.49(br.s.,2h),0.90-0.83(m,2h),0.80-0.73(m,2h);es-lcmsm/z232(m+1)。
步驟6:4-(1-(((叔丁基二甲基甲硅烷基)氧基)甲基)環丙基)-3-(三氟甲基)苯胺
在25℃下,向(1-(4-氨基-2-(三氟甲基)苯基)環丙基)甲醇(2.1g,9.08mmol)、1h-咪唑(1.546g,22.71mmol)在dcm(30ml)中的溶液中加入tbscl(1.506g,9.99mmol)。在該溫度下,攪拌得到的混合物2小時。將該混合物傾倒入50ml的水中,用dcm(50ml×2)萃取。將合并的有機層用鹽水(50ml)洗滌,經無水na2so4干燥,過濾并在減壓下濃縮,得到殘余物,通過硅膠柱色譜(20%ea:80%pe,24g硅膠柱)純化所述殘余物。將通過tlc(ea∶pe=1:2,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到淺黃色油狀物的4-(1-(((叔丁基二甲基甲硅烷基)氧基)甲基)環丙基)-3-(三氟甲基)苯胺(2.5g,6.51mmol,產率71.7%):1hnmr(400mhz,meod-d4)δ7.41(d,j=8.4hz,1h),7.07(d,j=2.2hz,1h),6.93(dd,j=2.2,8.4hz,1h),3.72(br.s.,2h),1.02-0.99(m,2h),0.96(s,9h),0.89(s,2h),0.00(s,6h);es-lcmsm/z346(m+1)。
步驟7:1-(4-(1-(((叔丁基二甲基甲硅烷基)氧基)甲基)環丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
在25℃下,向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(100mg,0.253mmol)、et3n(0.053ml,0.379mmol)在1,4-二噁烷(10ml)中的溶液中分批加入dppa(77mg,0.278mmol),在該溫度下,攪拌得到的混合物20分鐘。向上述混合物中加入4-(1-(((叔丁基二甲基甲硅烷基)氧基)甲基)環丙基)-3-(三氟甲基)苯胺(96mg,0.278mmol),并加熱至100℃2小時。將該混合物傾倒入20ml的水中,用dcm(50ml×2)萃取。將有機相用鹽水洗滌,經na2so4干燥,過濾并濃縮。通過制備tlc(dcm∶meoh=20:1,rf=0.5)純化殘余物,得到白色固體的1-(4-(1-(((叔丁基二甲基甲硅烷基)氧基)甲基)環丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(50.0mg,0.047mmol,產率18.8%):1hnmr(400mhz,meod-d4)δ9.16(s,1h),8.19(d,j=2.0hz,1h),7.99(d,j=2.0hz,2h),7.68-7.64(m,1h),7.54(d,j=8.6hz,1h),7.38(d,j=8.6hz,2h),7.00(d,j=8.6hz,2h),4.30-4.24(m,2h),3.91-3.88(m,3h),3.75(br.s.,2h),2.68(s,3h),1.61(t,j=7.1hz,3h),0.95(s,9h),0.00(s,6h);es-lcmsm/z738(m+1)。
步驟8:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(1-(羥基甲基)環丙基)-3-(三氟甲基)苯基)脲鹽酸鹽
攪拌在tfa中的1-(4-(1-(((叔丁基二甲基甲硅烷基)氧基)甲基)環丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(50mg,0.068mmol)在dcm(20%,10ml)中的溶液30分鐘。然后,濃縮該溶液,并通過制備hplc(儀器∶dc/柱∶geminic18150*25mm*10ul/流動相a∶水(水+0.1%hcl)/流動相b∶mecn/梯度∶30-60(b%)/流速:25ml/min/運行時間∶15min)純化殘余物,得到白色固體的1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(1-(羥基甲基)環丙基)-3-(三氟甲基)苯基)脲鹽酸鹽(6.71mg,0.012mmol,產率18.2%):1hnmr(400mhz,meod-d4)δ9.09(s,1h),8.10(d,j=2.0hz,1h),7.86(d,j=2.2hz,2h),7.60-7.52(m,2h),4.16(q,j=6.9hz,2h),3.54(br.s.,2h),2.58(s,3h),1.48(t,j=6.9hz,3h),0.94(s,2h),0.87(br.s.,2h);es-lcmsm/z504.1(m+h)。
實施例67:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(5-甲基-1,3,4-噁二唑-2-基)-5-(三氟甲基)苯基)脲
步驟1:1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(5-甲基-1,3,4-噁二唑-2-基)-5-(三氟甲基)苯基)脲
在25℃下,向2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(100mg,0.253mmol)、et3n(0.053ml,0.379mmol)在1,4-二噁烷(10ml)中的溶液中分批加入dppa(77mg,0.278mmol),在該溫度下,攪拌得到的混合物20分鐘。將3-(5-甲基-1,3,4-噁二唑-2-基)-5-(三氟甲基)苯胺(67.7mg,0.278mmol)加入到上述混合物中,并加熱至100℃2小時。將該混合物傾倒入20ml的水中,用dcm(50ml×2)萃取。將有機萃取物用鹽水洗滌,經na2so4干燥,過濾并濃縮。通過制備tlc(dcm:meoh=20:1,rf=0.5)純化殘余物,得到白色固體的1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(5-甲基-1,3,4-噁二唑-2-基)-5-(三氟甲基)苯基)脲(20mg,0.031mmol,產率12.4%):1hnmr(400mhz,meod-d4)δ9.17(s,1h),8.39(s,1h),7.94-7.91(m,1h),7.79(s,1h),7.55(s,1h),7.26(s,2h),6.88(s,2h),5.97-5.94(m,1h),5.29(d,j=12.7hz,2h),4.07(d,j=6.8hz,3h),3.76(s,3h),2.64(s,3h),2.38(s,3h),1.37-1.33(m,3h);es-lcmsm/z738(m+1).
步驟2:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(5-甲基-1,3,4-噁二唑-2-基)-5-(三氟甲基)苯基)脲
在25℃下,在h2氣氣氛下,攪拌1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(5-甲基-1,3,4-噁二唑-2-基)-5-(三氟甲基)苯基)脲(25mg,0.039mmol)、pd/c(4.19mg,0.039mmol)在meoh(10ml)中的混合物2小時。然后,過濾該混合物,并濃縮濾液,得到殘余物,通過制備hplc(儀器∶gilson215/柱∶geminic1810u150*25mm/流動相a∶水(0.01mol/l(nh4)hco3)/流動相b∶mecn(neutral)/梯度∶20-50(b%)/流速:25ml/min)純化,得到1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(3-(5-甲基-1,3,4-噁二唑-2-基)-5-(三氟甲基)苯基)脲(4.08mg,7.64μmol,產率19.4%):1hnmr(400mhz,dmso-d6)δ11.44-11.33(m,1h),9.85(s,1h),8.93(s,1h),8.53(s,1h),8.36(s,1h),8.04(s,1h),7.78(s,1h),7.64(s,1h),5.76(s,1h),4.01(q,j=6.8hz,2h),2.58(s,3h),2.44(s,3h),1.25(t,j=7.0hz,3h);es-lcmsm/z515.8(m+h)。
實施例68:1-(3-(叔丁基)-1-苯基-1h-吡唑-5-基)-3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲
步驟1:3-(4-異氰酰基-2-(三氟甲基)苯氧基)-3-甲基氧雜環丁烷
在0℃下,向3-(叔丁基)-1-苯基-1h-吡唑-5-胺(100mg,0.464mmol)、nahco3(195mg,2.322mmol)在dcm(10ml)和h2o(10ml)中的混合物中加入三光氣(45.5mg,0.153mmol)。在攪拌該混合物30分鐘之后,將該混合物用dcm(20ml×2)萃取,經na2so4干燥,濃縮,得到3-(叔丁基)-5-異氰酰基-1-苯基-1h-吡唑(40mg,0.166mmol,產率35.7%)。
步驟2:1-(3-(叔丁基)-1-苯基-1h-吡唑-5-基)-3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲
向5-(4-氨基苯基)吡啶-2(1h)-酮(30.9mg,0.166mmol)和3-(叔丁基)-5-異氰酰基-1-苯基-1h-吡唑(40mg,0.166mmol)在thf(15ml)中的混合物中加入et3n(0.046ml,0.332mmol)。然后,將該混合物加熱至60℃60分鐘,接著,濃縮該混合物,得到殘余物,通過制備hplc純化,得到1-(3-(叔丁基)-1-苯基-1h-吡唑-5-基)-3-(4-(6-氧代-1,6-二氫吡啶-3-基)苯基)脲(15.87mg,0.037mmol,產率22.4%):1hnmr(400mhz,cd3od)δ8.31-8.28(dd,j=9.20,2.80hz,1h),8.08-8.07(d,j=2.80hz,1h),7.75-7.73(m,3h),7.70-7.68(m,2h),7.57(m,4h),7.02-7.00(m,1h),6.90(s,1h),1.45(s,9h);.es-lcmsm/z428.2(m+h)。
實施例69:1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲
步驟1:1-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)-3-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)脲
向2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯胺(500mg,2.109mmol)在thf(50ml)中的溶液中加入三光氣(219mg,0.738mmol)。在70℃下,攪拌得到的混合物。在30分鐘之后,lcms分析顯示起始物質消失。在真空下除去溶劑,得到2-(3-氟-4-異氰酰基苯基)-4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷(520mg,1.977mmol,產率94%)。在70℃下,向4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯胺(568mg,1.977mmol)、et3n(0.827ml,5.93mmol)和dmap(24.15mg,0.198mmol)在thf(50ml)中的溶液中加入2-(3-氟-4-異氰酰基苯基)-4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷(520mg,1.977mmol)。在70℃下,攪拌得到的混合物。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物溶于dcm(100ml)中,并用h2o(30ml)和鹽水(30ml)洗滌。經na2so4干燥有機層,過濾并濃縮。通過柱色譜(dcm/meoh=20/1)純化殘余物,得到1-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)-3-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)脲(0.67g,0.851mmol,產率43.0%):1hnmr(400mhz,cd3od)δ8.17-8.14(m,1h),7.86(s,1h),7.69-7.67(m,1h),7.60(d,j=8.4hz,1h),7.49(d,j=8.0hz,1h),7.41(d,j=11.2hz,1h),4.59(s,2h),3.60(s,2h),2.52-2.47(m,8h),1.33(s,12h),1.10(t,j=7.2hz,3h);es-lcmsm/zm/z551.2(m+h)。
步驟2:1-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲
在n2氣氛下,在110℃下,攪拌1-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)-3-(2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基)脲(0.67g,1.217mmol)、5-溴-3-乙氧基-2-((4-甲氧基芐基)氧基)吡啶(0.412g,1.217mmol)、pdcl2(dppf)-dcm加合物(0.099g,0.122mmol)和cs2co3(0.793g,2.435mmol)在1,4-二噁烷(12ml)和水(4ml)中的溶液過夜。在lcms分析顯示起始物質消失之后。在真空下除去溶劑。將殘余物溶于ea(120ml)中,并用h2o(40ml)和鹽水(40ml)洗滌。經na2so4干燥有機層,過濾并濃縮。通過硅膠柱色譜(dcm/meoh=30/1至20/1)純化殘余物。將通過tlc(dcm/meoh=10/1)發現包含產物的所有級分合并,并濃縮,得到褐色固體的1-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲(0.53g,0.638mmol,產率52.4%):1hnmr(400mhz,cd3od)δ8.17(m,1h),7.91-7.89(m,2h),7.68(d,j=8.4hz,1h),7.61(m,1h),7.44-7.38(m,5h),6.90(d,j=8.8hz,1h),5.35(s,2h),4.17-4.11(s,2h),3.70(s,3h),3.67-3.65(m,2h),2.53-2.44(m,8h),1.41(t,j=7.0hz,3h),1.12-1.08(m,3h);es-lcmsm/z682.2(m+h)。
步驟3:1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲
在25℃下,攪拌在hcl中的1-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲(0.53g,0.777mmol)在meoh(10mll)中的溶液。在lcms分析顯示起始物質消失之后。在真空下除去溶劑,并通過制備hplc純化殘余物,得到黃色固體的1-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲二鹽酸鹽(293.81mg,0.459mmol,產率59.0%):1hnmr(400mhz,cd3od)δ8.18(t,j=8.4hz,1h),8.02(s,1h),7.82(m,1h),7.73(m,1h),7.49-7.41(m,4h),4.24-4.18(m,4h),3.76-3.25(m,8h),3.12(m,2h),1.49(t,j=7.0hz,3h),1.37(t,j=7.2hz,3h);es-lcmsm/z562.1(m+h)。
實施例70:1-(4-(1-氨基-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲二鹽酸鹽
步驟1:(2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙基)氨基甲酸叔丁酯
向2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙腈(2g,8.76mmol)在meoh(20ml)中的懸浮液中加入boc2o(2.238ml,9.64mmol)和阮內鎳(0.514g,8.76mmol,在h2o中50%)。在28℃下,在h2氣氛(15psi)下氫化該混合物16小時。然后,將溶液過濾,濃縮并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=5:1,硅膠=3g)純化殘余物。將通過tlc(pe/ea=5:1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的(2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙基)氨基甲酸叔丁酯(2.1g,6.09mmol,產率69.5%):1hnmr(400mhz,cdcl3)δ7.35-7.33(d,j=8.4hz,1h),7.06(d,j=2.8hz,1h),6.79-6.77(d,j=8.4hz,1h),3.78(br.s.,2h),3.43-3.42(d,j=6.4hz,2h),1.40(s,15h);es-lcmsm/z355.1(m+23h)。
步驟2:(2-(4-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙基)氨基甲酸叔丁酯
向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(300mg,0.759mmol)和(2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙基)氨基甲酸叔丁酯(252mg,0.759mmol)在1,4-二噁烷(10ml)中的溶液中加入et3n(0.317ml,2.276mmol)和dppa(313mg,1.138mmol)。在70℃下,攪拌該混合物12小時。然后,濃縮該溶液,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過制備tlc(pe/ea=1:1,rf=0.5)純化殘余物,得到淺黃色固體的(2-(4-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙基)氨基甲酸叔丁酯(125mg,0.138mmol,產率18.19%):1hnmr(400mhz,cd3od)δ9.12(s,1h),8.67(s,1h),8.10-8.06(m,1h),7.91(s,1h),7.64-7.58(m,2h),7.42-7.40(d,j=8.4hz,2h),6.93-6.91(d,j=8.4hz,2h),5.38(s,2h),4.19-4.14(q,j=7.2hz,2h),),3.79(s,3h),3.37(s.,2h),2.57(m,3h),1.52-1.26(m,18h);es-lcmsm/z725.2(m+h)。
步驟3:1-(4-(1-氨基-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲二鹽酸鹽
向(2-(4-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙基)氨基甲酸叔丁酯(125mg,0.172mmol)在dcm(5ml)中的懸浮液中加入tfa(6.64ml,8.62mmol)(在dcm中10%)。在25℃下,攪拌該混合物2小時。然后,將該溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過制備hplc(儀器∶dc/柱:asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:12-42(b%))純化殘余物,得到淺黃色固體的1-(4-(1-氨基-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲二鹽酸鹽(70.82mg,0.122mmol,產率70.6%)。tlc(dcm/meoh=10:1,rf=0.4):1hnmr(400mhz,cd3od)δ9.16(s,1h),8.15-8.14(d,j=2.0hz,1h),8.05(s,1h),7.87(d,j=2.0hz,1h),7.77-7.75(m,1h),7.69-7.67(m,1h),4.20-4.15(q,j=7.2hz,2h),3.33(s,2h),2.63(s,3h),1.58(s,6h),1.52-1.48(t,j=7.2hz,3h);es-lcmsm/z505.2(m+h)。
實施例71:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-羥基丙烷-2-基)-3-(三氟甲基)苯基)脲
步驟1:2-氯-5-異氰酰基-4-甲基嘧啶
向2-氯-4-甲基嘧啶-5-胺(150mg,1.045mmol)在thf(10ml)中的懸浮液中加入三光氣(140mg,0.470mmol)。在60℃下,攪拌混合物1小時。將該混合物冷卻至室溫。然后。濃縮溶液。得到2-氯-5-異氰酰基-4-甲基嘧啶(170mg,1.003mmol,產率96%)。tlc(pe/ea=5:1,rf=0.5);es-lcmsm/z202.0(m+meoh+h)。
步驟2:1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-氯-4-甲基嘧啶-5-基)脲
將1-(4-氨基-2-(三氟甲基)苯基)乙酮(213mg,1.048mmol)在thf(5ml)中的懸浮液加入到2-氯-5-異氰酰基-4-甲基嘧啶(178mg,1.048mmol)在thf(5ml)中的溶液中。加入et3n(0.365ml,2.62mmol)和dmap(12.81mg,0.105mmol),并在將該混合物置于60℃下10小時。將該混合物冷卻至室溫。然后,將溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過制備tlc(pe/ea=5:1,rf=0.6)純化殘余物,得到淺黃色固體的1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-氯-4-甲基嘧啶-5-基)脲(110mg,0.295mmol,產率28.1%):1hnmr(400mhz,cd3od)δ9.06-9.05(d,j=6.0hz,1h),7.98(s,1h),7.79-7.72(m,2h),2.68(s,3h),2.47(s,3h);es-lcmsm/z373.0(m+h)。
步驟3:1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
向1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-氯-4-甲基嘧啶-5-基)脲(110mg,0.295mmol)在dmf(2.4ml)和水(0.800ml)中的溶液中加入3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(114mg,0.295mmol)。加入cs2co3(240mg,0.738mmol)和pdcl2(pph3)2(20.71mg,0.030mmol),并在微波下,將該混合物置于110℃15分鐘。將該混合物冷卻至室溫。然后,將溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過制備tlc(dcm/meoh=10:1,rf=0.5)純化殘余物,得到淺黃色固體的1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(120mg,0.201mmol,產率68.3%):1hnmr(400mhz,cd3od)δ9.10(s,1h),8.66(d,j=1.6hz,1h),8.07(s,1h),7.98-7.96(d,j=8.4hz,1h),7.74-7.62(m,3h),7.41-7.39(d,j=8.4hz,1h),6.91-6.89(d,j=8.4hz,2h),5.37(s,2h),4.18-4.13(q,j=6.8hz,2h),3.78(s,3h),2.59-2.55(m,6h),1.45-1.41(t,j=6.8hz,3h);es-lcmsm/z596.1(m+h)。
步驟4:1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-羥基丙烷-2-基)-3-(三氟甲基)苯基)脲
在0℃下,向1-(4-乙酰基-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(120mg,0.201mmol)在thf(10ml)中的溶液中加入memgbr(3.36ml,10.07mmol)。將該混合物置于0℃下2小時。然后,將溶液用飽和的nh4cl水溶液淬滅,濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過制備tlc(pe/ea=5:1,rf=0.6)純化殘余物,得到淺黃色固體的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-羥基丙烷-2-基)-3-(三氟甲基)苯基)脲(21mg,0.029mmol,產率14.48%):1hnmr(400mhz,cd3od)δ9.09(s,1h),8.66(s,1h),8.08-8.07(d,j=2.0hz,1h),7.88(s,1h),7.65(s,2h),7.41-7.39(d,j=8.8hz,2h),6.92-6.89(d,j=8.8hz,2h),5.38(s,2h),4.18-4.13(q,j=6.8hz,2h),3.78(s,3h),2.57(s,3h),1.59(s6h),1.45-1.41(m,j=6.8hz,3h);es-lcmsm/z612.2(m+h)。
步驟5:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-羥基丙烷-2-基)-3-(三氟甲基)苯基)脲
向1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-羥基丙烷-2-基)-3-(三氟甲基)苯基)脲(21mg,0.034mmol)在meoh(10ml)中的懸浮液中加入pd/c(3.65mg,0.034mmol,10%)。在26℃下,在h2氣氛(15psi)下氫化該混合物2小時。然后,過濾溶液并濃縮。通過制備hplc(mecn/h2o作為洗脫液,酸性條件)純化殘余物,得到白色固體的1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-羥基丙烷-2-基)-3-(三氟甲基)苯基)脲(9.63mg,0.020mmol,產率57.1%)。tlc(dcm/meoh=10:1,rf=0.4):1hnmr(400mhz,dmso-d6)δ9.42(br.s.,1h),8.98(s,1h),8.42(br.s.,1h),7.90-7.88(dd,j=2.0,8.4hz,2h),7.62-7.57(m,3h),5.01(s,1h),4.03-3.98(q,j=6.8hz,2h),2.45(s,3h),1.49(s,6h),1.35-1.32(t,j=6.8hz,3h);es-lcmsm/z492.1(m+h)。
實施例72:1-(3-(1h-1,2,4-三唑-1-基)-5-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲鹽酸鹽
步驟1:2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯胺
向在20℃下,在n2下攪拌的4-溴-2-氟苯胺(40g,211mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-雙(1,3,2-二氧雜硼雜環戊烷)(64.1g,253mmol)和koac(41.3g,421mmol)在1,4-二噁烷(500ml)中的溶液中一次性加入pdcl2(dppf)(7.70g,10.53mmol)。在100℃下,攪拌反應混合物3小時。在真空中濃縮該溶液,得到2-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯胺(44g,158mmol,產率74.9%):1hnmr(400mhz,cdcl3)δ7.46-7.40(m,2h),6.75-6.71(m,1h),1.30(s,j=3.6hz,12h);es-lcmsm/z238.1(m+h)。
步驟2:4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯胺
向5-溴-3-乙氧基-2-((4-甲氧基芐基)氧基)吡啶(5g,14.78mmol)在1,4-二噁烷(30ml)和水(10.0ml)中的混合物中加入5-溴-3-乙氧基-2-((4-甲氧基芐基)氧基)吡啶(5g,14.78mmol)、cs2co3(9.63g,29.6mmol)和pdcl2(dppf)(1.082g,1.478mmol)。在110℃下,在n2下攪拌該混合物16小時。然后,過濾該反應殘余物,并濃縮濾液,通過硅膠柱色譜(pe/ea=8/1)純化。將通過tlc(pe/ea=8/1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到白色固體的4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯胺(4g,9.77mmol,產率66.1%):1hnmr(400mhz,cd3od)δ7.83(d,j=2.0hz,1h),7.40-7.37(m,2h),7.34(d,j=2.0hz,1h),7.24-7.20(m,1h),7.17-7.14(m,1h),6.92-6.89(m,3h),5.33(s,2h),4.15-4.09(m,2h),3.78(s,3h),1.40(t,j=7.2hz,3h);es-lcmsm/z369.1(m+h)。
步驟3:3-乙氧基-5-(3-氟-4-異氰酰基苯基)-2-((4-甲氧基芐基)氧基)吡啶
將4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯胺(193.76mg,0.526mmol)在thf(10ml)中的懸浮液加入到三光氣(70.2mg,0.237mmol)在thf(10ml)中的溶液中。將該混合物置于60℃下5分鐘。將該混合物冷卻至室溫。然后,濃縮溶液。得到3-乙氧基-5-(3-氟-4-異氰酰基苯基)-2-((4-甲氧基芐基)氧基)吡啶(195mg,0.494mmol,產率94%)。tlc(pe/ea=5/1,rf0.5):es-lcmsm/z307.0(m-87h)。
步驟4:1-(3-硝基-5-(三氟甲基)苯基)-1h-1,2,4-三唑
向1-氟-3-硝基-5-(三氟甲基)苯(1g,4.78mmol)在dmf(15ml)中的溶液中加入1h-,2,4-三唑(0.396g,5.74mmol)。加入cs2co3(3.12g,9.56mmol),并將該混合物置于80℃下8小時。將該混合物冷卻至室溫。然后,將溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=5/1)純化殘余物。將通過tlc(pe/ea=1/1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的1-(3-硝基-5-(三氟甲基)苯基)-1h-1,2,4-三唑(690mg,2.67mmol,產率55.9%):1hnmr(400mhz,cd3od)δ9.43(s,1h),9.01(s,1h),8.65(s,1h),8.55(s,1h),8.26(s,1h);es-lcmsm/z259.0(m+h)。
步驟5:3-(1h-1,2,4-三唑-1-基)-5-(三氟甲基)苯胺
向1-(3-硝基-5-(三氟甲基)苯基)-1h-1,2,4-三唑(690mg,2.67mmol)在meoh(10ml)中的懸浮液中加入pd/c(284mg,2.67mmol,10%)。在26℃下,在h2氣氛(15psi)下氫化該混合物2小時。然后,過濾該溶液并濃縮。得到呈白色固體的3-(1h-1,2,4-三唑-1-基)-5-(三氟甲基)苯胺(571mg,2.502mmol,產率94%)。tlc(pe/ea=1/1,rf=0.3):1hnmr(400mhz,cd3od)δ9.06(s,1h),8.13(s,1h),7.26(s,2h),6.93(s,1h);es-lcmsm/z229.1(m+h)。
步驟6:1-(3-(1h-1,2,4-三唑-1-基)-5-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)脲
向3-(1h-1,2,4-三唑-1-基)-5-(三氟甲基)苯胺(100mg,0.438mmol)在thf(10ml)中的懸浮液中加入3-乙氧基-5-(3-氟-4-異氰酰基苯基)-2-((4-甲氧基芐基)氧基)吡啶(208mg,0.526mmol)。加入et3n(0.153ml,1.096mmol)和dmap(5.35mg,0.044mmol),并將混合物置于60℃下10小時。將該混合物冷卻至室溫。然后,將溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過制備tlc(dcm/meoh=20/1,rf=0.4)純化殘余物,得到淺黃色固體的1-(3-(1h-1,2,4-三唑-1-基)-5-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)脲(102mg,0.164mmol,產率37.4%):es-lcmsm/z623.1(m+h)。
步驟7:1-(3-(1h-1,2,4-三唑-1-基)-5-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲鹽酸鹽
向1-(3-(1h-1,2,4-三唑-1-基)-5-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-2-氟苯基)脲(30mg,0.048mmol)在meoh(10ml)中的懸浮液中加入pd/c(10.26mg,0.096mmol,10%)。在26℃下,在h2氣氛(15psi)下氫化該混合物3小時。然后,過濾溶液并濃縮。通過制備hplc(mecn/h2o作為洗脫液,酸性條件)純化,得到黃白色固體的1-(3-(1h-1,2,4-三唑-1-基)-5-(三氟甲基)苯基)-3-(4-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)脲鹽酸鹽(16.88mg,0.031mmol,產率65.0%)。tlc(dcm/meoh=10/1,rf=0.4):1hnmr(400mhz,dmso-d6)δ10.11(s,1h),9.45(s,1h),8.92(s,1h),8.30(s,1h),8.22(s,1h),8.12–8.07(t,j=8.6hz,1h),7.92-7.88(d,j=7.8hz,1h),7.59-7.55(dd,j=12.8,2.0hz,1h),7.42-7.40(dd,j=8.8,2.0hz,1h),7.33-7.32(d,j=2.4hz,1h),7.15-7.14(d,j=2.4hz,1h),4.09-4.04(q,j=6.8hz,2h),1.36-1.33(t,j=6.8hz,3h);es-lcmsm/z503.0(m+h)。
實施例73:1-(4-(1-(二甲基氨基)-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲二鹽酸鹽
步驟1:(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)氨基甲酸叔丁酯
向2-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙腈(2g,8.76mmol)在etoh(20ml)中的懸浮液中加入boc2o(3.05ml,13.15mmol)。在28℃下,攪拌該混合物16小時。然后,將溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=5:1,硅膠=3g)純化殘余物。將通過tlc(pe/ea=5:1,rf=0.6)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)氨基甲酸叔丁酯(2.8g,6.40mmol,產率73.0%):1hnmr(400mhz,cdcl3)δ7.76(s,1h),7.62(s,2h),1.85(s,6h),1.53(s,9h);es-lcmsm/z329.1(m+h)。
步驟2:(4-(1-氨基-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)氨基甲酸叔丁酯
向(4-(2-氰基丙烷-2-基)-3-(三氟甲基)苯基)氨基甲酸叔丁酯(3.18g,9.69mmol)在meoh(20ml)中的懸浮液中加入阮內鎳(1.137g,19.37mmol,在h2o中50%)和nh4oh(10ml)。在28℃下,在40psi的h2氣氛下,氫化該混合物12小時。然后,過濾該溶液并濃縮,得到殘余物。得到(4-(1-氨基-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)氨基甲酸叔丁酯(1.5g,4.39mmol,產率45.3%)。tlc(pe/ea=1:1,rf=0.5):1hnmr(400mhz,cd3od)δ7.92(s,1h),7.67-7.65(d,j=8.4hz,1h),7.60-7.58(d,j=8.8hz,1h),3.17(s,2h),1.57-1.43(m,15h);es-lcmsm/z333.1(m+h)。
步驟3:(4-(1-(二甲基氨基)-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)氨基甲酸叔丁酯
向(4-(1-氨基-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)氨基甲酸叔丁酯(1.5g,4.51mmol)在meoh(15ml)中的懸浮液中加入nabh(oac)3(4.78g,22.57mmol)和甲醛(0.249ml,9.03mmol)。在28℃下,攪拌該混合物5小時。然后,將溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜(pe/ea=1:1,硅膠=2g)純化殘余物。將通過tlc(pe/ea=1:1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的(4-(1-(二甲基氨基)-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)氨基甲酸叔丁酯(1.48g,2.93mmol,產率64.9%):1hnmr(400mhz,cdcl3)δ7.77(s,1h),7.61-7.59(d,j=8.8hz,1h),7.50-7.48(d,j=8.0hz,1h),6.66(s,1h),2.75(s,2h),2.17(s,6h),1.53-1.51(m,15h);es-lcmsm/z361.2(m+h)。
步驟4:4-(1-(二甲基氨基)-2-甲基丙烷-2-基)-3-(三氟甲基)苯胺
將tfa(0.633ml,8.21mmol,在dcm中10%tfa,10ml)加入到(4-(1-(二甲基氨基)-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)氨基甲酸叔丁酯(1.48g,4.11mmol)在dcm(15ml)中的溶液中。將該混合物置于28℃4小時。然后,濃縮溶液,得到殘余物。通過硅膠柱色譜(pe/ea=1:1,硅膠=2g)純化殘余物。將通過tlc(pe/ea=1:1,rf=0.4)發現包含產物的所有級分合并,并濃縮,得到淺黃色固體的4-(1-(二甲基氨基)-2-甲基丙烷-2-基)-3-(三氟甲基)苯胺(700mg,2.313mmol,產率56.3%):1hnmr(400mhz,cdcl3)δ7.44-7.42(d,j=8.8hz,1h),7.04(s,1h),6.77(dd,j=2.4,8.8hz,1h),2.49(s,2h),2.07(s,6h),1.43(s,6h);es-lcmsm/z261.1(m+h)。
步驟5:1-(4-(1-(二甲基氨基)-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(300mg,0.759mmol)和4-(1-(二甲基氨基)-2-甲基丙烷-2-基)-3-(三氟甲基)苯胺(197mg,0.759mmol)在1,4-二噁烷(10ml)中的溶液中加入et3n(0.317ml,2.276mmol)和dppa(313mg,1.138mmol)。在70℃下,攪拌該混合物12小時。然后,將溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過制備tlc(dcm/meoh=10:1,rf=0.5)純化殘余物,得到淺黃色固體的1-(4-(1-(二甲基氨基)-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(150mg,0.129mmol,產率16.96%):1hnmr(400mhz,cd3od)δ8.69(s,1h),7.38-7.35(m,2h),7.27-7.19(m,3h),7.07-7.03(t,j=7.2hz,2h),6.93-6.91(d,j=8.4hz,2h),5.39(s,2h),4.20-4.14(q,j=7.2hz,2h),3.78(s,3h),2.67-2.57(m,11h),1.64(s,6h),1.46-1.43(t,j=7.2hz,3h);es-lcmsm/z653.1(m+h)。
步驟6:1-(4-(1-(二甲基氨基)-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲二鹽酸鹽
向1-(4-(1-(二甲基氨基)-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(150mg,0.230mmol)在meoh(10ml)中的懸浮液中加入pd/c(24.46mg,0.230mmol,10%)。在26℃下,在h2氣氛(15psi)下氫化該混合物6小時。然后,將溶液過濾并濃縮,得到殘余物。通過制備hplc(儀器∶dc/柱:asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:15-45(b%))純化殘余物,得到黃色固體的1-(4-(1-(二甲基氨基)-2-甲基丙烷-2-基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲二鹽酸鹽(52.74mg,0.086mmol,產率37.6%)。tlc(dcm/meoh=10:1,rf=0.4):1hnmr(400mhz,cd3od)δ9.22(s,1h),8.18(d,j=2.0hz,1h),8.12-8.11(d,j=2.0hz,1h),7.89(s,1h),7.79-7.74(m,2h),4.22-4.16(q,j=6.8hz,2h),3.61(s,2h),2.72(s,6h),2.66(s,3h),1.66(s,6h),1.52-1.48(t,j=6.8hz,3h);es-lcmsm/z533.3(m+h)。
實施例74:1-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲二鹽酸鹽
步驟1:n,n-二甲基-2-(3-硝基-5-(三氟甲基)苯氧基)乙胺
向1-氟-3-硝基-5-(三氟甲基)苯(2g,9.56mmol)在dmf(10ml)中的懸浮液中加入2-(二甲基氨基)乙醇(2.56g,28.7mmol)和k2co3(2.64g,19.13mmol)。在80℃下,攪拌該混合物8小時。將該混合物冷卻至室溫。然后,將溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過硅膠柱色譜tlc(10%ea:90%pe,3g硅膠柱)純化殘余物。將通過tlc(pe/ea=5:1,rf=0.5)發現包含產物的所有級分合并,得到淺黃色固體的n,n-二甲基-2-(3-硝基-5-(三氟甲基)苯氧基)乙胺(1.35g,4.85mmol,產率50.7%):1hnmr(400mhz,cdcl3)δ8.08(s,1h),7.94(s,1h),7.51(s,1h),4.20-4.17(t,j=5.6hz,2h),2.81-2.78(t,j=5.6hz,2h),2.36(s,6h);es-lcmsm/z279.1(m+h)。
步驟2:3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯胺
向n,n-二甲基-2-(3-硝基-5-(三氟甲基)苯氧基)乙胺(900mg,3.23mmol)在meoh(10ml)中的懸浮液中加入pd/c(172mg,0.162mmol)(10%)。在26℃下,在h2氣氛(15psi)下氫化該混合物3小時。然后,過濾溶液并濃縮。得到3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯胺(600mg,2.417mmol,產率74.7%)。tlc(pe/ea=1:1,rf=0.4):1hnmr(400mhz,cdcl3)δ6.58-6.51(m,2h),6.38(s,1h),4.06-4.03(t,j=5.6hz,2h),3.83(br.s.,2h),2.73-2.70(t,j=5.6hz,2h),2.34(s,6h);es-lcmsm/z249.1(m+h)。
步驟3:1-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(200mg,0.506mmol)和3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯胺(126mg,0.506mmol)在1,4-二噁烷(10ml)中的溶液中加入et3n(0.211ml,1.517mmol)和dppa(209mg,0.759mmol)。在70℃下,攪拌該混合物12小時。然后,將溶液濃縮,并分配在ea和飽和的nahco3溶液之間。將合并的有機萃取物用鹽水洗滌,經mgso4干燥,過濾并濃縮。通過制備tlc(pe/ea=1:1,rf=0.5)純化殘余物,得到淺黃色固體的1-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(150mg,0.234mmol,產率46.3%):1hnmr(400mhz,cd3od)δ9.12(s,1h),8.67(d,j=1.8hz,1h),8.08-8.07(d,j=1.8hz,1h),7.53(s,1h),7.47-7.35(m,3h),6.93-6.91(d,j=8.8hz,3h),5.39(s,2h),4.30-4.28(t,j=5.2hz,2h),4.19-4.14(q,j=6.8hz,2h),3.80(s,3h),3.23-3.20(m,2h),2.69(s,6h),2.59(s,3h),1.31(t,j=7.2hz,3h);es-lcmsm/z641.3(m+h)。
步驟4:1-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲二鹽酸鹽
向1-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(100mg,0.156mmol)在meoh(10ml)中的懸浮液中加入pd/c(16.61mg,0.156mmol,10%)。在25℃下,在h2氣氛(15psi)下氫化該混合物3小時。然后,過濾溶液并濃縮,得到殘余物。通過制備hplc(儀器∶dc/柱:asbc18150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:23-53(b%))純化殘余物,得到黃色固體的1-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲二鹽酸鹽(25.02mg,0.042mmol,產率26.9%)。tlc(dcm/meoh=10:1,rf=0.4):1hnmr(400mhz,cd3od)δ9.26(s,1h),8.18(d,j=2.0hz,1h),7.87(d,j=2.0hz,1h),7.49-7.47(d,j=9.7hz,2h),6.99(s,1h),4.48-4.40(m,2h),4.21-4.16(q,j=6.8hz,2h),3.71-3.59(m,2h),3.02(s,6h),2.69(s,3h),1.51-1.48(t,j=6.8hz,3h);es-lcmsm/z521.2(m+h)。
根據與上述那些類似的方法制備下述實施例∶
實施例171:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(2-氟-4-
((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)脲
步驟1:2-(4-(4-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-氟-2-(三氟甲基)芐基)哌嗪-1-基)乙基乙酸酯
向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(0.4g,0.910mmol)在甲苯(50ml)中的混合物中加入三乙胺(0.184g,1.821mmol)、dppa(0.376g,1.366mmol)和2-(4-(4-氨基-5-氟-2-(三氟甲基)芐基)哌嗪-1-基)乙基乙酸酯(0.473g,0.910mmol)。在120℃下,攪拌該混合物12小時。lcms顯示反應完成。濃縮該混合物,得到粗產物,通過柱(dcm/meoh=15:1,rf=0.4)純化,得到呈褐色固體的2-(4-(4-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-氟-2-(三氟甲基)芐基)哌嗪-1-基)乙基乙酸酯(340mg,0.292mmol,產率32.1%)∶1hnmr(methanol-d4,400mhz)δ8.66(s,1h),8.35(d,j=7.5hz,1h),7.58(d,j=11.9hz,1h),7.40(d,j=7.5hz,4h),6.90(d,j=8.8hz,2h),5.43(s,2h),4.16-4.24(m,4h),3.78(s,3h),3.61(s,2h),2.50-2.61(m,10h),2.17(s,3h),2.04(s,3h),1.40-1.47(m,3h);es-lcmsm/z756.2(m+h)。
步驟2:1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)脲
向2-(4-(4-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-氟-2-(三氟甲基)芐基)哌嗪-1-基)乙基乙酸酯(340mg,0.292mmol)在meoh(10ml)中的混合物中加入在水(5ml)中的naoh(35.1mg,0.877mmol)。在20℃下,攪拌該混合物2小時。lcms顯示反應完成。用etoac(20ml×3)萃取該混合物。將有機層用鹽水洗滌,并濃縮,得到粗產物,通過制備tlc(dcm:meoh=10:1,rf=0.4)純化,得到呈褐色固體的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)脲(120mg,0.101mmol,產率34.5%):1hnmr(400mhz,chloroform-d)δ9.04(s,1h),8.56(d,j=7.5hz,2h),7.48(d,j=11.9hz,2h),7.30(br.s.,2h),6.81(d,j=8.4hz,2h),5.41(s,2h),4.13(d,j=6.6hz,2h),3.73(s,3h),3.62(d,j=5.3hz,4h),2.67-2.61(m,10h),2.17(s,3h),1.41(m,3h);es-lcmsm/z714.3(m+h)。
步驟3:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)脲
向1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)脲(120mg,0.101mmol)在二氯甲烷(dcm)(5ml)中的混合物中加入氯化氫、甲醇(溶劑合物)(0.252ml,1.009mmol)。在20℃下,攪拌該混合物1小時。lcms顯示反應完成。濃縮該混合物,得到粗產物,通過制備hplc(柱∶asbc18150*25mm;流動相a∶水+0.1%hcl;流動相b∶mecn;流速:25ml/分鐘;梯度分布說明∶17-37(b%))純化,得到呈黃色固體的1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)脲三鹽酸鹽(18.5mg,0.025mmol,產率24.91%):1hnmr(400mhz,methanol-d4)δ9.37(s,1h),8.81(d,j=7.5hz,1h),8.24(s,1h),7.93(br.s.,2h),4.38(br.s.,2h),4.21(d,j=7.1hz,2h),3.94-3.90(m,2h),3.40(d,j=4.4hz,10h),2.70(s,3h),1.51(t,j=6.8hz,3h);es-lcmsm/z594.4(m+h)。
實施例172:1-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-(2-羥基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:1-(2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲
在20℃下,向2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(0.25g,0.449mmol)在甲苯(50ml)中的混合物中加入三乙胺(0.091g,0.897mmol)、dppa(0.185g,0.673mmol)和4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯胺(0.152g,0.449mmol)。在120℃下,攪拌該混合物3小時。濃縮該混合物,得到粗產物,通過柱色譜(dcm/meoh=20:1,rf=0.4)純化,得到呈褐色固體的1-(2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲(205mg,0.226mmol,產率50.3%):1hnmr(400mhz,methanol-d4)δ9.21(s,1h),8.63(d,j=7.9hz,1h),8.15(d,j=1.8hz,1h),7.42(d,j=8.4hz,2h),7.25(d,j=7.5hz,7h),6.89(d,j=8.4hz,2h),5.40(s,2h),4.62(s,2h),4.34-4.27(m,2h),3.90-3.86(m,2h),3.78(s,3h),3.71(s,2h),3.20-3.07(m,10h),2.58(s,3h),1.35-1.32(m,3h);es-lcmsm/z804.2(m+h)。
步驟2:1-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-(2-羥基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
在80℃下,攪拌1-(2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲(100mg,0.110mmol)在氯化氫、h2o(1428μl,11.01mmol)中的混合物1小時。濃縮該混合物,得到粗產物,通過制備hplc(柱∶asbc18150*25mm;流動相a∶水+0.1%hcl;流動相b∶mecn;流速:25mll/min;梯度分布說明∶15-45(b%))純化,得到呈黃色固體的1-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)-3-2-(5-(2-羥基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲三鹽酸鹽(24.87mg,0.035mmol,產率32.1%)。1hnmr(400mhz,methanol-d4)δ9.25(s,1h),8.69(d,j=7.9hz,1h),8.16(d,j=2.2hz,1h),7.90(d,j=2.2hz,1h),7.74(d,j=11.9hz,1h),4.13(d,j=4.4hz,2h),4.08-4.01(m,2h),3.94(br.s.,2h),3.66(br.s.,2h),3.48-3.33(m,4h),3.28-3.18(m,2h),3.01-2.77(m,2h),2.62(s,3h),1.38(t,j=7.3hz,3h);es-lcmsm/z594.3(m+h)。
實施例173:1-(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)-3-(2-(5-(2-羥基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:2-(4-(4-(3-(2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-氟-2-(三氟甲基)芐基)哌嗪-1-基)乙基乙酸酯
向2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(0.5g,0.897mmol)在甲苯(50ml)中的混合物中加入三乙胺(0.182g,1.795mmol),dppa(0.370g,1.346mmol)和2-(4-(4-氨基-5-氟-2-(三氟甲基)芐基)哌嗪-1-基)乙基乙酸酯(0.435g,0.897mmol)。在120℃下,攪拌該混合物12小時。濃縮該混合物,得到粗產物,通過柱(dcm/meoh=15:1,rf=0.4)純化,得到呈褐色固體的2-(4-(4-(3-(2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-氟-2-(三氟甲基)芐基)哌嗪-1-基)乙基乙酸酯(420mg,0.341mmol,產率38.0%):1hnmr(400mhz,methanol-d4)δ8.70(d,j=1.8hz,1h),8.36(d,j=7.5hz,1h),8.13(s,1h),7.59(d,j=11.9hz,1h),7.41(d,j=8.4hz,2h),7.25-7.15(m,6h),6.87(d,j=8.4hz,2h),5.39(s,2h),4.61(s,2h),4.31-4.24(m,4h),3.87(br.s.,2h),3.77(s,3h),3.64(s,2h),2.87-2.74(m,6h),2.61-2.57(m,4h),2.18(s,3h),2.05(s,3h);es-lcmsm/z862.2(m+h)。
步驟2:1-(2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)脲
向2-(4-(4-(3-(2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-氟-2-(三氟甲基)芐基)哌嗪-1-基)乙基乙酸酯(420mg,0.341mmol)在meoh(10ml)中的混合物中加入在水(5ml)中的naoh(40.9mg,1.023mmol)。在20℃下,攪拌該混合物2小時。lcms顯示反應完成。用etoac(20ml×3)萃取該混合物。將有機層用鹽水洗滌,并濃縮,得到粗產物,通過tlc(dcm:meoh=10:1,rf=0.4)純化,得到呈褐色固體的1-(2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)脲(110mg,0.087mmol,產率25.6%):1hnmr(400mhz,chloroform-d)δ9.02(s,1h),8.68(s,1h),8.56(d,j=7.5hz,2h),8.28(br.s.,1h),8.01(s,1h),7.50(d,j=11.9hz,2h),7.33-7.22(m,4h),6.79(d,j=8.4hz,2h),5.39(s,2h),4.57(s,2h),4.24(br.s.,2h),3.82(br.s.,2h),3.73(s,3h),3.57(t,j=5.1hz,4h),2.51-2.34(m,10h),2.17(s,3h);es-lcmsm/z820.2(m+h)。
步驟3:1-(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)-3-(2-(5-(2-羥基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
在80℃下,攪拌1-(2-(5-(2-(芐氧基)乙氧基)-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)脲(110mg,0.087mmol)在氯化氫溶液(1.5ml,18%)中的混合物1小時。lcms顯示反應完成。濃縮該混合物,得到粗產物,通過制備hplc(柱∶asbc18150*25mm;流動相a∶水+0.1%hcl;流動相b∶mecn;流速:25ml/min;梯度分布描述:10-40(b%))純化,得到呈黃色固體的1-(2-氟-4-((4-(2-羥基乙基)哌嗪-1-基)甲基)-5-(三氟甲基)苯基)-3-(2-(5-(2-羥基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲三鹽酸鹽(32.5mg,0.045mmol,產率51.8%):1hnmr(400mhz,methanol-d4)δ9.31(s,1h),8.79-8.74(m,1h),8.22-8.19(m,1h),7.92(d,j=1.8hz,1h),7.89-7.84(m,1h),4.33-4.27(m,2h),4.14(d,j=4.0hz,2h),3.98-3.92(m,4h),3.67-3.34(m,10h),2.66(s,3h);es-lcmsm/z610.3(m+h)。
實施例174:n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯磺酰胺
步驟1:n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯磺酰胺
向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(1016mg,2.57mmol)、3-氨基-n-(2-(二甲基氨基)乙基)-5-(三氟甲基)-苯磺酰胺(800mg,2.57mmol)和et3n(0.716ml,5.14mmol)在1,4-二噁烷(15ml)中的溶液中分批加入疊氮磷酸二苯酯(0.701ml,3.08mmol)。然后,在n2氣氛下攪拌該混合物,并在80-90℃下加熱回流2小時。lcms分析顯示起始物質消失。在真空下除去溶劑,將殘余物溶于dcm(60ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。將有機層經na2so4干燥,過濾并濃縮,得到粗產物,通過硅膠柱色譜(dcm/meoh=20:1至10:1)純化。將通過tlc(dcm/meoh=10:1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到粗物質。通過制備hplc(儀器∶gilson215/柱∶geminic1810u150*25mm/流動相a∶含有0.01mol/lnh3h2o的水/流動相b∶mecn/流速∶25ml/min/梯度分布描述:60-90(b%))進一步純化粗產物,得到呈白色固體的純產物n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯磺酰胺(170mg,0.205mmol,產率8.0%):1hnmr(400mhz,cd3od)δ9.10(s,1h),8.70(d,j=2.0hz,1h),8.26(s,1h),8.12-8.06(m,2h),7.76(s,1h),7.42(d,j=9.0hz,2h),6.92(d,j=8.6hz,2h),5.40(s,2h),4.18(q,j=7.0hz,2h),3.80(s,3h),3.04(t,j=6.8hz,2h),2.60(s,3h),2.44(t,j=6.8hz,2h),2.21(s,6h),1.45(t,j=7.0hz,3h);es-lcmsm/z:584.2(m-pmb+h),704.2(m+h)。
步驟2:n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯磺酰胺
向n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯磺酰胺(170mg,0.242mmol)在dcm(10ml)中的溶液中加入加入2,2,2-三氟乙酸(1ml,0.242mmol)。然后,在25℃下,攪拌該混合物25分鐘。將反應混合物濃縮至干。然后,通過制備hplc(儀器∶aa/柱:geminic1810u150*25mm/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min;梯度分布說明∶5-35(b%))純化粗物質,得到呈黃色固體的純產物n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯磺酰胺鹽酸鹽(98mg,0.158mmol,產率65.4%):1hnmr(400mhz,dmso)δ11.94(br.s.,1h),10.68(s,1h),9.77(br.s.,1h),9.06(s,1h),9.02(s,1h),8.34(br.s.,1h),8.25(s,1h),8.13(s,1h),7.92(s,1h),7.71(s,1h),7.60(d,j=2.0hz,1h),4.03(q,j=6.8hz,2h),3.15(br.s.,3h),2.78(d,j=4.8hz,4h),2.53(s,6h),1.36(t,j=7.0hz,3h);es-lcmsm/z:584.2(m+h)。
實施例175:1-(4-(1-氨基乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:(1-(4-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基-嘧啶-5-基)脲基)-2-(三氟甲基)苯基)乙基)氨基甲酸叔丁酯
向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(100mg,0.253mmol)在1,4-二噁烷(15ml)中的混合物中加入et3n(0.053ml,0.379mmol)、疊氮磷酸二苯酯(diphenylphosphorazidate)(84mg,0.303mmol)、(1-(4-氨基-2-(三氟甲基)苯基)乙基)氨基甲酸叔丁酯(92mg,0.303mmol)和dmap(3.09mg,0.025mmol)。在80℃下,攪拌該混合物3小時,然后濃縮,并通過制備tlc(dcm/meoh=20:1,rf=0.6)純化,得到黃色固體的(1-(4-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)乙基)氨基甲酸叔丁酯(60mg,0.073mmol,產率28.9%):1hnmr(400mhz,cd3od)δ9.13(s,1h),8.71(d,j=2.0hz,1h),8.12(d,j=1.6hz,1h),7.84(s.,1h),7.70(s.,1h),7.61(d,j=8.4hz,1h),7.44(d,j=8.4hz,2h),6.94(d,j=8.4hz,2h),5.42(s,2h),5.08-5.01(m,1h),4.20(q,j=7.2hz,2h),3.82(s,3h),2.61(s,3h),1.47(t,j=6.8hz,3h),1.43(s,9h),1.38(d,j=7.2hz,3h);es-lcmsm/z697.1(m+h)。
步驟2:1-(4-(1-氨基乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
向(1-(4-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)-吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)乙基)氨基甲酸叔丁酯(60mg,0.086mmol)在dcm(10ml)中的溶液中加入tfa(1ml,12.98mmol)。在25℃下,攪拌該混合物2小時。將反應混合物濃縮,并通過制備hplc(柱∶asbc18150*25mm;流動相a∶水+0.1%hcl;流動相b∶mecn;流速:25ml/min;梯度分布說明∶10-40(b%))純化,得到黃色固體的1-(4-(1-氨基乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲二鹽酸鹽(19.4mg,0.035mmol,產率41.0%):1hnmr(400mhz,cd3od)δ9.22(s,1h),8.18(d,j=2.0hz,1h),8.08(d,j=2.0hz,1h),7.92-7.84(m,2h),7.76(d,j=8.4hz,1h),4.74(q,j=6.8hz,1h),4.20(q,j=7.2hz,2h),2.68(s,3h),1.68(d,j=7.2hz,3h),1.52(t,j=7.2hz,3h);es-lcmsm/z477.0(m+h).tlc(dcm/meoh=8:1,rf=0.2)。
實施例176:1-(4-(1-(二甲基氨基)乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:1-(4-(1-(二甲基氨基)乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
向1-(4-(1-氨基乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲(40mg,0.084mmol)中的溶液中加入甲酸(5ml,130mmol)和甲醛(7ml,94mmol)。使該混合物達到環境溫度,并加熱至70℃。將反應混合物回流3小時。然后,濃縮該混合物,并通過加入過量的50%naoh溶液堿化。將該混合物濃縮,并通過制備hplc(儀器∶gilsongx281;柱∶gemini150*25mm*5um;流動相a∶水(0.05%氨水溶液);流動相b:乙腈;梯度∶30-60(b%);流速:25ml/分鐘;運行時間∶10min)純化,得到白色固體的1-(4-(1-(二甲基氨基)乙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲(19.81mg,0.039mmol,產率45.9%),無需進一步純化。tlc(dcm/meoh=10:1,rf=0.2):1hnmr(400mhz,cd3od)δ9.02(s,1h),8.05(d,j=2.4hz,1h),7.90(d,j=2.0hz,1h),7.84(d,j=2.0hz,1h),7.71-7.68(m,1h),7.65-7.61(m,1h),4.13(q,j=6.8hz,2h),3.51-3.45(m,1h),2.54(s,3h),2.21(s,6h),1.47(t,j=7.2hz,3h),1.32(d,j=6.4hz,3h);es-lcmsm/z505.1(m+h)。
實施例177:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-(吡咯烷-1-基)乙基)-3-(三氟甲基)苯基)脲
步驟1:1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-(吡咯烷-1-基)乙基)-3-(三氟甲基)苯基)脲
向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(800mg,2.023mmol)、4-(2-(吡咯烷-1-基)乙基)-3-(三氟甲基)苯胺(575mg,2.226mmol)和et3n(0.846ml,6.07mmol)在1,4-二噁烷(15ml)中的溶液中一次性加入疊氮磷酸二苯酯(835mg,3.03mmol)。然后,在n2氣氛下攪拌該混合物,并加熱至100℃3小時。lcms分析顯示起始物質消失。在真空下除去溶劑。將殘余物溶于dcm(60ml)中,并用h2o(20ml)和鹽水(20ml)洗滌。經na2so4干燥有機層,過濾并濃縮,得到粗物質,通過硅膠柱色譜(dcm/meoh=20:1至5:1)純化,得到呈深黃色固體的粗產物1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-(吡咯烷-1-基)乙基)-3-(三氟甲基)苯基)脲(300mg,0.300mmol,產率14.8%)∶1hnmr(400mhz,cd3od)δ9.02(s,1h),8.06(d,j=2.0hz,1h),7.93(d,j=2.0hz,1h),7.84(d,j=2.0hz,1h),7.66(d,j=8.6hz,1h),7.43(d,j=8.6hz,1h),7.26(d,j=7.0hz,2h),7.21-7.19(m,2h),4.14(q,j=7.0hz,2h),3.71(br.s.,2h),3.42-3.36(m,4h),3.31(br.s.,3h),3.21-3.11(m,4h),2.53(s,3h),2.17(br.s.,2h),2.08-1.98(m,2h),1.48(t,j=6.8hz,3h);es-lcms:m/z531.3(m-pmb+h),651.3(m+h)。
步驟2:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-(吡咯烷-1-基)乙基)-3-(三氟甲基)苯基)脲
向1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-(吡咯烷-1-基)乙基)-3-(三氟甲基)苯基)脲(300mg,0.461mmol)在二氯甲烷(18ml)中的溶液中滴加tfa(2ml,26.0mmol)。在20℃下,攪拌該混合物1小時。lcms分析顯示起始物質消失。在真空下除去溶劑。然后,通過制備hplc(儀器∶gilson215/柱∶geminic1810u150*25mm/流動相a∶水(0.01mol/lnh3h2o)/流動相b∶mecn/流速:25ml/min;梯度分布說明∶36-76(b%))純化殘余物,得到呈黃白色固體的純產物1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-(2-(吡咯烷-1-基)乙基)-3-(三氟甲基)苯基)脲(35.6mg,0.067mmol,產率14.5%):1hnmr(400mhz,cd3od)δ9.05(s,1h),8.08(d,j=2.0hz,1h),7.90-7.84(m,2h),7.62(d,j=10.0hz,1h),7.40(d,j=8.4hz,1h),4.18-4.13(m,2h),3.02-2.95(m,2h),2.73(d,j=9.0hz,2h),2.67(br.s.,4h),2.56(s,3h),1.87(br.s.,4h),1.49(t,j=7.0hz,3h);es-lcms:m/z530.4。
實施例178:1-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)脲二鹽酸鹽
步驟1:2-氯嘧啶-5-胺
在0℃下,向2-氯-5-硝基嘧啶(5g,31.3mmol)和鋅(20.49g,313mmol)在甲醇(150ml)中的溶液中加入氯化銨(16.77g,313mmol)。在25℃下,攪拌得到的混合物16小時。lcms分析顯示起始物質消失。過濾該混合物。濃縮濾液,得到粗產物,通過柱色譜(pe/ea=3/1至1/1)純化。將通過tlc(pe/ea=1/1,rf=0.5)發現包含產物的所有級分合并,并濃縮,得到黃色固體的2-氯嘧啶-5-胺(1g,7.72mmol,產率24.63%):1hnmr(400mhz,methanol-d4)δ8.04(s,2h);es-lcmsm/z130.1(m+h)。
步驟2:1-(2-氯嘧啶-5-基)-3-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)-苯基)脲
向2-氯嘧啶-5-胺(100mg,0.772mmol)在thf(15ml)中的溶液中加入三光氣(80mg,0.270mmol)。在60℃下,攪拌得到的混合物0.5小時。lcms分析顯示起始物質消失。在真空下除去溶劑,得到黃色油狀物的2-氯-5-異氰酰基嘧啶(120mg,0.744mmol,產率96%)。在60℃下,向3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯胺(192mg,0.771mmol)和et3n(0.323ml,2.314mmol)在thf(15ml)中的溶液中加入2-氯-5-異氰酰基嘧啶(120mg,0.771mmol)在thf(15ml)中的溶液。在60℃下,攪拌得到的混合物1小時。在真空下除去溶劑。將殘余物分配在dcm(30ml)和h2o(20ml)之間,用dcm(30ml×2)萃取。將有機層用鹽水(20ml)洗滌,經na2so4干燥,過濾并濃縮,得到黃色固體的1-(2-氯嘧啶-5-基)-3-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)脲(300mg,0.743mmol,產率96%):1hnmr(400mhz,methanol-d4)δ8.86(s,2h),8.04(s,1h),7.42(s,1h),6.90(s,1h),4.17(t,j=5.3hz,2h),4.08(t,j=5.4hz,2h),2.38(s,6h);es-lcmsm/z404.2(m+h)。
步驟3:1-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)脲
在n2氣氛下,在110℃下,攪拌1-(2-氯嘧啶-5-基)-3-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)脲(150mg,0.371mmol)、3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(143mg,0.371mmol)、pdcl2(dppf)(27.2mg,0.037mmol)和cs2co3(242mg,0.743mmol)在1,4-二噁烷(18ml)和水(6ml)中的溶液1小時。lcms分析顯示起始物質消失。將有機層分離并濃縮,得到粗產物,通過制備tlc(dcm/meoh=10/1,rf=0.2)純化,得到黃色固體的1-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)脲(60mg,0.091mmol,產率24.5%):1hnmr(400mhz,methanol-d4)δ8.98(s,2h),8.67(d,j=1.8hz,1h),8.08(s,1h),7.60(br.s.,1h),7.41(d,j=8.6hz,2h),7.34(brs,1h),6.96(brs,1h),6.92(d,j=8.8hz,2h),5.40(s,2h),4.37-4.30(m,2h),4.27-4.21(m,3h),4.17(q,j=7.0hz,2h),3.79(s,3h),2.77(s,6h),1.45(t,j=6.9hz,3h);es-lcmsm/z627.3(m+h),507.2(m+h-pmb)。
步驟4:1-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)脲二鹽酸鹽
在25℃下,攪拌1-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)脲(60mg,0.096mmol)在2,2,2-三氟乙酸、二氯甲烷(溶劑合物)(5ml,3.72mmol)中的溶液0.5小時。lcms分析顯示起始物質消失。在真空下除去溶劑。通過制備hplc純化粗產物(儀器∶dg/柱:phenomenexsynergic18150*30mm*4um/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/分鐘/梯度分布說明∶18-48(b%)),得到黃色固體的1-(3-(2-(二甲基氨基)乙氧基)-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)脲二鹽酸鹽(20mg,0.035mmol,產率36.1%):1hnmr(400mhz,methanol-d4)δ8.96(s,2h),8.11(s,1h),7.92(d,j=2.0hz,1h),7.65(s,1h),7.35(s,1h),7.00(s,1h),4.45-4.41(m,2h),4.20-4.15(m,2h),3.66-3.62(m,2h),3.00(s,6h),1.49(t,j=6.9hz,3h);es-lcmsm/z507.3(m+h)。
實施例179:1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)脲
步驟1:1-(2-氯嘧啶-5-基)-3-(4-((二甲基氨基)甲基)-3-(三氟甲基)-苯基)-脲
向2-氯嘧啶-5-胺(200mg,1.544mmol)在thf(10ml)中的溶液中加入三光氣(151mg,0.509mmol)。在60℃下,攪拌該混合物0.5小時。濃縮該混合物,得到呈黃色固體的粗產物(240mg),其用于下一步中:es-lcmsm/z188.0(m+meoh)。向4-((二甲基氨基)甲基)-3-(三氟甲基)苯胺(337mg,1.543mmol)、三乙胺(156mg,1.543mmol)在thf(10ml)中的溶液中加入2-氯-5-異氰酰基嘧啶(240mg,1.543mmol)。在60℃下,攪拌該混合物0.5小時。濃縮該混合物,得到粗產物,通過制備hplc(柱∶phenomenexsynergic18250*21.2mm*4um,條件0.05%hcl-acnbeginb13endb43,梯度時間(min)10100%b,保持時間(min)3,流速(ml/min)25)純化,得到呈黃色固體的產物1-(2-氯嘧啶-5-基)-3-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)脲二鹽酸鹽(90mg,0.199mmol,產率12.88%):1hnmr(400mhz,methanol-d4)δ8.87(s,2h),8.06(s,1h),7.91(d,j=10.58hz,1h),7.68(d,j=8.60hz,1h),4.46(s,2h),2.93(s,6h);es-lcmsm/z:374.1(m+h)
步驟2:1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)脲
在微波中,在110℃下,攪拌1-(2-氯嘧啶-5-基)-3-(4-((二甲基氨基)甲基)-3-(三氟甲基)-苯基)脲(50mg,0.134mmol)、3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(51.5mg,0.134mmol)、cs2co3(43.6mg,0.134mmol)、pdcl2(dppf)(9.79mg,0.013mmol)在1,4-二噁烷(3ml)、水(1ml)中的混合物0.5小時。過濾該混合物并濃縮,得到粗產物。在通過制備tlc(dcm/meoh=10:1,rf=0.4)純化之后,得到呈黃色固體的產物1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)脲(75mg,0.094mmol,產率70.5%):1hnmr(400mhz,methanol-d4)δ8.98(s,2h),8.66(d,j=1.98hz,1h),8.08(d,j=1.98hz,1h),7.97(s,1h),7.64-7.75(m,2h),7.41(d,j=8.60hz,2h),6.92(d,j=8.60hz,2h),5.39(s,2h),4.17(q,j=6.98hz,2h),3.79(s,3h),2.66(brs,2h),2.41(s,6h),1.44(t,j=6.95hz,3h);es-lcmsm/z:597.2(m+h)
步驟3:1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)脲
向1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)脲(75mg,0.094mmol)在dcm(5ml)中的溶液中加入tfa(0.145ml,1.886mmol)。在22℃下,攪拌該混合物0.5小時。濃縮該混合物,得到粗產物,通過制備hplc(柱,純化phenomenexgemini150*25mm*10um,條件:0.05%hcl-acnbeginb14endb44,梯度時間(min)12.2100%b,保持時間(min)2.5,流速(ml/min)22)純化,得到呈黃色固體的產物1-(4-((二甲基氨基)甲基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)脲二鹽酸鹽(17.06mg,0.029mmol,產率31.3%):1hnmr(400mhz,methanol-d4)δ8.93(s,2h)8.07(m,2h)7.86(m,2h)7.69(d,j=8.31hz,1h)4.45(s,2h)4.14(q,j=6.85hz,2h),2.92(s,6h)1.47(t,j=6.85hz,3h);es-lcmsm/z477.2(m+h)
實施例180:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲鹽酸鹽
步驟1:1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲
向2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-羧酸(300mg,0.787mmol)在甲苯(10ml)中的溶液中加入5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-胺(153mg,0.787mmol)、疊氮磷酸二苯酯(325mg,1.180mmol)和et3n(0.219ml,1.573mmol)。在120℃下,攪拌該混合物2小時。濃縮該混合物,得到粗產物,通過制備tlc(dcm/meoh=10:1,rf=0.4)純化,得到黃色產物1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(50mg,0.053mmol,產率6.7%):
1hnmr(400mhz,methanol-d4)δ9.04(s,2h)8.31(s,1h)7.26(d,j=7.28hz,2h)7.19-7.22(m,2h)6.85(s,1h)6.48-6.52(m,1h)5.32(s,2h)4.12-4.18(m,2h)3.81(s,3h)1.61(s,6h)1.36-1.39(m,3h);es-lcmsm/z573.2(m+h)。
步驟2:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲鹽酸鹽
向1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(50mg,0.087mmol)在dcm(5ml)中的溶液中加入tfa(0.067ml,0.873mmol)。在15℃下,攪拌該混合物1小時。在通過lcms檢查之后,物質被耗盡。濃縮該混合物,得到粗產物,通過制備hplc(柱∶gemini150*255u,條件0.05%hcl-acnbeginb14endb44,梯度時間(min)100%b,保持時間(分鐘),流速(ml/min)25)純化,得到呈黃色固體的產物1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基-丙烷-2-基)異噁唑-3-基)脲鹽酸鹽(10.38mg,0.021mmol,產率24.3%):1hnmr(400mhz,methanol-d4)δ9.14(s,2h),8.17(s,1h),6.84(s,1h),6.22(s,1h),4.28(q,2h,j=7.6hz),1.61(s,6h),1.45(t,j=7.6hz,3h);es-lcmsm/z453.1(m+h)。
實施例181:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲鹽酸鹽
步驟1:1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲
在23℃下,向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-羧酸(300mg,0.787mmol)在1,4-二噁烷(10ml)中的溶液中加入疊氮磷酸二苯酯(260mg,0.944mmol)。攪拌該混合物10分鐘,將et3n(0.164ml,1.180mmol)加入到上述混合物中。向該混合物中加入5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-胺(153mg,0.787mmol)。在23℃下,攪拌該混合物10分鐘,然后在100℃下,攪拌1小時。濃縮該混合物,得到粗產物,通過制備tlc(dcm/meoh=10:1,rf=0.3)純化,得到粗產物1-(2-(5-乙氧基-6-((4-甲氧基芐基)-oxy)吡啶-3-基)嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(100mg,60%純度,0.087mmol,產率13.4%):es-lcmsm/z573.0(m+h)。
步驟2:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲鹽酸鹽
向1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(100mg,60%,0.105mmol)在dcm(5ml)中的溶液中加入tfa(2ml,在dcm中10%)。在23℃下,攪拌該混合物0.5小時。濃縮該混合物,得到粗產物,通過制備hplc(gilsongx281柱∶gemini150*25mm*5um流動相a∶含有0.1%hcl的水,流動相b∶mecn,柱溫∶40℃,梯度:30-60%b10min,流速∶25ml/min)純化。得到呈黃色固體的產物1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲鹽酸鹽7.71mg,0.015mmol,產率14.3%):1hnmr(400mhz,dmso-d6)δ8.83(s,2h)7.94(d,j=1.98hz,1h)7.71(d,j=2hz,1h)6.76(s,1h)4.03(q,j=7.2hz,2h),1.49(s,6h)1.36(t,j=7.2hz,3h);es-lcmsm/z453.0(m+h)
實施例182:1-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(4-(2-甲氧基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:1-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(6-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲。
在25℃下,向4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯胺(79mg,0.259mmol)、et3n(0.098ml,0.705mmol)、2-(6-((4-甲氧基芐基)-氧基)-4-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(100mg,0.235mmol)在甲苯(40ml)中的混合物中加入疊氮磷酸二苯酯(97mg,0.353mmol)。在120℃下,攪拌該混合物2小時。用水(20ml)淬滅該反應。用dcm(20ml×3)萃取混合物,將有機萃取物用鹽水(20ml)洗滌,經na2so4干燥,過濾并濃縮,得到呈黃色固體粗產物的1-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(6-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(100mg,0.110mmol,產率46.8%):1hnmr(400mhz,cd3od)9.32-9.25(m,1h),8.60(d,j=7.5hz,1h),8.31-8.23(m,1h),7.61(d,j=12.3hz,1h),7.39(d,j=8.4hz,2h),6.94-6.88(m,2h),6.53-6.49(m,1h),5.32(s,2h),4.24-4.17(m,2h),3.79(s,2h),3.73-3.70(m,2h),3.63(s,2h),3.53(s,3h),3.33(s,3h),2.59(s,3h),2.56-2.42(m,8h),1.13-1.08(m,3h);es-lcmsm/z698.3(m+h)。
步驟2:1-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(4-(2-甲氧基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
向1-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(6-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(100mg,0.117mmol)在dcm(10ml)中的溶液中加入2,2,2-三氟乙酸(66.6mg,0.584mmol),在25℃下攪拌該混合物20分鐘。在真空下除去溶劑,通過制備hplc(柱∶gemini150*255u;流動相b∶10mmnh4hco3-acn;梯度∶在25分鐘內,b從20到50;流速∶25ml/min;波長∶220/254nm.)純化,并凍干,得到呈白色固體的1-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(4-(2-甲氧基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲(19.22mg,0.032mmol,產率27.1%):1hnmr(400mhz,methanol-d4)9.25(s,1h),8.60(d,j=7.5hz,1h),7.80(s,1h),7.61(d,j=12.3hz,1h),6.03(s,1h),4.24-4.16(m,2h),3.78-3.70(m,2h),3.64(s,2h),3.34(s,3h),2.56(s,13h),1.13(t,j=7.3hz,3h);es-lcms(m/z)(m+h)=608.2。
實施例183:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲三鹽酸鹽
步驟1:1-(2-氯嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲
向2-氯嘧啶-5-胺(100mg,0.772mmol)在thf(15ml)中的溶液中加入三光氣(80mg,0.270mmol)。在60℃下,攪拌得到的混合物0.5小時。lcms分析顯示起始物質消失。在真空下除去溶劑,得到黃色油狀物的2-氯-5-異氰酰基嘧啶(120mg,產率95%)。在60℃下,向4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯胺(236mg,0.771mmol)和et3n(0.323ml,2.314mmol)在thf(15ml)中的溶液中加入2-氯-5-異氰酰基嘧啶(120mg,0.771mmol)在thf(15ml)中的溶液。在60℃下,攪拌得到的混合物1小時。在真空下除去溶劑。將殘余物分配在dcm(30ml)和h2o(20ml)之間,用dcm(30ml×2)萃取。將有機層用鹽水(20ml)洗滌,經na2so4干燥,過濾并濃縮,得到粗產物,通過制備tlc(dcm/meoh=10/1,rf=0.4)純化,得到褐色固體的1-(2-氯嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲(60mg,0.111mmol,產率14.34%):1hnmr(400mhz,methanol-d4)δ8.89(s,2h),8.81(s,2h),3.76(s,2h),2.92-2.60(m,10h),1.22(t,j=7.4hz,3h);es-lcmsm/z461.2(m+h)。
步驟2:1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲
在n2氣氛下,在110℃下,攪拌1-(2-氯嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲(59.8mg,0.130mmol)、3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(50mg,0.130mmol)、pdcl2(dppf)(9.50mg,0.013mmol)和cs2co3(85mg,0.260mmol)在1,4-二噁烷(18ml)和水(6ml)中的溶液1小時。lcms分析顯示起始物質消失。分離有機層并濃縮,得到粗產物,通過制備tlc(dcm/meoh=10/1,rf=0.2)純化,得到黃色固體的1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲(60mg,0.070mmol,產率54.1%):1hnmr(400mhz,methanol-d4)δ8.97(s,2h),8.58(d,j=7.6hz,1h),8.09-8.07(m,1h),7.62(d,j=12.0hz,2h),7.41(d,j=8.8hz,2h),6.92(d,j=8.4hz,2h),5.39(s,2h),4.17(d,j=6.8hz,2h),3.79(s,3h),3.69-3.65(m,4h),3.59(s,2h),3.57-3.53(m,4h),2.61(br.s.,2h),1.47-1.43(m,3h),1.28(m,3h);es-lcmsm/z684.3(m+h),564.2(m+h-pmb)。
步驟3:1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲三鹽酸鹽
在25℃下,攪拌1-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲(50mg,0.073mmol)在2,2,2-三氟乙酸(在dcm中10%)(2ml,1.488mmol)中的溶液0.5小時。lcms分析顯示起始物質消失。在真空下除去溶劑。通過制備hplc(儀器∶db/柱:gemini150*255u/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:9-39(b%))純化粗產物,得到黃色固體的1-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲三鹽酸鹽(5mg,7.43μmol,產率10.2%):1hnmr(400mhz,methanol-d4)δ8.94(s,2h),8.61(d,j=7.2hz,1h),8.07(s,1h),7.87(d,j=2.0hz,1h),7.67(s,1h),4.16(m,2h),3.80(br.s.,2h),3.69-3.65(m,2h),3.56(d,j=4.8hz,2h),3.25-3.20(m,2h),3.13(br.s.,2h),2.55(br.s.,2h),1.49(t,j=7.0hz,3h),1.36(t,j=7.2hz,3h);es-lcmsm/z564.2(m+h)。
實施例184:1-(2-氟-4-((4-甲基哌嗪-1-基)甲基)-5-(三氟甲基)-苯基)-3-(2-(5-(2-甲氧基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲三鹽酸鹽
步驟1:1-(2-氟-4-((4-甲基哌嗪-1-基)甲基)-5-(三氟甲基)苯基)-3-(2-(6-((4-甲氧基芐基)氧基)-5-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
在n2氣氛下,在120℃下,攪拌2-(6-((4-甲氧基芐基)氧基)-5-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(100mg,0.235mmol)、2-氟-4-((4-甲基哌嗪-1-基)甲基)-5-(三氟甲基)苯胺(68.5mg,0.235mmol)、疊氮磷酸二苯酯(78mg,0.282mmol)和et3n(0.066ml,0.470mmol)在甲苯(5ml)中的溶液2小時。在真空下除去溶劑。通過制備tlc(dcm/meoh=15/1,rf=0.3)純化該混合物,得到黃色固體的1-(2-氟-4-((4-甲基哌嗪-1-基)甲基)-5-(三氟甲基)苯基)-3-(2-(6-((4-甲氧基芐基)氧基)-5-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(53.3mg,0.049mmol,產率21%):1hnmr(400mhz,methanol-d4)9.20(s,1h),8.69(d,j=2.0hz,1h),8.61(d,j=7.6hz,1h),8.12(d,j=1.6hz,1h),7.58(d,j=12.0hz,1h),7.40(d,j=8.8hz,2h),6.90(d,j=8.4hz,2h),5.39(s,2h),4.24-4.22(m,2h),3.82-3.76(m,7h),3.69(s,2h),3.41(s,3h),3.26(m,2h),3.11(m,4h),2.76(s,3h),2.58(s,3h);es-lcmsm/z:714.2(m+h)。
步驟2:1-(2-氟-4-((4-甲基哌嗪-1-基)甲基)-5-(三氟甲基)苯基)-3-(2-(5-(2-甲氧基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲三鹽酸鹽
在25℃下,攪拌1-(2-氟-4-((4-甲基哌嗪-1-基)甲基)-5-(三氟甲基)苯基)-3-(2-(6-((4-甲氧基芐基)氧基)-5-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(80mg,0.112mmol)在tfa(在dcm中10%)(5ml)中的溶液0.5小時。lcms分析顯示起始物質消失。在真空下除去溶劑。通過制備hplc(柱∶phenomenexsynergic18250*21.2mm*4um/流動相a∶水+0.1%hcl/流動相b∶mecn/流速:25ml/min/梯度分布描述:15-45(b%))純化殘余物。在冷凍干燥之后,得到黃色固體的1-(2-氟-4-((4-甲基哌嗪-1-基)甲基)-5-(三氟甲基)苯基)-3-(2-(5-(2-甲氧基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲三鹽酸鹽(50mg,0.070mmol,產率62.5%):1hnmr(400mhz,methanol-d4)d=9.25(s,1h),8.68(d,j=8.0hz,1h),8.18(s,1h),7.98(s,1h),7.69(d,j=12.0hz,1h),4.26(d,j=4.5hz,2h),3.94-3.82(m,4h),3.63-3.40(m,7h),3.15(br.s.,2h),2.96(s,3h),2.68(s,2h),2.63(s,3h);es-lcmsm/z594.2(m+h)。
實施例185:1-(4-(2-氨基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:(1-(4-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-
甲基-嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙烷-2-基)氨基甲酸叔丁酯
向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(500mg,1.265mmol)在甲苯(25ml)中的懸浮液中加入(1-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙烷-2-基)氨基甲酸叔丁酯(647mg,1.265mmol)、et3n(0.264ml,1.897mmol)和疊氮磷酸二苯酯(522mg,1.897mmol)。在130℃下,攪拌該混合物12小時。然后,濃縮該溶液,并分配在乙酸乙酯(15ml)和水(10ml)之間。將有機萃取物用鹽水(10ml)洗滌,經na2so4干燥,過濾并濃縮。通過制備tlc(dcm/meoh=10:1,rf=0.4)純化粗物質,得到黃色固體的(1-(4-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙烷-2-基)-氨基甲酸叔丁酯(124mg,0.152mmol,產率12.0%):es-lcmsm/z605.4(m+h)。
步驟2:1-(4-(2-氨基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
在16℃下,攪拌在hcl中的(1-(4-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙烷-2-基)氨基甲酸叔丁酯(124mg,0.152mmol)在etoac(10ml,4n)中的溶液5小時。然后,濃縮溶液。通過制備hplc(儀器∶db/柱∶gemini150*25mm*5um/流動相a∶水(0.05%氨水溶液)/流動相b:乙腈/梯度∶25-55(b%)/流速∶25ml/min/運行時間∶10min)純化粗物質,得到1-(4-(2-氨基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲(31.8mg,0.063mmol,產率41.5%)。tlc(dcm/meoh=10:1,rf=0.2):1hnmr(400mhz,cd3od)δ9.06(s,1h),8.09(d,j=2.0hz,1h),7.90(dd,j=2.0,15.1hz,2h),7.65(d,j=7.0hz,1h),7.49(d,j=8.5hz,1h),4.17(q,j=6.9hz,2h),2.94(s,2h),2.58(s,3h),1.51(t,j=7.0hz,3h);1.16(s,6h);es-lcmsm/z505.2(m+h)。
實施例186:1-(4-(2-氨基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
步驟1:(1-(4-(3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基-嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙烷-2-基)氨基甲酸叔丁酯
向2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(500mg,1.265mmol)在甲苯(15ml)中的懸浮液中加入(1-(4-氨基-2-(三氟甲基)苯基)-2-甲基丙烷-2-基)氨基甲酸叔丁酯(647mg,1.265mmol)、et3n(0.264ml,1.897mmol)和疊氮磷酸二苯酯(522mg,1.897mmol)。在120℃下,攪拌該混合物12小時。然后,濃縮溶液,并分配在乙酸乙酯(20ml)和水(10ml)之間。將合并的有機萃取物用鹽水(10ml)洗滌,經na2so4干燥,過濾并濃縮。通過制備tlc(dcm/meoh=10:1,rf=0.7)純化粗物質,得到黃色固體的(1-(4-(3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙烷-2-基)氨基甲酸叔丁酯(300mg,0.372mmol,產率29.4%):1hnmr(400mhz,cd3od)δ9.40-9.05(m,1h),8.29(s,1h),7.47-7.22(m,5h),6.94(d,j=8.5hz,2h),6.50(s,1h),5.33(s,2h),4.16(q,j=7.0hz,2h),3.84-3.80(m,3h),3.24-3.16(m,2h),2.66-2.54(m,3h),1.52(s,9h),1.42-1.35(m,3h),1.24-1.20(m,6h);es-lcmsm/z725.4(m+h)。
步驟2:1-(4-(2-氨基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲
在18℃下,攪拌在hcl中的1-(4-(3-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-2-(三氟甲基)苯基)-2-甲基丙烷-2-基)氨基甲酸叔丁酯(300mg,0.372mmol)在etoac(10ml,4n,40.0mmol)中的溶液10小時。然后,濃縮該溶液。通過制備hplc(儀器∶db/柱:gemini150*25mm*5um/流動相a∶水(0.05%氨水溶液)/流動相b:乙腈/梯度∶23-53(b%)/流速∶25ml/min/運行時間∶10min)純化粗物質,得到白色固體的1-(4-(2-氨基-2-甲基丙基)-3-(三氟甲基)苯基)-3-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲(56.88mg,0.111mmol,產率29.8%)。tlc(dcm/meoh=10:1,rf=0.1):1hnmr(400mhz,cd3od)δ9.17(s,1h),7.90(d,j=2.2hz,1h),7.78(s,1h),7.69-7.60(m,1h),7.47(d,j=8.4hz,1h),6.00(s,1h),4.12(q,j=6.8hz,2h),2.93(s,2h),2.57(s,3h),1.37(t,j=7.1hz,3h),1.14(s,6h);es-lcmsm/z505.1(m+h)。
實施例187:n-(2-(二甲基氨基)乙基)-3-(3-(2-(4-(2-甲氧基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺
步驟1:n-(2-(二甲基氨基)乙基)-3-(3-(2-(6-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺
在25℃下,向3-氨基-n-(2-(二甲基氨基)乙基)-5-(三氟甲基)苯甲酰胺(100mg,0.349mmol)、et3n(0.133ml,0.952mmol)、2-(6-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(150mg,0.317mmol)在甲苯(40ml)中的混合物中加入疊氮磷酸二苯酯(131mg,0.476mmol)。在120℃下,攪拌該混合物2小時。在真空中除去溶劑,得到殘余物,將其用dcm(20ml×2)萃取。將有機萃取物用鹽水(20ml)洗滌,經na2so4干燥,過濾并濃縮,得到呈黃色固體的粗產物n-(2-(二甲基氨基)乙基)-3-(3-(2-(6-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺(150mg,0.129mmol,產率40.7%):1hnmr(400mhz,cd3od)9.40(s,1h),8.27-8.18(m,3h),7.83(br.s.,1h),7.49(br.s.,1h),7.33(br.s.,1h),6.88(d,j=8.8hz,2h),6.13(s,1h),4.37-4.34(m,2h),3.78-3.75(m,3h),3.74-3.69(m,4h),3.42-3.38(m,3h),3.18-3.13(m,4h),2.88(s,3h),1.27(t,j=7.3hz,6h);es-lcms(m/z)(m+h)=698.4。
步驟2:n-(2-(二甲基氨基)乙基)-3-(3-(2-(4-(2-甲氧基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺
向n-(2-(二甲基氨基)乙基)-3-(3-(2-(6-((4-甲氧基芐基)氧基)-4-(2-甲氧基乙氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺(150mg,0.129mmol)在二氯甲烷(10ml)中的溶液中加入2,2,2-三氟乙酸(73.5mg,0.645mmol)。在25℃下,攪拌該混合物20分鐘。在真空中除去溶劑,通過制備hplc(柱∶gemini150*255u;流動相∶水(0.05%氫氧化氨v/v)-acn;梯度∶在10分鐘中b從14到44;流速∶25ml/min;波長∶220/254nm)純化,并凍干,得到呈白色固體的n-(2-(二甲基氨基)乙基)-3-(3-(2-(4-(2-甲氧基乙氧基)-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺(45.4mg,0.079mmol,產率60.9%):1hnmr(400mhz,cd3od)9.17(s,1h),8.10(d,j=13.2hz,2h),7.81(s,2h),6.04(s,1h),4.21-4.18(m,2h),3.75-3.72(m,2h),3.55(t,j=6.6hz,2h),3.34(s,3h),2.61(t,j=6.6hz,2h),2.57(s,3h),2.34(s,6h);es-lcms(m/z)(m+h)=578.4。
實施例188:
1-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)脲二鹽酸鹽
步驟1:1-(2-氯嘧啶-5-基)-3-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)脲
向2-氯嘧啶-5-胺(150mg,1.158mmol)在thf(20ml)中的溶液中加入雙(三氯甲基)碳酸酯(0.082ml,0.405mmol)。在65℃下,攪拌得到的混合物0.5小時。lcms分析顯示起始物質消失。在真空下除去溶劑,得到黃色固體的2-氯-5-異氰酰基嘧啶(180mg,1.104mmol,產率95%)。在60℃下,向4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯胺(273mg,1.157mmol)和et3n(0.484ml,3.47mmol)在thf(20ml)中的溶液中加入2-氯-5-異氰酰基嘧啶(180mg,1.157mmol)在thf(20ml)中的溶液。在60℃下,攪拌得到的混合物1小時。在真空下除去溶劑,得到黃色固體的1-(2-氯嘧啶-5-基)-3-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)脲(380mg,0.165mmol,產率14.2%):1hnmr(400mhz,methanol-d4)d=8.85(s,2h),7.61(dd,j=4.9,9.0hz,1h),7.33-7.28(m,1h),3.70(s,2h),2.30-2.28(m,6h);es-lcmsm/z392.1(m+h)。
步驟2:1-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)脲
在n2氣氛下,在110℃下,攪拌1-(2-氯嘧啶-5-基)-3-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)脲(380mg,0.165mmol)、3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(63.5mg,0.165mmol)、pdcl2(dppf)(12.07mg,0.016mmol)和cs2co3(107mg,0.330mmol)在1,4-二噁烷(15ml)和水(5ml)中的溶液1小時。lcms分析顯示起始物質消失。分離水層。濃縮有機層,得到粗產物,通過制備tlc(dcm/meoh=15/1,rf=0.3)純化,得到褐色固體的1-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)脲(60mg,0.078mmol,產率47.4%):1hnmr(400mhz,dmso-d6)d=8.98(d,j=6.6hz,2h),8.65-8.61(m,1h),8.50(d,j=7.7hz,1h),8.01(br.s.,1h),7.56(d,j=12.3hz,1h),7.40(d,j=8.6hz,2h),6.93(d,j=8.4hz,2h),5.35(s,2h),4.13(q,j=7.1hz,2h),3.74(s,2h),3.47(s,3h),3.28(s,6h),1.34(t,j=6.7hz,3h);es-lcmsm/z495.2(m+h-pmb)。
步驟3:1-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)脲二鹽酸鹽
在25℃下,攪拌1-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)脲(50mg,0.081mmol)在2,2,2-三氟乙酸(在二氯甲烷中10%)(2ml,1.488mmol)中的溶液0.5小時。lcms分析顯示起始物質消失。在真空下除去溶劑。通過制備hplc(柱∶phenomenexsynergic18250*21.2mm*4um/流動相a∶水+0.05%hcl/流動相b∶mecn/流速∶25ml/min/梯度分布描述:22-52(b%))純化粗產物,得到黃色固體的1-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)脲二鹽酸鹽(15mg,0.026mmol,產率31.6%):1hnmr(400mhz,methanol-d4)δ9.02(s,2h),8.92(d,j=7.2hz,1h),8.11(d,j=1.2hz,1h),7.86-7.82(m,2h),4.53(s,2h),4.22-4.17(m,2h),2.97(s,6h),1.53(t,j=6.6hz,3h);es-lcmsm/z495.3(m+h)。
實施例189:n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺
步驟1:3-(3-(2-氯嘧啶-5-基)脲基)-n-(2-(二甲基氨基)乙基)-5-(三氟甲基)苯甲酰胺
向2-氯-5-異氰酰基嘧啶(240mg,0.984mmol)和et3n(0.206ml,1.477mmol)在thf(10ml)中的溶液中加入3-氨基-n-(2-(二甲基氨基)乙基)-5-(三氟甲基)苯甲酰胺(271mg,0.984mmol)。在60℃下,攪拌該混合物0.5小時。濃縮該混合物,得到粗產物,通過制備hplc(柱phenomenexgemini150*25mm*10um條件:0.225%fa-acnbeginb15endb45,梯度時間(min)12.2100%b,保持時間(min)2.5,流速(ml/min)22)純化,得到呈黃色固體的產物3-(3-(2-氯嘧啶-5-基)脲基)-n-(2-(二甲基氨基)乙基)-5-(三氟甲基)苯甲酰胺(200mg,0.413mmol,產率42.0%):1hnmr(400mhz,methanol-d4):δ8.88(s,2h)8.26(s,1h)8.02(s,1h)7.82(s,1h)3.74(t,j=5.77hz,2h)3.27(br.s.,2h)2.90(s,6h);es-lcmsm/z:431.1(m+h)。
步驟2:n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)-吡啶-3-基)嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺
在氮氣氛下,向3-(3-(2-氯嘧啶-5-基)脲基)-n-(2-(二甲基氨基)乙基)-5-(三氟甲基)苯甲酰胺(100mg,0.232mmol)、3-乙氧基-2-((4-甲氧基芐基)氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)吡啶(89mg,0.232mmol)、cs2co3(76mg,0.232mmol)在1,4-二噁烷(6ml)/水(2.00ml)中的混合物中加入pdcl2(dppf)(170mg,0.232mmol)。在微波中,在110℃下,攪拌該混合物0.5小時,然后濃縮,得到粗產物,通過制備tlc(dcm/meoh=10:1,rf=0.2)純化,得到呈黃色固體的產物n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺(60mg,0.079mmol,產率33.9%):1hnmr(400mhz,methanol-d4)δ8.99(s,2h)8.65(s,1h)8.21(br.s.,1h)8.08(d,j=12.96hz,2h)7.82(s,1h)7.41(d,j=8.56hz,1h)6.91(d,j=8.56hz,2h)5.38(s,2h)4.16(q,j=7.01hz,2h)3.79(s,3h)3.73(br.s.,2h)3.19(br.s.,2h)2.81(s,6h)1.44(t,j=6.85hz,3h);es-lcmsm/z:654.2(m+h)。
步驟3:n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺
向n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-((4-甲氧基芐基)-氧代)吡啶-3-基)嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺(60mg,0.092mmol)在dcm(5ml)中的溶液中加入tfa(0.141ml,1.836mmol)。在25℃下,攪拌該混合物1小時。濃縮該混合物,得到粗產物,通過制備hplc(柱phenomenexsynergic18250*21.2mm*4um,條件0.05%hcl-acnbeginb15endb45,梯度時間(min):10100%b,保持時間(min)3,流速(ml/min)25)純化,得到呈黃色固體的產物n-(2-(二甲基氨基)乙基)-3-(3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)嘧啶-5-基)脲基)-5-(三氟甲基)苯甲酰胺二鹽酸鹽(7.77mg,0.013mmol,產率14.0%):1hnmr(400mhz,dmso-d6):δ11.93(brs,1h),9.83(s,1h),9.54(s,1h),8.91(s,2h),8.18(s,1h),8.12(s,1h),7.90(brs.,1h),7.85(s,1h),7.58(d,j=2.01hz,1h),4.03(q,j=7.19hz,2h),3.63(d,j=5.52hz,2h),3.27(brs,2h),2.84(s,6h),1.36(t,j=6.90hz,3h);es-lcmsm/z534.1(m+h)。
實施例190:
1-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲二鹽酸鹽
步驟1:1-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲
在n2氣氛下,向2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(200mg,0.506mmol)、疊氮磷酸二苯酯(209mg,0.759mmol)和et3n(0.106ml,0.759mmol)在1,4-二噁烷(20ml)中的溶液中加入疊氮磷酸二苯酯(209mg,0.759mmol)。在70℃下,攪拌得到的混合物18小時。lcms分析顯示起始物質消失。在真空下除去溶劑。通過制備tlc(dcm/meoh=10/1,rf=0.3)純化殘余物,得到黃色固體的1-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(100mg,0.151mmol,產率29.9%):1hnmr(400mhz,cd3od)δ8.68(br.s.,1h),8.09(br.s.,1h),7.41(d,j=8.8hz,2h),7.30(s,1h),7.04(br.s.,2h),6.92(d,j=8.8hz,2h),5.39(s,2h),4.17(d,j=6.8hz,2h),3.83-3.74(m,5h),2.59(s,3h),2.31(s,6h),1.44(t,j=6.9hz,3h);es-lcmsm/z:629.2(m+h);509.1(m+h-pmb)。
步驟2:2-(4-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-2-氟苯基)-n-(3-(1-甲基吡咯烷-3-基)-5-(三氟甲基)苯基)乙酰胺
在25℃下,攪拌1-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)脲(100mg,0.159mmol)在2,2,2-三氟乙酸、二氯甲烷(溶劑合物)(3ml,10%)中的溶液0.5小時。lcms分析顯示起始物質小時。在真空下除去溶劑。通過制備hplc(柱∶gemini150*25mm*5um/流動相a∶水+0.1%hcl/流動相b∶mecn/流速::25ml/min/梯度分布描述:5-35(b%))純化粗產物,得到黃色固體的1-(4-((二甲基氨基)甲基)-2-氟-5-(三氟甲基)苯基)-3-(2-(5-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)脲二鹽酸鹽(40mg,0.069mmol,產率43.2%):1hnmr(400mhz,cd3od)δ9.22-9.17(m,1h),8.92(d,j=7.6hz,1h),8.12(d,j=1.5hz,1h),7.90(d,j=2.0hz,1h),7.68(d,j=11.5hz,1h),4.51(s,2h),4.21-4.15(m,2h),2.97(s,6h),2.61(s,3h),1.51(t,j=7.0hz,3h);es-lcmsm/z:509.1(m+h)。
實施例191:
1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲三鹽酸鹽
步驟1:1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲
向2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-羧酸(200mg,0.455mmol)在甲苯(30ml)中的混合物中加入三乙胺(92mg,0.910mmol),dppa(188mg,0.683mmol)和4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯胺(164mg,0.455mmol)。在120℃下,攪拌該混合物12小時。在真空下除去溶劑。通過柱色譜(dcm/meoh=10/1,rf=0.4)純化殘余物,得到黃白色固體的1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲(200mg,0.172mmol,產率37.8%):1hnmr(400mhz,methanol-d4)δ9.25(s,1h),8.67-8.61(m,2h),8.27(s,1h),7.60(dd,j=5.7,12.3hz,2h),7.46-7.37(m,2h),7.34(br.s.,1h),4.94(br.s.,2h),4.62(br.s.,2h),4.17-4.11(m,2h),3.70(br.s.,3h),3.20-3.00(m,8h),2.65-2.53(m,5h),1.40-1.35(m,3h),1.31-1.28(m,3h);es-lcmsm/z698.2(m+h)。
步驟2:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲三鹽酸鹽
向1-(2-(4-乙氧基-6-((4-甲氧基芐基)氧基)吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲(200mg,0.263mmol)在二氯甲烷(3ml)中的溶液中加入tfa(在dcm中10%,2ml,2.60mmol)。在25℃下,攪拌該混合物1小時。在真空下除去溶劑。通過制備hplc(儀器∶aa/柱∶phenomenexsynergic18250*21.2mm*4um/流動相a∶0.05%hcl/流動相b∶mecn/流速∶25ml/min/運行時間∶10min/梯度分布描述:14-44(b%))純化殘余物,并通冷凍干燥來干燥,得到黃白色固體的1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(4-((4-乙基哌嗪-1-基)甲基)-2-氟-5-(三氟甲基)苯基)脲三鹽酸鹽(70.1mg,0.098mmol,產率37.2%):1hnmr(400mhz,methanol-d4)δ9.64(s,1h),8.79(d,j=7.5hz,1h),8.55(s,1h),7.89(d,j=11.9hz,1h),6.22(s,1h),4.41(q,j=6.9hz,2h),4.19(brs,2h),3.70(brs,4h),3.42(dd,j=2.4,6.8hz,2h),3.20-2.97(m,j=15.0hz,4h),2.82(s,3h),1.51(t,j=6.8hz,3h),1.38(t,j=7.1hz,3h);es-lcmsm/z578.2(m+h)。
實施例192:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的結晶無水游離堿(化合物a游離堿無水物)
攪拌1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲(493.5mg)在12.5ml的丙酮中的懸浮液過夜,同時在40℃至5℃之間的溫度循環。在5℃下,加熱化合物a游離堿無水物的晶種。通過真空過濾分離固體,并在真空烘箱中于40℃干燥過夜,得到呈結晶固體的標題化合物。當暴露于75%rh5天時,游離堿無水物是物理穩定的。.
晶種制備∶
攪拌1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲在丙酮中的懸浮液3天,同時在40℃和5℃之間的溫度循環。通過真空過濾分離固體并干燥,得到呈結晶固體的標題化合物。
化合物a游離堿無水物的x射線粉末衍射(xrpd)圖案顯示在圖1中,衍射角和d-間距的概述在下表i中給出。xrpd分析是在pananalyticalx’pertprodiffractometer衍射計于si零-背景晶片上進行的。采集條件包括:cukα射線,發生器電壓∶45kv,發生器電流:40ma,步長∶0.02°2θ,x'celeratortmrtms(realtimemulti-strip)檢測器。入射光束側的設置∶固定的發散狹縫(0.25°),0.04rad索勒縫隙,抗-散射狹縫(0.25°)和10mm光束掩模。衍射光束側的設置∶固定的發散狹縫(0.25°)和0.04rad索勒縫隙。
表i
在nicoletnxr9650ft-ramanspectrometer上記錄標題化合物的拉曼光譜,4cm-1分辨率,采用來自nd:yvo4激光的激發波長(λ=1064nm)。化合物a游離堿無水物的拉曼光譜顯示在圖2中,觀察到的主要峰位于187.4、360.1、409.4、441.9、466.5、585.1、707.5、742.7、772.7、790.0、850.8、904.4、950.3、1005.2、1247.3、1313.6、1329.7、1396.8、1435.0、1468.6、1491.7、1530.2、1576.5、1622.9、1653.0、1710.0、2939.9cm-1。
在40ml/minn2吹掃下,在裝有自動采樣器和冷凍冷卻系統的tainstrumentsq100differentialscanningcalorimeter上記錄標題化合物的差示掃描量熱法(dsc)熱分析圖,并顯示在圖3中。在卷邊鋁盤中,使用15℃/min的加熱速率進行實驗。化合物a游離堿無水物的dsc熱分析圖顯示尖吸熱峰,具有251.95℃的起始溫度,約256.30℃的峰溫度和214.7j/g的焓。本領域技術人員應當認識到吸熱的起始溫度、峰溫度和焓可能根據實驗條件而變化。
在tainstrumentsq500thermogravimetricanalyzer上記錄標題化合物的熱重量分析(tga)熱分析圖,并顯示在圖4中。在鋁盤中,以40ml/minn2氣流和15℃/min的加熱速率進行實驗。化合物a游離堿無水物的tga熱分析圖顯示在25℃至150℃的溫度范圍的可忽略的重量損失和243.34℃的熱分解起始溫度。
實施例193:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲游離堿的第一結晶水合物(化合物a游離堿水合物1)
攪拌1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲在水中的懸浮液3天,同時在40℃和5℃之間的溫度循環。通過真空過濾分離固體,風干1小時,然后在真空烘箱中于40℃干燥,得到呈結晶固體的標題化合物。
化合物a游離堿水合物1的x射線粉末衍射(xrpd)圖案顯示在圖5中,衍射角和d-間距的概述在下表ii中給出。xrpd分析是在pananalytiicalx’pertprodiiffractometer衍射計于si零-背景晶片上進行的。采集條件包括:cukα射線,發生器電壓∶45kv,發生器電流:40ma,步長∶0.02°2θ,x'celeratortmrtms(realtimemulti-strip)檢測器。入射光束側的設置∶固定的發散狹縫(0.25°),0.04rad索勒縫隙,抗-散射狹縫(0.25°)和10mm光束掩模。衍射光束側的設置∶固定的發散狹縫(0.25°)和0.04rad索勒縫隙。
表ii
在nicoletnxr9650ft-ramanspectrometer上記錄標題化合物的拉曼光譜,4cm-1分辨率,采用來自nd:yvo4激光的激發波長(λ=1064nm)。化合物a游離堿水合物1的拉曼光譜顯示在圖6中,觀察到的主要峰位于582.9、744.4、776.1、859.7、896.0、999.8、1239.7、1278.0、1345.9、1372.5、1392.1、1428.9、1468.0、1488.3、1529.6、1572.1、1621.2、1732.7、3000.4cm-1。
在40ml/minn2吹掃下,在裝有自動采樣器和冷凍冷卻系統的tainstrumentsq100differentialscanningcalorimeter上記錄標題化合物的差示掃描量熱法(dsc)熱分析圖,并顯示在圖7中。在卷邊鋁盤中,使用15℃/min的加熱速率進行實驗。化合物a游離堿水合物1的dsc熱分析圖顯示第一次吸熱具有約64℃的起始溫度,約96℃的峰溫度和249.8j/g的焓,接著第二次吸熱具有約123℃的起始溫度,約146℃的峰溫度和93.4j/g的焓。本領域技術人員應當認識到吸熱的起始溫度、峰溫度和焓可能根據實驗條件而變化。
在tainstrumentsq500thermogravimetricanalyzer上記錄標題化合物的熱重量分析(tga)熱分析圖,并顯示在圖8中。在鋁盤中,以40ml/minn2氣流和15℃/min的加熱速率進行實驗。化合物a游離堿水合物1的tga熱分析圖顯示在最終熱分解之前觀察到兩個階段的重量損失事件。第一次重量損失事件發生在30℃至100℃的溫度范圍,重量損失約9.7%。第二次重量損失事件發生在100℃至150℃的溫度范圍,重量損失約3.1%。
實施例194:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲游離堿的第二結晶水合物(化合物a游離堿水合物2)
攪拌1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲在乙醇中的懸浮液3天,同時在40℃和5℃之間的溫度循環。通過真空過濾分離固體,風干1小時,然后在真空烘箱中于40℃干燥,得到呈結晶固體的標題化合物。
化合物a游離堿水合物2的x射線粉末衍射(xrpd)圖案顯示在圖9中,衍射角和d-間距的概述在下表iii中給出。xrpd分析是在pananalytiicalx’pertprodiiffractometer衍射計于si零-背景晶片上進行的。采集條件包括:cukα射線,發生器電壓∶45kv,發生器電流:40ma,步長∶0.02°2θ,x'celeratortmrtms(realtimemulti-strip)檢測器。入射光束側的設置∶固定的發散狹縫(0.25°),0.04rad索勒縫隙,抗-散射狹縫(0.25°)和10mm光束掩模。衍射光束側的設置∶固定的發散狹縫(0.25°)和0.04rad索勒縫隙。
表iii
在nicoletnxr9650ft-ramanspectrometer上記錄標題化合物的拉曼光譜,4cm-1分辨率,采用來自nd:yvo4激光的激發波長(λ=1064nm)。化合物a游離堿水合物2的拉曼光譜顯示在圖10中,觀察到的主要峰位于541.0、579.9、609.4、664.3、696.7、719.2、773.7、792.4、817.3、901.9、945.5、987.5、1211.1、1246.6、1312.2、1331.9、1362.2、1398.1、1428.5、1465.5、1487.2、1535.5、1579.1、1617.4、2943.7、2998.9、3096.1cm-1。
在40ml/minn2吹掃下,在裝有自動采樣器和冷凍冷卻系統的tainstrumentsq100differentialscanningcalorimeter上記錄標題化合物的差示掃描量熱法(dsc)熱分析圖,并顯示在圖11中。在卷邊鋁盤中,使用15℃/min的加熱速率進行實驗。化合物a游離堿水合物2的dsc熱分析圖顯示第一次吸熱具有約46℃的起始溫度,約67℃的峰溫度和18.78j/g的焓,接著第二次吸熱具有約155℃的起始溫度,約164℃的峰溫度和1.15j/g的焓,之后第三次吸熱具有約195℃的起始溫度,約205℃的峰溫度和53.81j/g的焓,接著第四次吸熱具有約240℃的起始溫度,約245℃的峰溫度和49.10j/g的焓。本領域技術人員應當認識到吸熱的起始溫度、峰溫度和焓可能根據實驗條件而變化。
在tainstrumentsq500thermogravimetricanalyzer上記錄標題化合物的熱重量分析(tga)熱分析圖,并顯示在圖12中。在鋁盤中,以40ml/minn2氣流和15℃/min的加熱速率進行實驗。化合物a游離堿水合物2的tga熱分析圖顯示在最終熱分解之前觀察到多次重量損失事件。第一次重量損失事件發生在25℃至100℃的溫度范圍,重量損失為約3.7%。第二次重量損失事件發生在130℃至175℃的溫度范圍,重量損失約1.9%。最后一次重量損失事件發生在175℃至210℃的溫度范圍,重量損失約3.3%。在低于225℃下沒有觀察到熱分解。
實施例195:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲游離堿的第三結晶水合物(化合物a游離堿水合物3)
攪拌1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲在9:1丙酮:水中的懸浮液3天,同時在40℃和5℃之間的溫度循環。通過真空過濾分離固體,風干1小時,然后在真空烘箱中于40℃干燥,得到呈結晶固體的標題化合物。化合物a游離堿水合物3的x射線粉末衍射(xrpd)圖案顯示在圖13中,衍射角和d-間距的概述在下表iv中給出。xrpd分析是在pananalytiicalx’pertprodiiffractometer衍射計于si零-背景晶片上進行的。采集條件包括:cukα射線,發生器電壓∶45kv,發生器電流:40ma,步長∶0.02°2θ,x'celeratortmrtms(realtimemulti-strip)檢測器。入射光束側的設置∶固定的發散狹縫(0.25°),0.04rad索勒縫隙,抗-散射狹縫(0.25°)和10mm光束掩模。衍射光束側的設置∶固定的發散狹縫(0.25°)和0.04rad索勒縫隙。
表iv
在nicoletnxr9650ft-ramanspectrometer上記錄標題化合物的拉曼光譜,4cm-1分辨率,采用來自nd:yvo4激光的激發波長(λ=1064nm)。化合物a游離堿水合物3的拉曼光譜顯示在圖14中,觀察到的主要峰位于542.9、587.4、671.6、696.4、719.1、775.4、794.7、817.6、900.8、949.6、988.4、1246.5、1316.2、1333.2、1361.8、1399.2、1430.4、1463.4、1486.2、1534.7、1580.2、1616.9、2942.3、3001.5、3094.6cm-1。
在40ml/minn2吹掃下,在裝有自動采樣器和冷凍冷卻系統的tainstrumentsq100differentialscanningcalorimeter上記錄標題化合物的差示掃描量熱法(dsc)熱分析圖,并顯示在圖15中。在卷邊鋁盤中,使用15℃/min的加熱速率進行實驗。化合物a游離堿水合物3的dsc熱分析圖顯示第一次吸熱具有約56℃的起始溫度,約75℃的峰溫度和18.16j/g的焓,接著第二次吸熱具有約89℃的起始溫度,約106℃的峰溫度和17.62j/g的焓,之后第三次吸熱具有約187℃的起始溫度,約196℃的峰溫度和42.13j/g的焓,接著第四次吸熱具有約237℃的起始溫度,約242℃的峰溫度和30.77j/g的焓。本領域技術人員應當認識到吸熱的起始溫度、峰溫度和焓可能根據實驗條件而變化。
在tainstrumentsq500thermogravimetricanalyzer上記錄標題化合物的熱重量分析(tga)熱分析圖,并顯示在圖16中。在鋁盤中,以40ml/minn2氣流和15℃/min的加熱速率進行實驗。化合物a游離堿水合物3的tga熱分析圖顯示在最終熱分解之前觀察到多次重量損失事件。第一次重量損失事件發生在25℃至63℃的溫度范圍,重量損失為約4.3%。第二次重量損失事件發生在63℃至100℃的溫度范圍,重量損失約2.5%。最后一次重量損失事件發生在100℃至210℃的溫度范圍,重量損失約3.9%。在低于225℃下沒有觀察到熱分解。
實施例196:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲游離堿的第四結晶水合物(化合物a游離堿水合物4)
攪拌1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲在2-甲氧基乙醇中的懸浮液3天,同時在40℃和5℃之間的溫度循環。通過真空過濾分離固體,風干1小時,然后在真空烘箱中于40℃干燥,得到呈結晶固體的標題化合物。
化合物a游離堿水合物4的x射線粉末衍射(xrpd)圖案顯示在圖17中,衍射角和d-間距的概述在下表v中給出。xrpd分析是在pananalytiicalx’pertprodiiffractometer衍射計于si零-背景晶片上進行的。采集條件包括:cukα射線,發生器電壓∶45kv,發生器電流:40ma,步長∶0.02°2θ,x'celeratortmrtms(realtimemulti-strip)檢測器。入射光束側的設置∶固定的發散狹縫(0.25°),0.04rad索勒縫隙,抗-散射狹縫(0.25°)和10mm光束掩模。衍射光束側的設置∶固定的發散狹縫(0.25°)和0.04rad索勒縫隙。
表v
在nicoletnxr9650ft-ramanspectrometer上記錄標題化合物的拉曼光譜,4cm-1分辨率,采用來自nd:yvo4激光的激發波長(λ=1064nm)。化合物a游離堿水合物4的拉曼光譜顯示在圖18中,觀察到的主要峰位于550.9、680.5、747.5、776.0、856.6、894.3、954.6、1002.6、1088.1、1240.5、1277.7、1314.5、1343.9、1390.6、1439.9、1463.3、1491.7、1532.6、1569.5、1613.3、1650.6、1729.1、2940.4、2998.1cm-1。
在40ml/minn2吹掃下,在裝有自動采樣器和冷凍冷卻系統的tainstrumentsq100differentialscanningcalorimeter上記錄標題化合物的差示掃描量熱法(dsc)熱分析圖,并顯示在圖19中。在卷邊鋁盤中,使用15℃/min的加熱速率進行實驗。化合物a游離堿水合物4的dsc熱分析圖顯示第一次吸熱具有約63℃的起始溫度,約92℃的峰溫度和81.38j/g的焓,接著第二次吸熱具有約194℃的起始溫度,約198℃的峰溫度和44.70j/g的焓,之后第三次吸熱具有約242℃的起始溫度,約244℃的峰溫度和2.939j/g的焓。本領域技術人員應當認識到吸熱的起始溫度、峰溫度和焓可能根據實驗條件而變化。
在tainstrumentsq500thermogravimetricanalyzer上記錄標題化合物的熱重量分析(tga)熱分析圖,并顯示在圖20中。在鋁盤中,以40ml/minn2氣流和15℃/min的加熱速率進行實驗。化合物a游離堿水合物4的tga熱分析圖顯示在最終熱分解之前觀察到多次重量損失事件。第一次重量損失事件發生在25℃至110℃的溫度范圍,重量損失為約3.9%。第二次重量損失事件發生在155℃至210℃的溫度范圍,重量損失約1.2%。在低于225℃下沒有觀察到熱分解。
實施例197:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲游離堿的第五結晶水合物(化合物a游離堿水合物5)
攪拌1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲在19:1丙酮:水中的懸浮液3天,同時在40℃和5℃之間的溫度循環。通過真空過濾分離固體,風干1小時,然后在真空烘箱中于40℃干燥,得到呈結晶固體的標題化合物。
化合物a游離堿水合物5的x射線粉末衍射(xrpd)圖案顯示在圖21中,衍射角和d-間距的概述在下表vi中給出。xrpd分析是在pananalytiicalx’pertprodiiffractometer衍射計于si零-背景晶片上進行的。采集條件包括:cukα射線,發生器電壓∶45kv,發生器電流:40ma,步長∶0.02°2θ,x'celeratortmrtms(realtimemulti-strip)檢測器。入射光束側的設置∶固定的發散狹縫(0.25°),0.04rad索勒縫隙,抗-散射狹縫(0.25°)和10mm光束掩模。衍射光束側的設置∶固定的發散狹縫(0.25°)和0.04rad索勒縫隙。
表vi
在nicoletnxr9650ft-ramanspectrometer上記錄標題化合物的拉曼光譜,4cm-1分辨率,采用來自nd:yvo4激光的激發波長(λ=1064nm)。化合物a游離堿水合物5的拉曼光譜顯示在圖22中,觀察到的主要峰位于542.9、581.1、664.4、696.3、719.5、774.8、793.9、817.9、898.4、944.0、988.9、1109.8、1247.0、1315.3、1332.8、1399.4、1429.9、1464.5、1486.7、1533.4、1580.3、1617.5、2938.9、2998.5、3098.4cm-1。
在40ml/minn2吹掃下,在裝有自動采樣器和冷凍冷卻系統的tainstrumentsq100differentialscanningcalorimeter上記錄標題化合物的差示掃描量熱法(dsc)熱分析圖,并顯示在圖23中。在卷邊鋁盤中,使用15℃/min的加熱速率進行實驗。化合物a游離堿水合物5的dsc熱分析圖顯示第一次吸熱具有約36℃的起始溫度,約64℃的峰溫度和97.61j/g的焓,接著第二次吸熱具有約148℃的起始溫度,約155℃的峰溫度和0.2688j/g的焓,之后第三次吸熱具有約181℃的起始溫度,約198℃的峰溫度和51.45j/g的焓。本領域技術人員應當認識到吸熱的起始溫度、峰溫度和焓可能根據實驗條件而變化。
在tainstrumentsq500thermogravimetricanalyzer上記錄標題化合物的熱重量分析(tga)熱分析圖,并顯示在圖24中。在鋁盤中,以40ml/minn2氣流和15℃/min的加熱速率進行實驗。化合物a游離堿水合物5的tga熱分析圖顯示在最終熱分解之前觀察到多次重量損失事件。第一次重量損失事件發生在25℃至105℃的溫度范圍,重量損失為約7.7%。第二次重量損失事件發生在105℃至175℃的溫度范圍,重量損失約3.4%。最后一次重量損失事件發生在175℃至225℃的溫度范圍,重量損失為約3.9%。在低于225℃下沒有觀察到熱分解。
實施例198:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的結晶無水鹽酸鹽(化合物a鹽酸鹽無水物)
·hcl
將1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲在丙酮中的懸浮液加熱至40℃。加入一當量的3m鹽酸水溶液,并攪拌該漿液2天,同時在一小時時段內于40℃和5℃之間的溫度范圍循環,接著在室溫下平衡4小時。過濾固體,風干,并用丙酮洗滌,得到呈結晶固體的標題化合物。離子色譜法分析指示1:1的酸:游離堿化學計量。
化合物a鹽酸鹽無水物的x射線粉末衍射(xrpd)圖案顯示在圖25中,衍射角和d-間距的概述在下表vii中給出。xrpd分析是在pananalytviicalx’pertprodviiffractometer衍射計于si零-背景晶片上進行的。采集條件包括:cukα射線,發生器電壓∶45kv,發生器電流:40ma,步長∶0.02°2θ,x'celeratortmrtms(realtimemulti-strip)檢測器。入射光束側的設置∶固定的發散狹縫(0.25°),0.04rad索勒縫隙,抗-散射狹縫(0.25°),和10mm光束掩模。衍射光束側的設置∶固定的發散狹縫(0.25°)和0.04rad索勒縫隙。
表vii
在nicoletnxr9650ft-ramanspectrometer上記錄標題化合物的拉曼光譜,4cm-1分辨率,采用來自nd:yvo4激光的激發波長(λ=1064nm)。化合物a鹽酸鹽無水物的拉曼光譜顯示在圖26中,觀察到的主要峰位于589.0、734.4、768.5、893.3、1177.3、1203.0、1257.1、1374.9、1475.7、1602.0、1715.5、2993.2cm-1。
在40ml/minn2吹掃下,在裝有自動采樣器和冷凍冷卻系統的tainstrumentsq100differentialscanningcalorimeter上記錄標題化合物的差示掃描量熱法(dsc)熱分析圖,并顯示在圖27中。在卷邊鋁盤中,使用15℃/min的加熱速率進行實驗。化合物a鹽酸鹽無水物的dsc熱分析圖顯示尖吸熱峰,具有約221℃的起始溫度,約232℃的峰溫度和185.8j/g的焓。本領域技術人員應當認識到吸熱的起始溫度、峰溫度和焓可能根據實驗條件而變化。
在tainstrumentsq500thermogravimetricanalyzer上記錄標題化合物的熱重量分析(tga)熱分析圖,并顯示在圖28中。在鋁盤中,以40ml/minn2氣流和15℃/min的加熱速率進行實驗。化合物a鹽酸鹽無水物的tga熱分析圖顯示在25℃至150℃的溫度范圍的最小重量損失事件,重量損失為約0.2%。在低于200℃下沒有觀察到熱分解。
實施例199:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲鹽酸鹽的結晶水合物(化合物a鹽酸鹽水合物)
·h2o
·hcl
將1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲在乙腈中的懸浮液加熱至40℃。加入一當量的3m鹽酸水溶液,并攪拌該漿液過夜,同時在一小時時段內于40℃和5℃之間的溫度范圍循環,接著在室溫下平衡1小時。過濾固體,風干,并用乙腈洗滌,得到呈結晶固體的標題化合物。
化合物a鹽酸鹽水合物的x射線粉末衍射(xrpd)圖案顯示在圖29中,衍射角和d-間距的概述在下表viii中給出。xrpd分析是在pananalytiicalx’pertprodiiffractometer衍射計于si零-背景晶片上進行的。采集條件包括:cukα射線,發生器電壓∶45kv,發電機電流∶40ma,步長∶0.02°2θ,x'celeratortmrtms(realtimemulti-strip)檢測器。入射光束側的設置∶固定的發散狹縫(0.25°),0.04rad索勒縫隙,抗-散射狹縫(0.25°),和10mm光束掩模。衍射光束側的設置∶固定的發散狹縫(0.25°)和0.04rad索勒縫隙。
表viii
在nicoletnxr9650ft-ramanspectrometer上記錄標題化合物的拉曼光譜,4cm-1分辨率,采用來自nd:yvo4激光的激發波長(λ=1064nm)。化合物a鹽酸鹽水合物的拉曼光譜顯示在圖30中,觀察到的主要峰位于213.1、456.7、575.1、704.6、735.5、770.1、885.3、934.8、1232.5、1256.0、1369.8、1493.3、1548.5、1578.9、1612.9、1722.2、2918.2cm-1。
在40ml/minn2吹掃下,在裝有自動采樣器和冷凍冷卻系統的tainstrumentsq100differentialscanningcalorimeter上記錄標題化合物的差示掃描量熱法(dsc)熱分析圖,并顯示在圖31中。在卷邊鋁盤中,使用15℃/min的加熱速率進行實驗。化合物a鹽酸鹽水合物的dsc熱分析圖顯示第一次吸熱具有約115℃的起始溫度,約157℃的峰溫度和100.5j/g的焓,接著第二次吸熱具有約187℃的起始溫度,約198℃的峰溫度和114.9j/g的焓。本領域技術人員應當認識到吸熱的起始溫度、峰溫度和焓可能根據實驗條件而變化。
在tainstrumentsq500thermogravimetricanalyzer上記錄標題化合物的熱重量分析(tga)熱分析圖,并顯示在圖32中。在鋁盤中,以40ml/minn2氣流和15℃/min的加熱速率進行實驗。化合物a鹽酸鹽水合物的tga熱分析圖顯示在25℃至180℃的溫度范圍的重量損失事件,重量損失為約3.6%。在低于200℃下沒有觀察到熱分解。
實施例200:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的結晶乙磺酸鹽(化合物a乙磺酸鹽)
將1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲在乙腈中的懸浮液加熱至40℃。加入一當量的3m乙磺酸水溶液,并攪拌該漿液過夜,同時在一小時時段內于40℃和5℃之間的溫度范圍循環,接著在室溫下平衡1小時。過濾固體,風干,并用乙腈洗滌,得到呈結晶固體的標題化合物。1hnmr分析指示1:1的酸:堿化學計量。
化合物a乙磺酸鹽的x射線粉末衍射(xrpd)圖案顯示在圖33中,衍射角和d-間距的概述在下表ix中給出。xrpd分析是在pananalytiicalx’pertprodiiffractometer衍射計于si零-背景晶片上進行的。采集條件包括:cukα射線,發生器電壓∶45kv,發生器電流:40ma,步長∶0.02°2θ,x'celeratortmrtms(realtimemulti-strip)檢測器。入射光束側的設置∶固定的發散狹縫(0.25°),0.04rad索勒縫隙,抗-散射狹縫(0.25°)和10mm光束掩模。衍射光束側的設置∶固定的發散狹縫(0.25°)和0.04rad索勒縫隙。
表ix
在nicoletnxr9650ft-ramanspectrometer上記錄標題化合物的拉曼光譜,4cm-1分辨率,采用來自nd:yvo4激光的激發波長(λ=1064nm)。化合物a乙磺酸鹽的拉曼光譜顯示在圖34中,觀察到的主要峰位于195.0、432.2、734.5、749.7、882.2、1046.1、1211.4、1240.4、1380.1、1422.3、1502.1、1600.0、1617.0、1713.9、2937.7cm-1。
在40ml/minn2吹掃下,在裝有自動采樣器和冷凍冷卻系統的tainstrumentsq100differentialscanningcalorimeter上記錄標題化合物的差示掃描量熱法(dsc)熱分析圖,并顯示在圖35中。在卷邊鋁盤中,使用15℃/min的加熱速率進行實驗。化合物a乙磺酸鹽的dsc熱分析圖顯示尖吸熱峰,具有約236℃的起始溫度,約239℃的峰溫度和140.7j/g的焓。本領域技術人員應當認識到吸熱的起始溫度、峰溫度和焓可能根據實驗條件而變化。
在tainstrumentsq500thermogravimetricanalyzer上記錄標題化合物的熱重量分析(tga)熱分析圖,并顯示在圖36中。在鋁盤中,以40ml/minn2氣流和15℃/min的加熱速率進行實驗。化合物a乙磺酸鹽的tga熱分析圖顯示在25℃至180℃的溫度范圍的最小重量損失事件,重量損失為約0.14%。在低于200℃下沒有觀察到熱分解。
實施例201:1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲的結晶硫酸鹽(化合物a硫酸鹽)
將1-(2-(4-乙氧基-6-氧代-1,6-二氫吡啶-3-基)-4-甲基嘧啶-5-基)-3-(5-(1,1,1-三氟-2-甲基丙烷-2-基)異噁唑-3-基)脲在乙腈中的懸浮液加熱至40℃。加入一當量的2.5m硫酸水溶液,并攪拌該漿液過夜,同時在一小時時段內于40℃和5℃之間的溫度范圍循環,接著在室溫下平衡1小時。過濾固體,風干,并用乙腈洗滌,得到呈結晶固體的標題化合物。離子色譜分析指示1:1的酸:堿化學計量。
化合物a硫酸鹽的x射線粉末衍射(xrpd)圖案顯示在圖37中,衍射角和d-間距的概述在下表x中給出。xrpd分析是在pananalytiicalx’pertprodiiffractometer衍射計于si零-背景晶片上進行的。采集條件包括:cukα射線,發生器電壓∶45kv,發生器電流:40ma,步長∶0.02°2θ,x'celeratortmrtms(realtimemulti-strip)檢測器。入射光束側的設置∶固定的發散狹縫(0.25°),0.04rad索勒縫隙,抗-散射狹縫(0.25°),和10mm光束掩模。衍射光束側的設置∶固定的發散狹縫(0.25°)和0.04rad索勒縫隙。
表x
在nicoletnxr9650ft-ramanspectrometer上記錄標題化合物的拉曼光譜,4cm-1分辨率,采用來自nd:yvo4激光的激發波長(λ=1064nm)。化合物a硫酸鹽的拉曼光譜顯示在圖38中,觀察到的主要峰位于202.1、572.0、697.9、737.5、777.3、937.1、1181.1、1264.9、1370.0、1499.4、1554.8、1602.3、1723.7、2942.8cm-1。
在40ml/minn2吹掃下,在裝有自動采樣器和冷凍冷卻系統的tainstrumentsq100differentialscanningcalorimeter上記錄標題化合物的差示掃描量熱法(dsc)熱分析圖,并顯示在圖39中。在卷邊鋁盤中,使用15℃/min的加熱速率進行實驗。化合物a硫酸鹽的dsc熱分析圖顯示第一次吸熱具有約30℃的起始溫度,約77℃的峰溫度和28.76j/g的焓,接著第二次吸熱具有約214℃的起始溫度,約218℃的峰溫度和164.0j/g的焓。本領域技術人員應當認識到吸熱的起始溫度、峰溫度和焓可能根據實驗條件而變化。
在tainstrumentsq500thermogravimetricanalyzer上記錄標題化合物的熱重量分析(tga)熱分析圖,并顯示在圖40中。在鋁盤中,以40ml/minn2氣流和15℃/min的加熱速率進行實驗。化合物a硫酸鹽的tga熱分析圖顯示在30℃至160℃的溫度范圍的重量損失事件,重量損失為約1.3%。在低于200℃下沒有觀察到熱分解。
生物分析
ret激酶的酶分析
使用桿狀病毒表達系統,將人類ret激酶細胞質結構域(登記號np_000314.1的氨基酸658-1114)表達為n-末端gst-融合蛋白。使用谷胱甘肽瓊脂糖色譜純化gst-ret。以總體積10ul用遞增濃度的ret激酶抑制劑作為單體在384孔模板中,如下進行ret激酶酶法分析:通過如下制備ret抑制劑化合物:將100nl不同濃度的ret抑制劑加入到384-孔板中。將5μl/孔的2x酶混合物(50mmhepes(4-(2-羥乙基)-1-哌嗪乙磺酸);1mmchaps(3-[(3-膽酰胺丙基(cholamidopropyl))二甲基銨基(ammonio)]-1-丙磺酸鹽);0.1mg/mlbsa(牛血清白蛋白);1mmdtt(二硫蘇糖醇);0.2nmret激酶)加入到該384孔板中,并在23℃下培養30分鐘。加入5μl/孔的2x底物混合物(50mmhepes;1mmchaps;0.1mg/mlbsa;20μm三磷腺苷;20mmmgcl2和1mm生物素化的肽底物),并在23℃下培養1小時。在23℃下,培養10μl/孔2x停止/檢測混合物(50mmhepes;0.1%bsa;800mm氟化鉀;50mmedta(乙二胺四乙酸);銪穴狀化合物標記的抗-磷酸酪氨酸抗體的200x稀釋物;62.5nm鏈親和素-xl665)1小時,并在homogenoustime-resolvedfluorescence讀數機上讀數。使用graphpadprism將ic50擬合到s形劑量響應曲線。
生物學分析
在上述ret分析中檢測了本發明的實施例化合物,發現所述實施例化合物為具有ic50<10μm的ret抑制劑。在人類ret激酶的酶分析中檢測的特定實施例的數據列在如下表1中:+=10μm>ic50>500nm;++=500nm≥ic50>100nm;+++=ic50≤100nm。
表1
ret激酶基于細胞的機理分析
可以在基于細胞的分析中,檢測本發明的化合物抑制組成型ret激酶磷酸化的功效。將tt細胞(atcccrl-1803),一種具有組成型活化ret激酶的髓樣甲狀腺癌細胞系,保持在37℃下的150cm2皿中的5%二氧化碳中的f12kaighn's培養基、10%胎牛血清、1xglutamax、1x非必需氨基酸、1xpen/strep抗生素中。將1.0e5tt細胞/孔加入到96孔細胞培養板中,并使其粘附過夜。在37℃下,在5%二氧化碳中用不同濃度的ret抑制劑化合物處理tt細胞,用冰冷的pbs(磷酸鹽緩沖鹽水)洗滌,并通過加入200μl的25mmtrishclph7.5;2mmedta;150mmnacl;1%脫氧膽酸鈉;1%tritonx-100;50mmβ磷酸甘油鈉;1mm原釩酸鈉;1x磷酸酶抑制劑混合物#2(sigma#p5726);1x磷酸酶抑制劑混合物#3(sigma#p0044)和1x完全小型無edta蛋白酶抑制劑混合物(roche#4693159001)裂解,在-80℃下培養10分鐘,并在冰上解凍。在4℃下,將100μl的tt細胞裂解產物加入到96孔板中過夜,所述板已經在4℃下用1xpbs;0.05%吐溫-20;1%牛血清白蛋白阻斷的兔子抗-ret抗體(cellsignaling#_7032)的1:1,000稀釋液涂布過夜。將該板用200μl的1xpbs洗滌4x;加入0.05%吐溫-20,然后加入100μl的抗-磷酸酪氨酸檢測抗體(cellsignaling#_7034)的1:1,000稀釋液,并在37℃下培養1小時。將該板用200μl的1xpbs洗滌4x;加入0.05%吐溫-20,然后加入100μl的抗-小鼠免疫球蛋白辣根過氧化物酶結合抗體(cellsignalin#_7034),并在37℃下培養1小時。將該板用200μl的1xpbs洗滌4x;加入0.05%吐溫-20、100μl的tmb(3,3',5,5"-四甲基聯苯胺)底物(cellsignaling#_7004),在37℃下培養10分鐘,加入100μl的終止液(cellsignaling#_7002),并在分光光度計上于450nm讀取吸光度。使用graphpadprism將ic50擬合到s形劑量響應曲線。
ret激酶基于細胞的增殖分析
可以檢測本發明的化合物抑制細胞增殖和細胞生存力的能力的功效。將tt細胞(atcccrl-1803),一種具有組成型活化ret激酶的髓樣甲狀腺癌細胞系,保持在37℃下的150cm2皿中5%二氧化碳中的f12kaighn's培養基、10%胎牛血清、1xglutamax、1x非必需氨基酸、1xpen/strep抗生素中。將在50μl培養基中的6.0e3tt細胞/孔加入到96孔細胞培養板中,并使它們的粘附過夜。將50μl的連續稀釋的ret抑制劑化合物加入到含有培養的tt細胞的96孔板中,并在37℃下,在5%二氧化碳中培養八天。加入50μl的celltiter-glo(promega#_g-7573),并在攪拌器上混合內含物1分鐘,接著在23℃下避光10分鐘,并通過envision(perkinelmer)讀取發光。使用graphpadprism將ic50擬合到s形劑量響應曲線。
體內結腸超敏模型
在結腸超敏的體內模型中評價ret激酶抑制劑化合物的功效(hoffman,j.m.,etal.,gastroenterology,2012,142:844-854)。
- 還沒有人留言評論。精彩留言會獲得點贊!