多肽和植物乳桿菌胞外代謝產物及它們的應用及誘導植物乳桿菌產細菌素的方法和鑒定方法與流程
本發明涉及微生物領域,具體地,涉及一種多肽、一種植物乳桿菌的胞外代謝產物,所述多肽和/或所述植物乳桿菌的胞外代謝產物在誘導植物乳桿菌產生細菌素中的應用,以及一種誘導植物乳桿菌產生細菌素的方法。
背景技術:
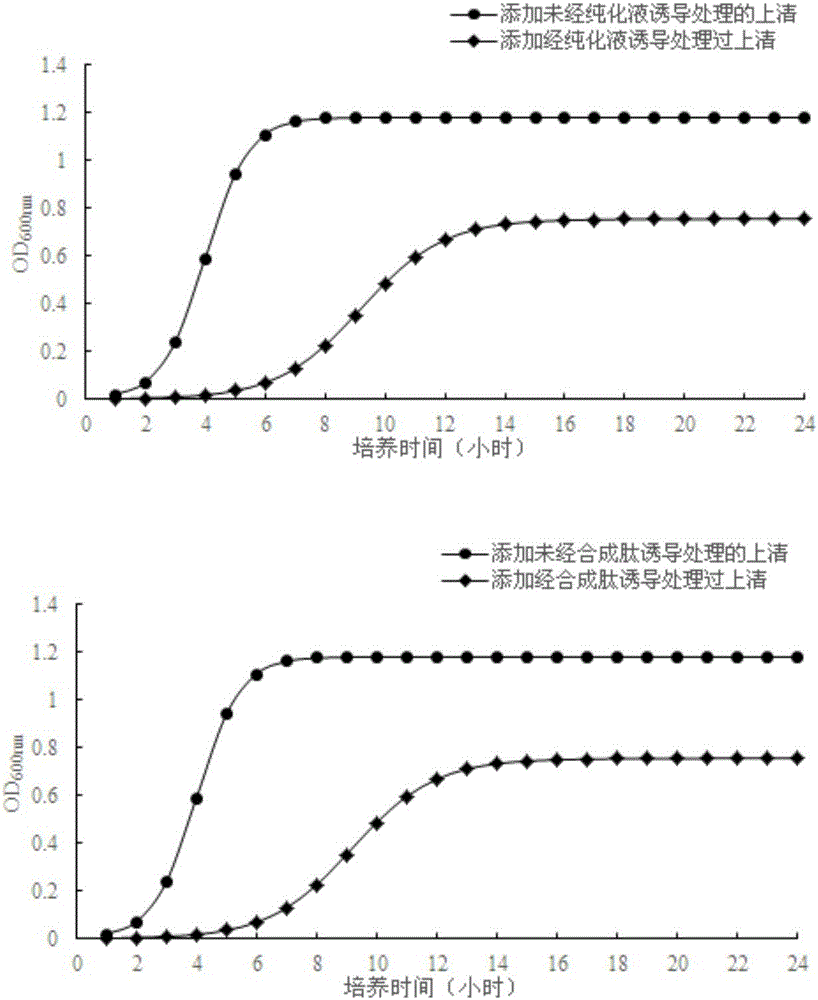
:近幾十年來,隨著抗生素藥物的廣泛使用,引起機體內越來越多的常規微生物有機轉變為條件致病菌,引起人們多種不必要的疾病,于是,人們迫切需要一種新型的、天然的物質成為抑菌藥物或者化學防腐的替代品。細菌素作為一種天然、無副作用、強效的抑菌類物質,被廣泛關注,并被認為是一種有潛力的抗菌類藥物與防腐劑的替代品。目前研究比較深入的細菌素的防腐劑有乳酸鏈球菌素(Nisin)、納他霉素、溶菌酶等。乳酸菌是一類能夠發酵糖類,且乳酸是主要或唯一發酵產物的革蘭氏陽性無芽孢細菌的總稱。大量研究結果表明,乳酸菌具有調節腸道菌群平衡、抑制腸道致病菌定植、提高機體免疫力、改善機體營養狀況等作用,因而在多個領域被廣泛應用。乳酸菌素是乳酸菌的次級代謝產物,被檢測認定為一類對動物無毒性、無抗原性、熱穩定性好的多肽類物質,能夠被人體消化道中的蛋白酶所降解,不會引起不良反應,是一類天然安全的防腐劑。由于Ⅱa類乳酸菌素對致病菌有高效的抑菌活性的特性,研究工作者認為細菌素以及產細菌素的菌株有望成為潛在的食品天然防腐劑。然而受細菌素自身特性的限制,使得這些菌株以及所產細菌素在工業應用以及在食品加工過程中條件都受到較多的置疑。基于此,天然細菌素的應用一直處于原地。另一方面細菌素合成的影響受許多因素的影響,其中認為最重要的是pH、培養溫度、培養基的體系成分等,而且有時最適合細胞生長的條件并不總是產生最多的細菌素。有許多的研究表明最高細菌素的獲得常常是在低于最適菌株生長條件的pH值與生長溫度。在一些情況,培養基中的高濃度NaCl,以及某些應急反應都會刺激產生細菌素。因此,亟需尋找一種能夠高效誘導乳酸菌產生細菌素的物質以及方法。技術實現要素:本發明的目的是為了克服現有技術中的以上缺陷,提供一種能夠誘導植物乳桿菌產生細菌素的多肽和/或植物乳桿菌的胞外代謝產物,所述多肽和/或植物乳桿菌的胞外代謝產物在誘導植物乳桿菌產生細菌素中的應用,以及一種誘導植物乳桿菌產生細菌素的方法。為了實現上述目的,一方面,本發明提供了一種多肽,該多肽的氨基酸序列如SEQIDNO:1(KYYGNGVTCGKHSCSVDWGKATTCIINNGAMAWATGGHQGNHKC)所示。第二方面,本發明提供了一種植物乳桿菌的胞外代謝產物,其中,所述植物乳桿菌的胞外代謝產物含有如上所述的多肽。第三方面,本發明還提供了如上所述的植物乳桿菌的胞外代謝產物的制備方法,該方法包括:(1)將植物乳桿菌的發酵產物進行固液分離,得到發酵上清液;(2)在所述發酵上清液中加入硫酸銨進行鹽析,得到沉淀物,并將得到的沉淀物溶于水中;(3)對步驟(2)得到的溶液依次進行透析、離子交換以及萃取,從而得到所述植物乳桿菌的胞外代謝產物。優選的,所述植物乳桿菌為植物乳桿菌植物亞種(Lactobacillusplantarumsubsp.plantarum),更優選為保藏號CGMCCNo.6936的植物乳桿菌植物亞種。優選的,步驟(3)中,所述透析的條件包括:截留分子量為3000-4000Da,溫度為2-6℃,時間為8-15小時。優選的,步驟(3)中,使用陽離子交換樹脂進行所述離子交換層析,所述離子交換層析的條件包括:平衡緩沖液為含有3-4g/L檸檬酸和1-2g/L檸檬酸鈉(例如,檸檬酸三鈉)的混合溶液;洗脫液為1.5-2.5mol/L的氯化鈉溶液,0-100體積%的所述洗脫液的梯度洗脫;洗脫流速為0.8-1.2mL/min,洗脫時間為30-130min。優選的,步驟(3)中,所述萃取通過C18柱進行,所述萃取的步驟包括:先通過超純水將樣品載入C18柱中,然后通過65-75體積%的乙腈收集樣品。第四方面,本發明還提供了如上所述的多肽和/或如上所述的植物乳桿菌的胞外代謝產物在誘導植物乳桿菌產生細菌素中的應用。第五方面,本發明還提供了一種誘導植物乳桿菌產生細菌素的方法,該方法包括:在對所述植物乳桿菌進行培養的過程中,優選在所述植物乳桿菌培養的對數期,向培養液中加入如上所述的多肽和/或如上所述的植物乳桿菌的胞外代謝產物。第六方面,本發明還提供了脫脂乳培養基在鑒定產生細菌素的植物乳桿菌中的應用。通過上述技術方案,將如上所述的多肽和/或如上所述的植物乳桿菌的胞外代謝產物用在培養所述植物乳桿菌的過程中,尤其是對數期,特別是在對數前期,能夠有效誘導植物乳桿菌表達細菌素,并且如測試例3中所示的,植物乳桿菌基因中的papA、papB、papC、papD四個與細菌素產生相關的基因的表達水平分別上調了9.41倍,6.75倍,7.94倍及6.63倍。這說明添加如上所述的多肽和/或如上所述的植物乳桿菌的胞外代謝產物能夠誘導植物乳桿菌菌株基因中相關基因的表達,從而提高細菌素的產生。本發明的其它特征和優點將在隨后的具體實施方式部分予以詳細說明。生物菌種公開信息本發明使用的保藏號CGMCCNo.6936的植物乳桿菌植物亞種Zhang-LL已于2012年12月4日保藏于中國微生物菌種保藏管理委員會普通微生物中心(地址:北京市朝陽區北辰西路1號院3號,中國科學院微生物研究所)。并于2014年12月25日進行了專利申請,2015年4月29日公開,專利申請號為201410816266.3。在此通過全文援引的方式將該專利申請的內容合并于此。附圖說明附圖是用來提供對本發明的進一步理解,并且構成說明書的一部分,與下面的具體實施方式一起用于解釋本發明,但并不構成對本發明的限制。在附圖中:圖1為經和未經植物乳桿菌CGMCCNo.6936的胞外代謝產物誘導的植物乳桿菌CGMCCNo.6936發酵上清液的抑菌實驗結果(抑菌圈)。其中,圖1A為添加了植物乳桿菌CGMCCNo.6936的胞外代謝產物的液體脫脂乳培養基培養物的抑菌效果;圖1B為添加了本發明的多肽的液體脫脂乳培養基培養物的抑菌效果;圖1C為未添加植物乳桿菌CGMCCNo.6936的胞外代謝產物的液體脫脂乳培養基的培養物的抑菌效果。圖2為經和未經植物乳桿菌CGMCCNo.6936的胞外代謝產物誘導的植物乳桿菌CGMCCNo.6936發酵上清液的抑菌實驗結果(生長曲線)。其中,圖1A為添加了植物乳桿菌CGMCCNo.6936的胞外代謝產物的液體脫脂乳培養基培養物的抑菌效果;圖1B為添加了本發明的多肽的液體脫脂乳培養基培養物的抑菌效果。圖3為植物乳桿菌CGMCCNo.6936的胞外代謝產物誘導CGMCCNo.6936菌株相關基因表達量變化圖,其中A為添加了植物乳桿菌CGMCCNo.6936的胞外代謝產物的液體脫脂乳培養基培養物的基因相對表達變化量;B為未添加植物乳桿菌CGMCCNo.6936的胞外代謝產物的液體脫脂乳培養基的培養物的基因相對表達變化量。具體實施方式以下對本發明的具體實施方式進行詳細說明。應當理解的是,此處所描述的具體實施方式僅用于說明和解釋本發明,并不用于限制本發明。在本文中所披露的范圍的端點和任何值都不限于該精確的范圍或值,這些范圍或值應當理解為包含接近這些范圍或值的值。對于數值范圍來說,各個范圍的端點值之間、各個范圍的端點值和單獨的點值之間,以及單獨的點值之間可以彼此組合而得到一個或多個新的數值范圍,這些數值范圍應被視為在本文中具體公開。第一方面,本發明提供了一種多肽,該多肽的氨基酸序列如SEQIDNO:1所示。根據本發明,如上所述的多肽可以通過任意的方法獲得,例如,可以委托生物公司進行合成,也可以自行合成,還可以通過特定的手段進行分離,或根據其氨基酸序列從包括有所述多肽序列的較長氨基酸序列中進行截取。第二方面,本發明公開了一種植物乳桿菌的胞外代謝產物,其中,所述植物乳桿菌的胞外代謝產物含有如上所述的多肽。根據本發明,含有如上所述多肽的植物乳桿菌的胞外代謝產物可以為將植入乳桿菌的發酵產物進行固液分離后的上清液,也可以為通過一定的純化手段進行純化后的產物。本申請所述的植物乳桿菌的胞外代謝產物優選為經過純化后的產物。由此,第三方面,本發明還提供了一種含有如上所述多肽的植物乳桿菌的胞外代謝產物的制備方法,該方法包括:(1)將植物乳桿菌的發酵產物進行固液分離,得到發酵上清液;(2)在所述發酵上清液中加入硫酸銨進行鹽析,得到沉淀物,并將得到的沉淀物溶于水中;(3)對步驟(2)得到的溶液依次進行透析、離子交換以及萃取,從而得到所述植物乳桿菌的胞外代謝產物。根據本發明,步驟(1)中,所述植物乳桿菌的培養方法可以采用本領域常規的乳酸菌培養方法,例如,可以在MRS培養基中于33-40℃下進行厭氧培養,也可以具體參照專利申請201410816266.3中的培養方法,本發明對此并沒有過多的限制。根據本發明,所述植物乳桿菌優選為植物乳桿菌植物亞種(Lactobacillusplantarumsubsp.plantarum),更優選為保藏號CGMCCNo.6936的植物乳桿菌植物亞種。當采用保藏號CGMCCNo.6936的植物乳桿菌植物亞種時,所制備出的植物乳桿菌的胞外代謝產物能夠更有效的促進植物乳桿菌產生細菌素。根據本發明,對培養后的發酵產物進行固液分離的方法為本領域常規的選擇,例如,可以通過離心的方法,也可以通過過濾的方法,本領域技術人員可以根據實際需求進行具體的選擇。本發明優選采用離心的方法,例如,將培養結束(一般培養20-30小時)后的發酵產物于2-6℃下以5000-12000rpm的轉速進行離心分離20-40min,得到發酵上清液。步驟(2)中,術語“鹽析”一般是指溶液中加入無機鹽類而使某種物質溶解度降低而析出的過程。能夠理解的是,就本申請而言,由于本申請欲制備含有SEQIDNO:1所示的多肽的植物乳桿菌的胞外代謝產物,所以所述“鹽析”指的是加(NH4)2SO4使蛋白質凝聚的過程。所述硫酸銨的加入量可以為常規的對蛋白質進行鹽析的量。優選的,本發明中所述硫酸銨的加入量使得硫酸銨的最終飽和度為60-75%,更優選為65-72%。根據本發明,為了進一步保證蛋白質的活性以及完整性,所述鹽析過程優選在低溫(2-6℃)的條件下進行。此外,進一步優選的,所述硫酸銨在攪拌的條件下加入,直至達到預期的飽和度。所述攪拌可以為人工攪拌,可以通過磁力攪拌器攪拌,本發明對此并沒有過多的限制。根據本發明,待達到預期的飽和度后,優選在低溫(2-6℃)的條件下將其靜置18-30小時以充分對目標產物進行沉淀。此外,沉淀結束后,優選通過離心的方法對沉淀物進行收集,所述離心的條件,例如可以為在2-6℃下以5000-12000rpm的轉速離心分離20-40min。離心結束后使用水對沉淀物進行復溶以便進行下一步純化,所述水可以為能夠溶解沉淀物的任何水或水溶液,例如,可以為去離子水。為了進一步去除雜質,本發明還優選通過再次離心的方法對所述沉淀物的水溶液進行進一步純化,所述離心的條件,例如可以為2-6℃下5000-12000rpm的轉速離心分離20-40min,離心后棄去沉淀物,保留上清液。步驟(3)中,為了能夠更為有效獲得本發明的多肽,所述透析過程中使用的透析袋的截留分子量優選為3000-4000Da,更優選為3200-3800Da。在優選的情況下,在透析如上步驟(2)所得到的沉淀物水溶液之前,將所述透析袋在溫水(40-60℃)中浸泡20-40min以進行前處理。其中,優選的,所述透析的條件包括:截留分子量為3000-4000Da,溫度為2-6℃,時間為8-15小時。另外,所述透析在攪拌的條件下進行,所述攪拌可以通過磁力攪拌器完成,攪拌的速度例如可以為90-100rpm。根據本發明,透析結束后,采用陽離子交換層析對透析產物進行進一步純化,所述陽離子交換層析所用陽離子交換樹脂一般可分為強酸性陽離子交換劑:活性基團是-SO3H(磺酸基)和-CH2SO3H(次甲基磺酸基);以及弱酸性陽離子交換劑:活性基團有-COOH,-OCH2COOH,C6H5OH等弱酸性基團;本發明優選使用弱酸性陽離子交換劑對透析產物進行離子交換。根據本發明,所述離子交換層析的步驟可以按照常規的步驟進行,例如,加入樣品后,先使用平衡緩沖液將樣品帶入離子交換層析柱中,然后再通過洗脫液對目標產物進行洗脫。本發明中,相對于本申請特定的目標產物,所述平衡緩沖液的為含有3-4g/L檸檬酸和1-2g/L檸檬酸鈉的混合溶液,所述洗脫液為1.5-2.5mol/L的氯化鈉緩沖液。本發明中,為了得到本發明的目標產物,所述洗脫的條件優選包括:使用所述洗脫液對目標產物進行梯度洗脫,梯度洗脫:0-100體積%的所述洗脫液;洗脫流速為0.8-1.2mL/min,洗脫時間為30-130min。在洗脫過程中,收集紫外吸收值A280nm出現峰值的洗脫樣品。其中,所述“梯度洗脫”指的是,在規定的時間內,將洗脫液的濃度隨時間以恒定的梯度成線性上升。所述洗脫液的濃度可通過將洗脫液與去離子水或純凈水按照一定的比例進行調節。根據本發明,為了更進一步分離本發明的多肽,還優選通過C18柱對所述洗脫樣品進行萃取。本發明中,在萃取前,優選先通過甲醇的水溶液對所述C18柱進行處理,所述甲醇和水的體積比優選為1:0.5-2。使用C18柱對所述洗脫樣品進行萃取的步驟優選先通過超純水進行淋洗,以將樣品帶入柱子中,然后再使用65-75體積%乙腈的水溶液收集樣品。為了進一步純化本發明的目標產物,還優選在45-60℃的條件下對萃取液進行濃縮至乙腈完全揮發,從而得到本發明的植物乳桿菌的胞外代謝產物。進一步的,本發明可以通過將如上得到的濃縮產物冷凍干燥以制備成凍干粉長期保存,也可以加入適當的無菌水進行稀釋,冷藏或冷凍備用。根據本發明,優選的情況下,在所述植物乳桿菌的胞外代謝產物的使用前,將其pH值調節至6-7,并使用無菌過濾器進行除菌過濾。第四方面,本發明還提供了如上所述的多肽和/或如上所述的植物乳桿菌的胞外代謝產物在誘導植物乳桿菌產生細菌素中的應用。其中,所述植物乳桿菌為植物乳桿菌植物亞種(Lactobacillusplantarumsubsp.plantarum),更優選為保藏號CGMCCNo.6936的植物乳桿菌植物亞種。第五方面,本發明還提供了一種誘導植物乳桿菌產生細菌素的方法,該方法包括:在對所述植物乳桿菌進行培養的過程中,優選在所述植物乳桿菌培養的對數期,向培養液中加入如上所述的多肽和/或如上所述的植物乳桿菌的胞外代謝產物。其中,所述植物乳桿菌為植物乳桿菌植物亞種(Lactobacillusplantarumsubsp.plantarum),更優選為保藏號CGMCCNo.6936的植物乳桿菌植物亞種。根據本發明,更為優選的,在所述植物乳桿菌培養的對數期前期加入如上所述的多肽和/或如上所述的植物乳桿菌的胞外代謝產物。所述對數前期指的是進入對數期后的0-8h之間。根據本發明,以所述多肽計,相對于每毫升的培養液,如上所述的多肽和/或如上所述的植物乳桿菌的胞外代謝產物的加入量為2-5微克。本發明的發明人在研究的過程中發現,在常規用于培養乳酸菌的培養基例如,MRS培養基中,植物乳桿菌均能夠或多或少的表達并分泌細菌素,因此,常規的用于乳酸菌培養的培養基不能夠鑒定出植物乳桿菌是否能夠產生細菌素。然而本發明的發明人在研究的過程中發現,在脫脂乳培養基中,不經過本發明的多肽或植物乳桿菌的胞外代謝產物誘導的植物乳桿菌不會產生細菌素,而經過本發明的多肽或植物乳桿菌的胞外代謝產物誘導的植物乳桿菌則能夠產生細菌素。基于如上的發現,第六方面,脫脂乳培養基在鑒定產生細菌素的植物乳桿菌中的應用。其中,所述脫脂乳培養基中脫脂乳的濃度優選為50-200g/L,更優選為80-150g/L。具體的,使用如上的脫脂乳培養基對產生細菌素的植物乳桿菌進行鑒定的方法包括:將植物乳桿菌培養在如上的脫脂乳培養基中,培養8-15小時,取培養上清液,檢測其抑菌情況。所述抑菌的檢測可以使用單核細胞增生李斯特菌(ATCC54003)為指示菌。所述抑菌實驗為本領域技術人員所公知的,例如,檢測抑菌圈,本發明在此不再詳細贅述。以下將通過實施例對本發明進行詳細描述。平衡緩沖液:稱取3.36224g的檸檬酸,1.1764g的檸檬酸三鈉,溶解后,定容到1L的容量瓶中。洗脫液:2mol/LNaCl溶液。TSBYE培養基:胰蛋白胨17.0g、酵母浸粉6.0g、大豆胨3.0g、葡萄糖2.5g、氯化鈉5.0g、磷酸氫二鉀2.5g、水1L,pH6.5,121℃滅菌20min,固體培養基則加入1.5%的瓊脂。液體脫脂乳培養基:脫脂乳110g、去離子水1L,水加溫至脫脂乳完全溶解,分裝至玻璃試管中,10mL/管,115℃高壓滅菌20min。NAES緩沖液:100mL體系:取1.67mL的3M乙酸鈉,2mL0.5M的EDTA母液(0.5M),稱取1g的SDS溶解后定容至100mL。高壓滅菌。制備例1本制備例用于說明本發明的多肽的制備方法委托北京恒宇視野生物技術有限公司合成本發明SEQIDNO:1(KYYGNGVTCGKHSCSVDWGKATTCIINNGAMAWATGGHQGNHKC)所示的多肽。制備例2本制備例用于說明本發明的植物乳桿菌的胞外代謝產物的制備方法(1)按照201410816266.3專利申請中的方法對保藏號為CGMCCNo.6936的植物乳桿菌植物亞種(Lactobacillusplantarumsubsp.plantarum)Zhang-LL菌株擴大培養24h。(2)取發酵液于4℃,8000rpm低溫離心30min得到發酵上清液,將所述發酵上清液放置于4℃,并置于磁力攪拌器上,邊攪拌邊緩緩加入硫酸銨粉末,使硫酸銨的最終飽和度為70%。4℃冰箱沉淀過夜后,8000rpm離心30min,將沉淀懸浮于體積為發酵上清液體積的1/10去離子水中。并4℃,8000rpm離心30min除去殘留的不溶物。(3)對(2)步得到的沉淀物水溶液進行透析,透析袋的截留分子量為3500Da,將透析袋于溫水(50-60℃)中浸泡30min。在透析袋的一端打兩個死結,將溶液移入透析袋內,于4℃下去離子水中用磁力攪拌器緩慢攪拌(100rpm),過夜透析。(4)將透析液采用陽離子交換層析法(所使用的陽離子交換層析柱購自美國GEHealthcare,貨號SP-SepharoseFF,基質6%瓊脂糖微球,配體-O-CH2CHOHCH2OCH2CH2CH2SO3-)進行進一步純化步驟(3)得到的透析產物:用無菌注射器吸取步驟(3)中得到的透析產物3mL,將轉換接頭入口管接入樣品液中。用30mL平衡緩沖液將樣品沖洗到陽離子交換層析柱,然后加入洗脫液進行洗脫,每3min收集一管,洗脫過程中同時檢測蛋白質濃度即紫外吸收值A280nm,洗脫程序為:等梯度洗脫:0-100%洗脫液;洗脫時間:30min-130min;流速:1mL/min。(5)將所得到的(4)中紫外吸收值A280nm出現峰圖值的樣液收集并進行C18柱(購自安捷倫Bondelutc18ewp)萃取,萃取的過程為:先使用3mL甲醇、3mL水活化柱子,然后加入3mL樣品,之后用6mL超純水淋洗將樣品沖到C18柱,最后采用6mL70%乙腈收取樣液濃縮。(6)用真空低溫濃縮儀在50℃下將(5)中收集的樣液濃縮至乙腈揮發完全,采用透析前體積1/10的無菌水復溶,得到植物乳桿菌的胞外代謝產物,-20℃保存備用,使用前細菌素需調pH6.5,經0.22μm無菌濾器過濾。(7)將鑒定得到的細菌素純化液中含有氨基酸序列如SEQIDNO:1所示的多肽。制備例3本制備例用于說明本發明的植物乳桿菌的胞外代謝產物的制備方法按照實施例2的方法進行植物乳桿菌的胞外代謝產物的制備,不同的是,所使用的植物乳桿菌植物亞種CICC(購自中國工業微生物菌種保藏管理中心)。制備例4本制備例用于說明本發明的植物乳桿菌的胞外代謝產物的制備方法按照實施例2的方法進行植物乳桿菌的胞外代謝產物的制備,不同的是,不進行后續透析、離子交換層析以及萃取的步驟。測試例1(1)挑取新鮮培養的保藏號為CGMCCNo.6936的植物乳桿菌植物亞種(Lactobacillusplantarumsubsp.plantarum)Zhang-LL的單菌落,接種于5mLMRS液體養基中,37℃180rpm培養12h。(2)將上述(1)中培養好的菌液以12000rpm、4℃離心收集菌體,復溶到等體積的生理鹽水中,以102cfu/mL初始接種濃度接種于液體脫脂乳培養基中,接種后分為5組,每組3個平行。其中四組分別加入調節pH并過濾滅菌后的制備例1中的多肽,以及制備例2-4中的植物乳桿菌的胞外代謝產物,其中,相對于每mL的液體脫脂乳培養基,多肽的加入量為4微克,植物乳桿菌的胞外代謝產物的加入量為50μL,在菌體剛進入對數期時加入。其中1組不加入任何物質,作為空白對照。將處理后的各組于37℃,180rpm培養36h檢測培養物細菌素。(3)細菌素檢測分別收集如上5組中的培養基的培養物,4℃,12000rpm離心10min,取上清液用0.22μm無菌濾膜過濾,取100μL,以單核細胞增生李斯特菌(ATCC54003)為指示菌。挑取指示菌單菌落于TSBYE培養基,37℃培養12h。將指示菌菌株稀釋至107cfu/mL,與加熱融化的TSBYE固體培養基混勻后,傾注約15mL于平皿中。仍分為5組,每組3個平行。待培養基凝固后,輕輕放上已滅菌的牛津杯,分別取各組過濾后的上清100μL加入牛津杯中。于4℃冰箱擴散4h后,置于37℃溫箱中培養12h,觀察抑菌圈的出現,使用制備例1和2以及空白對照誘導的植物乳桿菌脫脂乳培養上清液的抑菌結果見圖1。由圖1可知,添加本發明的多肽(圖1B)和植物乳桿菌的胞外代謝產物培養基培養物的上清液(圖1A)對指示菌單核細胞增生李斯特菌(ATCC54003)具有明顯的抑菌作用,而對照的不添加任何外源物質的液體脫脂乳培養基培養物的上清不產生抑菌效果(圖1C)。說明添加了植物乳桿菌的胞外代謝產物誘導了不產細菌素的液體脫脂乳培養基培養物產生了細菌素。另外,經制備例3-4所制備的植物乳桿菌的胞外代謝產物誘導后的CGMCCNo.6936的上清液也表現出了明顯的抑制指示菌單核細胞增生李斯特菌(ATCC54003)的作用,但制備例3-4的作用效果明顯低于制備例1的多肽以及制備例2的植物乳桿菌的胞外代謝產物。(3)單核細胞增生李斯特菌(ATCC54003)生長曲線的測定配制液體TSBYE培養基,分為5組,每組3個平行,分別加入1體積%的步驟(3)所述的上清,同時,以1體積%的接種量將單核細胞增生李斯特菌(ATCC54003)接種至TSBYE液體培養基中,37℃培養24h,其中,每隔2小時測定一次培養液的OD600值,并繪制單核細胞增生李斯特菌(ATCC54003)的生長曲線。其中,使用制備例1和2以及空白對照誘導的植物乳桿菌脫脂乳培養上清液的單核細胞增生李斯特菌(ATCC54003)的生長曲線見圖2。由圖2可知,添加本發明的多肽和植物乳桿菌的胞外代謝產物培養基培養物的上清液對指示菌單核細胞增生李斯特菌(ATCC54003)具有明顯的抑菌作用,而對照的不添加任何外源物質的液體脫脂乳培養基培養物的上清不產生抑菌效果。說明添加了植物乳桿菌的胞外代謝產物誘導了不產細菌素的液體脫脂乳培養基培養物產生了細菌素。另外,經制備例3-4所制備的植物乳桿菌的胞外代謝產物誘導后的CGMCCNo.6936的上清液也表現出了明顯的抑制指示菌單核細胞增生李斯特菌(ATCC54003)的作用,但制備例3-4的作用效果明顯低于制備例1的多肽以及制備例2的植物乳桿菌的胞外代謝產物。測試例2按照測試例1的方法制備例3制備的植物乳桿菌的胞外代謝產物誘導植物乳桿菌產生細菌素的檢測,不同的是,所采用的實驗菌株為物乳桿菌植物亞種CICC(購自中國工業微生物菌種保藏管理中心)。結果顯示,制備例3制備的植物乳桿菌的胞外代謝產物所誘導的植物乳桿菌植物亞種CICC的上清液的抑菌效果與其誘導的植物乳桿菌植物亞種CGMCCNo.6936的上清液的抑菌效果沒有顯著性的差異。測試例3相關基因表達水平檢測1、液體脫脂乳培養基培養物RNA的提取及反轉錄(1)將新鮮的經制備例2的植物乳桿菌的胞外代謝產物誘導的液體脫脂乳培養基培養物(A組)的菌液以及未加入誘導物質的液體脫脂乳培養基培養物(B組)(培養條件同測試例1)分別進行離心收集菌體。收集過程如下:按菌液:1%EDTA(pH為12)為1:1的比例混勻后4℃,12000rpm離心7min,以去除脫脂乳中多余的蛋白成分。離心后棄上清用1mL的PBS(pH7.4)洗滌菌體,離心后棄上清,留菌體進行后續實驗。(2)將菌體重懸于500μL的NAES緩沖液中,并加入500μL的酸性苯酚(水飽和酚):氯仿(5:1)。(3)將該體系轉移至均質管(裝有0.3g的0.1mm玻璃珠)中,beadbeater振蕩30s,冰浴2min后,12000rpm,4℃離心5min。(4)取450μL上層水相于新離心管中,加入520μL異丙醇,輕輕搖勻,再加入35μL3M乙酸鈉,輕輕搖勻,12000g,4℃離心5min,棄盡上清。(5)加入1mL70體積%的乙醇,反復吹打沉淀,4℃,12000rpm離心5min,吸盡上清,用50μL0.1%DEPC(焦碳酸二乙酯)水溶解,待檢測。(6)取3μL樣品進行電泳進行電泳檢測,證明RNA提取成功。(7)DnaseⅠ處理:提取的核酸樣品12μL、DnaseI1.5μL、DnaseI+MgCl2buffer1.5μL,37℃反應30min;加入1.5μLEDTA液,65℃處理10min得到RNA樣品,并立即逆轉錄。(8)逆轉錄:參照試劑盒(Takara貨號6110A)說明書中的方法進行處理,得到逆轉錄樣品。2、實時定量PCR測定表達量以逆轉錄樣品為模板,16srDNA為內參基因,測定植物乳桿菌植物亞種(Lactobacillusplantarumsubsp.plantarum)Zhang-LL基因中與細菌素產生相關的基因:papA、papB、papC、papD的基因表達變化,基因相對表達量的變化采用2-ΔΔCt的計算方法。相關基因的引物序列:基因標號引物序列5'-3'反應條件如下:滅菌的去離子水7.6μl上游引物(10μM)0.5μl下游引物(10μM)0.5μlROX-II0.4μlSYBRPremixExTaq10μl模板1μl反應參數,95℃30s,然后進行下列循環:95℃變性10s,60℃退火30s,72℃延伸30s,共進行40個循環,檢測溶解曲線,結束反應。按照公式2-ΔΔCt計算基因相對表達量的變化,得到結果見圖3。從結果可以得出,相比于為添加誘導物質的Zhang-LL,添加了制備例2的植物乳桿菌的胞外代謝產物后,Zhang-LL基因中的papA、papB、papC、papD四個與細菌素產生相關的基因的表達水平分別上調了9.41倍,6.75倍,7.94倍及6.63倍。說明添加細菌素純化液誘導了植物乳桿菌植物亞種Zhang-LL菌株基因中相關基因的表達。以上詳細描述了本發明的優選實施方式,但是,本發明并不限于上述實施方式中的具體細節,在本發明的技術構思范圍內,可以對本發明的技術方案進行多種簡單變型,這些簡單變型均屬于本發明的保護范圍。另外需要說明的是,在上述具體實施方式中所描述的各個具體技術特征,在不矛盾的情況下,可以通過任何合適的方式進行組合。為了避免不必要的重復,本發明對各種可能的組合方式不再另行說明。此外,本發明的各種不同的實施方式之間也可以進行任意組合,只要其不違背本發明的思想,其同樣應當視為本發明所公開的內容。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1