整合素胞內多肽序列在抑制新生血管形成中的應用的制作方法
本發明涉及三種基于整合素β亞基胞內保守序列的多肽化合物及其效應分子能夠有效地在體內體外阻斷新生血管形成并具有抑制小鼠皮下實體瘤生長的作用。
背景技術:
整合素是位于細胞表面的一類重要的細胞黏附分子,由α和β兩個亞基通過非共價鍵連接而成的跨模異二聚體糖蛋白受體。整合素在人體內分布廣泛,幾乎所有不同組織的細胞上都表達有一種或幾種整合素分子。在脊椎動物中,目前發現有18個α及8個β亞基,α亞基和β亞基的不同組合共形成24個α/β整合素異二聚體。整合素與腫瘤的發生、發展密切相關,其通過調節內皮細胞的分化、黏附、遷移及存活,參與新生血管的形成和血管網絡的構建。腫瘤血管生成離不開血管內皮細胞與細胞外基質黏附,并借此侵入血管周圍間質,然后通過細胞-細胞的黏附作用促進血管條索的形成。作為內皮細胞和細胞外基質(ecm)連接的橋梁,血管內皮細胞中的整合素在腫瘤新生血管形成中起重要的作用。
整合素αvβ3是目前研究較為深入的整合素家族成員,并參與腫瘤新生血管形成。其在休眠的內皮細胞中低表達,但在多種腫瘤細胞及腫瘤新生血管內皮細胞中表達量明顯增加。研究顯示,通過胞外抑制αvβ3的功能,可誘導新生血管內皮細胞凋亡,抑制腫瘤新生血管的形成,促使腫瘤細胞凋亡,達到抗腫瘤的目的,而這個過程并不會對正常組織的血管造成不良影響。因此,整合素αvβ3成為理想的抑制腫瘤及腫瘤血管生成的靶點。
以阻斷整合素與其胞外配基結合為靶點的抗腫瘤新生血管形成藥物主要分為以下幾類:(1)整合素抗體類藥物;(2)含有與整合素有高親和力結合序列的多肽類小分子化合物,其中以含rgd序列(精氨酸-甘氨酸-天冬氨酸)的小分子多肽最為典型;(3)整合素為靶點的其他類藥物等。其中一部分藥物已顯露出良好的抗血管新生和抗腫瘤作用,并已進入臨床研究關鍵階段(例如,抗體類vitaxin[1,2],多肽類cilengitide[3-5])。
通過阻斷整合素信號通路抑制腫瘤的發生發展,因研究領域內一些不一致的研究數據,尚存爭議。例如,β3型整合素缺失的小鼠反而促進體內腫瘤的生長[6];還有,低濃度的整合素抑制劑rgd擬肽cilengitide對小鼠體內血管新生和腫瘤生長反而具有促進作用[7,8]。另外,來自于emd/merck公司研究開發的cilengitide是基于阻斷整合素αvβ3和αvβ5胞外配體結合位點開發的新型治療惡性膠質瘤的藥物,但經大規模臨床試驗后并未達到預期效果[9]。這些發現增加了以整合素-配基結合為靶點藥物的功能不確定性。
整合素可介導雙向信號傳導,并且整合素與胞外配基的結合受到整合素胞內序列的精確調控。整合素α/β亞基胞內序列較短(除β4外),自身也不具有酶活性,但其在整合素雙向信號傳導中起著重要作用,尤其是β亞基(β4和β8除外)胞內的保守序列,如兩個nxxy/f區域[10],它們可分別識別結合多種胞內信號和細胞骨架蛋白分子。比如,talin可與β亞基胞內段近膜區npxy序列結合,是整合素激活的關鍵調控因子;另外kindlin蛋白家族分子可與整合素β亞基胞內區遠膜端nxxy/f相互結合,并協同talin誘導整合素的激活[11-13]。此外,研究還發現整合素β3亞基胞內遠膜端nxxy序列(nity)還能夠識別結合β3-endonexin。
kindlin家族包含3個家族成員,分別是kindlin-1,kindlin-2和kindlin-3。它們在激活整合素中發揮重要作用,在不同的細胞中參與整合素介導的細胞遷移、黏附等多項生物學功能。kindlin蛋白表達異常還可以導致多種遺傳疾病的發生,在相關人類疾病和試驗小鼠模型中都得到驗證[14]。β3-endonexin是一個含111個氨基酸的多肽,已知是β3型整合素胞內序列的結合因子,但并不與β1、β2型整合素胞內序列結合[15,16]。目前,β3-endonexin是否參與β3型整合素的激活調控尚不明確。kindlin與β3-endonexin均在血管內皮細胞中表達[17-21]。
我們的前期研究發現kindlin-2參與整合素αvβ3介導的血管內皮細胞的粘附與遷移,并且在斑馬魚與小鼠體中具有促進新生血管形成的功能[17,20]。有一項研究表明,低氧條件下β3-endonexin通過hif途徑起到抑制血管新生的作用,過量表達β3-endonexin可降低低氧誘導的hif-1αmrna水平,抑制了hif的激活,進而抑制內皮細胞形成新生血管的過程[22]。因為kindlin-2與β3-endonexin都參與調控血管新生且均與β整合素c末端nxxy序列結合,所以我們推測包含整合素β胞內段c末端nxxy序列的多肽化合物可能具有調控新生血管形成的功能。據此,我們設計了6種含有不同整合素β亞基胞內保守序列的衍生穿膜多肽化合物(mβctps),每一種都包含一個整合素β亞基c末端的nxxy/f序列,并評估了其在體內和體外抗血管形成的能力,最終發現了有些整合素β亞基胞內功能序列可通過與β3-endonexin相互作用而抑制新生血管形成,從而揭示了開發新一代抗新生血管形成的新型靶位點。
技術實現要素:
本發明的目的之一在于提供了基于整合素β亞基胞內保守區域的功能多肽化合物氨基酸序列。
本發明的目的之二在于提供多肽衍生化合物(mβ3ctp,mβ5ctp,mβ6ctp)能夠抑制體外人臍靜脈內皮細胞形成血管狀結構;抑制裸鼠皮下接種基質膠中血管的生成;并對裸鼠皮下接種實體瘤的生長有不同程度的抑制作用。并且,功能試驗揭示這些具有抗新生血管形成功能的整合素β亞基胞內段序列可通過結合效應蛋白因子β3-endonexin而發揮作用。
為闡明上述目的,本發明采用如下技術方案:
三種基于整合素β亞基胞內保守序列的多肽化合物,其特征在于該多肽化合物為有seqidno:1、seqidno:2或seqidno:3所示的氨基酸序列。
上述的基于整合素β亞基胞內保守序列的多肽化合物在制備抗新生血管形成藥物中的應用。
上述的基于整合素β亞基胞內保守序列的多肽化合物在制備抗腫瘤藥物中的應用。
本發明的這三種小分子多肽化合物可以通過結合共同的效應信號蛋白分子來阻斷新生血管的形成。其在偶聯具有穿膜功能多肽后具有抑制實驗小鼠體內實體腫瘤生長的作用,屬于生物醫學領域。本發明基于功能小分子多肽化合物及其效應蛋白分子能夠抑制體外人臍靜脈內皮細胞形成血管狀結構,抑制裸鼠皮下接種基質膠中血管的生成,和抑制裸鼠皮下接種實體瘤的生長。我們的研究發現不僅提供了多種具有阻抗新生血管形成作用的先導化合物,而且還揭示了一個調控新生血管形成的新機制,從而為開發新一代抗新生血管形成和抗腫瘤藥物提供新的靶位點。
附圖說明
圖1為本發明中小分子多肽化合物mβctp系列的氨基酸序列和組成以及mβctp系列選擇性地抑制臍靜脈血管內皮細胞(huvec)體外形成血管樣小管效果對比圖。(a)mβctp由兩部分組成:一是穿膜多肽(cpp),為具有11個氨基酸的序列,可以介導與之偶聯的目的多肽分子進入細胞內;二是目的多肽(βctp),為來自不同整合素β亞基胞內保守序列的多肽,其自身不具有穿膜功能。因此,mβctp系列多肽是穿膜多肽與目的多肽的偶聯復合物,可穿越細胞膜進入細胞內發揮功能。(b)被fitc熒光標記后的mβ3ctp與huvec孵育后可檢測到其具有穿膜的能力。(c-d)檢測mβctp系列多肽抑制臍靜脈血管內皮細胞(huvec)體外形成血管樣小管的能力。
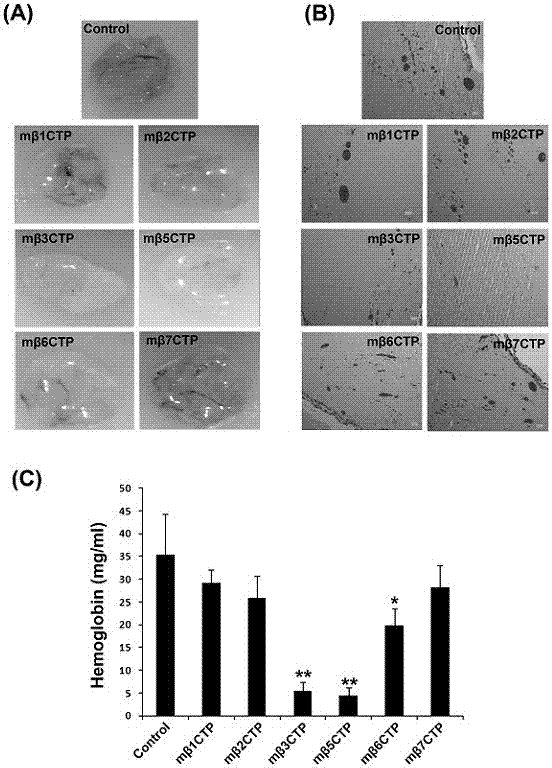
圖2為本發明中小分子多肽化合物mβctp系列抑制皮下種植基質膠(matrigel)團塊中血管形成的能力。(a)不同mβctp分別與液態基質膠混合后注射到小鼠皮下,基質膠在小鼠體內迅速固化并誘導新生血管的形成。7天后取出固態基質膠塊觀察血管形成的情況。(b)組織化學染色(he)觀察基質膠內形成的血管。(c)測定基質膠內的血紅蛋白量。
圖3為本發明中小分子多肽化合物mβctp抑制裸鼠皮下實體瘤的生長及免疫組織化學分析腫瘤內血管分布情況。(a)小鼠皮下植瘤后分別用不同的mβctp處理并觀察其對腫瘤生長的影響。(b-c)取出小鼠內瘤體并進行組化觀察(cd31+)瘤內血管的形成情況和數量。
圖4為本發明中鑒定mβ3ctp中目的多肽(β3ctp)的功能核心序列。(a)從β3ctp兩端分別進行氨基酸序列的刪減,構建含有不同氨基酸序列的mβ3ctp衍生多肽化合物。(b-c)huvec細胞種植在已鋪好基質膠的24孔板中,并與(a)中所示多種mβ3ctp衍生多肽化合物(20μm)共孵育后觀察形成血管管道樣結構的能力。
圖5為本發明中整合素β亞基胞內序列以及功能mβctp多肽化合物與β3-endonexin和kindlin-2相互作用的情況。(a)利用純化的帶有gst標簽的整合素β亞基胞內序列與表達有外源egfp-β3-endonexin和內源kindlin-2的huvec細胞裂解液孵育,并測定不同β亞基胞內序列與egfp-β3-endonexin和kindlin-2的結合能力。(b)利用酵母雙雜交系統測定不同整合素β亞基胞內序列與β3-endonexin和kindlin-2的結合能力。(c)利用競爭抑制實驗測定功能mβ3ctp和mβ5ctp與β3-endonexin的直接結合作用。
圖6為本發明中β3-endonexin調控臍靜脈內皮細胞血管管道樣結構形成并且促進小鼠皮下實體腫瘤生長的情況。(a-c)利用兩種特異性sirna分別下調huvec中內源性β3-endonexin的表達并檢測其對huvec形成血管樣小管結構的影響。(d-f)利用慢病毒表達系統上調huvec中β3-endonexin的表達并檢測其對huvec形成血管樣小管結構的影響。(g-h)分別用可表達egfp-β3-endonexin和對照egfp的慢病毒局部注射小鼠體內腫瘤并觀察其對小鼠體內腫瘤生長的影響。
具體實施方式
實施例一:合成并純化mβctp系列多肽分子
含有目標多肽的mβctp系列衍生多肽分子命名和氨基酸序列參見圖1(a)。該系列多肽合成于公司,采用手動固相fmoc法,以fmoc-gly-wang樹脂為起始原料,從c端向n端方向合成。純化采用hp1100型(美國安捷倫公司)反相高效液相色譜儀,其純度達99.62%。該方法為小分子多肽常規合成方法。
實施例二:臍靜脈血管內皮細胞(huvec)血管樣管道形成實驗研究mβctp系列多肽對新生血管形成的作用:
參見圖1,體外培養的人臍靜脈血管內皮細胞(huvec)在含生長因子的基底膜基質膠上能自行組裝成類似血管的管道樣結構。在細胞培養液中加入不同的mβctp(終濃度20μm),觀察其抑制huvec細胞組裝管道的能力。參見圖1(c-d),結果顯示,與無藥處理組相比較,添加衍生多肽mβ3ctp、mβ5ctp、mβ6ctp能夠有效地抑制管道的形成,說明這些多肽對huvec細胞體外形成血管樣管道結構有顯著的抑制作用。同時該實驗結果也說明該抑制功能來自相應的整合素β胞內序列(βctp)而不是所偶聯的穿膜多肽(cpp),因為同樣具有cpp序列的mβ1ctp、mβ2ctp、mβ7ctp對huvec細胞形成管道樣結構并無明顯影響。同時,沒有偶聯穿膜多肽的βctp并不具有抑制功能,說明它們是在細胞內發揮作用的。
圖1:mβctp系列多肽選擇性地抑制臍靜脈內皮細胞(huvec)血管管道樣結構的形成。(a)mβctp系列多肽包含兩部分:一是穿膜多肽(cpp);二是目標多肽,包含整合素β亞基胞內含c末端nxxy/f的序列(βctp)。βctp自身不具有穿膜能力,其與穿膜多肽cpp偶聯后可穿越細胞膜進入細胞內發揮功能。(b)n端標記熒光素fitc的mβ3ctp與huvec共孵育,其穿膜特性通過熒光顯微鏡觀察。(c)huvec鋪在基質膠上,分別添加mβctp系列多肽藥物(20μm);不添加組為對照。孵育12h后倒置顯微鏡下觀察(5倍物鏡)血管管道樣結構的形成情況。(d)對形成管道樣結構的數目進行統計,統計結果以均值±標準差(mean±sd)表示,實驗獨立樣本均值采用獨立樣本t檢驗,p﹤0.01(**)說明數據在統計學分析中有顯著差異。
實施例三:小鼠體內基底膜基質中血管形成實驗:
參見圖2,實驗材料為裸鼠(balb/c),6周齡,雄性(每組7只裸鼠),基底膜基質膠(matrigel)。先將基底膜基質膠放在冰上融化為液態后,加入600ng/mlbfgf和100u/mlheparin以及不同的mβctp多肽(50μm)。然后在裸鼠皮下注射500μl的基底膜基質膠混合物。基底膜基質膠進入小鼠體內迅速固態化并誘導新生血管的生長,歷時7天后,將固態matrigel塊小心從小鼠皮下剝離取出,測定基底膜基質膠中血紅蛋白的含量;同時對固定后的基底膜基質膠進行組織化學分析(he染色)。結果發現相同重量的基質中,mβ3ctp、mβ5ctp、mβ6ctp處理組相對于無藥對照組所含血紅蛋白含量明顯降低。并且,mβ3ctp和mβ5ctp處理組的新生血管數量比無藥處理的對照組顯著減少。同時該實驗結果也說明具有抑制功能的mβctp多肽中的效應序列來自相應的整合素β胞內序列(βctp)而不是所偶聯的穿膜多肽(cpp),因為同樣具有cpp序列的mβ1ctp、mβ2ctp、mβ7ctp對基質膠內血管的形成無明顯影響。
圖2:小鼠皮下種植基質膠實驗檢測mβctp系列多肽化合物抑制血管形成的能力。(a)裸鼠皮下注射基質膠matrigel(500μl)(含600ng/mlbfgf和100u/mlheparin),并同時添加mβctp(50μm)系列多肽藥物;不加藥組作為對照。膠塊于7天后小心取出并拍照。(b)固定后的基質膠matrigel石蠟包埋后經he染色并顯微觀察。染深紅色部分為血管(紅細胞),淺粉色背景為基質膠matrigel染色。(c)matrigel樣品中血紅蛋白總含量的測定,統計結果以均值±標準差(mean±sd)表示,實驗獨立樣本均值采用獨立樣本t檢驗,p﹤0.05(*)或p﹤0.01(**)說明數據在統計學分析中有顯著差異。
實施例四:功能mβctp多肽對小鼠實體瘤生長的作用:
參見圖3(a),實驗材料為裸鼠(balb/c),6周齡,雄性,隨機分成2組,對照組以及mβctp治療組(每組6只)。每只皮下注射小鼠前列腺癌細胞rm1(1.2x106/只),并添加1%基質膠。荷瘤5天后,治療組隔天皮下局部注射功能mβctp(50μm;100μlpbs溶液);對照組皮下注射等量pbs緩沖液,同時測量小鼠腫瘤大小(v)(v=l×w×0.52;其中l為腫瘤測量長度,w為腫瘤測量寬度)。由圖3(a)可以看出,相對于對照組,mβ3ctp、mβ5ctp處理組的腫瘤體積明顯較小;而mβ6ctp處理組對腫瘤的生長無明顯影響。這種區別可能是因為目的多肽與其胞內效應蛋白分子的結合強弱造成的(見后面實例)。
圖3(a):mβ3ctp,mβ5ctp及mβ6ctp抑制裸鼠體內腫瘤生長的情況。(a)裸鼠皮下注射rm1細胞,隔天皮下局部分別給藥mβ3ctp、mβ5ctp以及mβ6ctp(50μm);不加藥組作為對照。記錄腫瘤長(l)與寬(w),并計算體積v(v=l*w*w*0.52)并繪制腫瘤生長曲線。統計結果以均值±標準差(mean±sd)表示,實驗獨立樣本均值采用獨立樣本t檢驗,p﹤0.01(**)說明數據在統計學分析中有顯著差異。
實施例五:利用免疫組織化學分析腫瘤組樣,研究mβctp對實體瘤內血管的形成的影響:
參見圖3(b-c),小鼠前列腺癌rm-1細胞接種裸鼠,經不同治療后20天后取出形成的腫瘤,經pbs清洗,中性甲醛固定,然后制做石蠟切片并進行cd31免疫組化檢測。處理后的組樣用顯微觀察各組樣本血管腔形成情況。無藥物處理的對照組腫瘤組織內有明顯的血管生成,并且多數已經形成完整的血管管道樣結構;雖然mβ3ctp和mβ5ctp(圖3,b)給藥組的腫瘤組織經免疫組化有cd31陽性細胞,但形成的血管數目明顯減少,且形成的血管管道不規整,其血管大小及形態與對照組相比有顯著差異。該實驗結果證明mβ3ctp和mβ5ctp對腫瘤內新生血管的形成有著顯著的抑制作用,具有抑制固體腫瘤生長的作用。相比較而言,mβ6ctp對腫瘤內血管形成的抑制作用較弱。
圖3(b-c):mβ3ctp,mβ5ctp及mβ6ctp抑制裸鼠體內腫瘤血管形成的情況。(b)裸鼠皮下注射rm1細胞,隔天皮下局部分別給藥mβ3ctp、mβ5ctp以及mβ6ctp(50μm);不加藥組作為對照。實體瘤取出后組化切片并進行cd31免疫染色(褐色部分)(c)各組腫瘤組織內形成的血管數量統計,統計結果以均值±標準差(mean±sd)表示,實驗獨立樣本均值采用獨立樣本t檢驗,p﹤0.01(**)說明數據在統計學分析中有顯著差異。
實施例六:鑒定mβ3ctp目的多肽中的核心功能序列:
參見圖4,對功能多肽mβ3ctp中來自整合素β3胞內序列的目標多肽(βctp)中的氨基酸的序列分別從n-端和c-端進行截短并合成相應的衍生多肽見圖4(a),然后用臍靜脈血管內皮細胞(huvec)血管樣管道形成實驗來驗證這些衍生多肽抗新生血管形成的能力。結果顯示,mβ3ctp目標多肽中的nity序列及其n-端的至少2個氨基酸殘基形成功能核心序列。
圖-4:mβ3ctp中目的多肽內功能核心序列的鑒定。(a)從β3ctp兩端分別進行氨基酸序列的刪減,構建含有不同氨基酸序列的mβ3ctp衍生多肽化合物。(b-c)huvec細胞種植在已鋪好基質膠的24孔板中,并與(a)中所示多種mβ3ctp衍生多肽化合物(20μm)共孵育;不添加多肽組為對照。倒置顯微鏡下觀察(5倍物鏡)拍照,并對形成的管道樣結構進行統計,統計結果以均值±標準差(mean±sd)表示,實驗獨立樣本均值采用獨立樣本t檢驗,p﹤0.01(**)說明數據在統計學分析中有顯著差異。
實施例七:利用pulldown試驗和酵母雙雜交實驗研究整合素β亞基胞內序列以及功能mβctp多肽與β3-endonexin和kindin-2結合的情況:
參見圖5,首先,用pulldown鑒定整合素β亞基的胞內序列與β3-endonexin和kindin-2的相互作用。huvec細胞表達的外源efgp-β3-endonexin及內源kindlin-2分別與結合在介質上gst融合的整合素β亞基的胞內序列孵育。洗脫掉非特異性結合蛋白后,用westernblot實驗鑒定結合上去的efgp-β3-endonexin及kindlin-2。圖5(a)中結果顯示,β3-endonexin與整合素β3,β5和β6的胞內多肽序列結合,但其中與β6的胞內多肽序列結合較弱。相比較,另一個胞內整合素結合蛋白kindlin-2與β1,β3和β7的胞內多肽序列結合。由此,β3-endonexin和kindlin-2結合整合素β亞基的胞內序列具有不同的選擇性。然后,用酵母雙雜交系統(matchermarkertmgold)進一步鑒定整合素β亞基的胞內序列與β3-endonexin及kindlin-2的相互作用。β3-endonexin及kindlin-2克隆在pgbdt7載體上,構建bd(dna結合結構域)融合蛋白;同時,β亞基的胞內段序列克隆在pgadt7載體上,構建ad(轉錄激活結構域)融合蛋白。如果兩種蛋白具有相互作用,就可以形成有功能的轉錄因子(ad-bd),并激活下游報告基因的轉錄,導致酵母菌株可以在選擇培養基(sd-3)上生長。如圖5b所示,酵母雙雜交的檢測結果與pulldown實驗結果一致。最后,我們用競爭實驗進一步驗證了mβ3ctp與mβ5ctp可與β3-endonexin特異性結合,見圖5(c)。這些實驗結果說明功能mβctp多肽對新生血管和腫瘤生長的抑制作用很可能是通過結合效應信號蛋白分子β3-endonexin來實現的。
圖-5:整合素β亞基的胞內段與β3-endonexin和kindin-2相互作用的檢測。(a)pulldown實驗:huvec細胞表達的efgp-β3-endonexin及kindlin-2分別與結合在介質上gst融合的整合素β亞基的胞內序列孵育。洗脫掉非特異性結合蛋白后,用westernblot實驗鑒定結合上去的efgp-β3-endonexin及kindlin-2。(b)酵母雙雜交系統(matchermarkertmgoldyeasttwo-hybridsystem)進一步鑒定整合素β亞基的胞內序列與β3-endonexin及kindlin-2的相互作用。β3-endonexin及kindlin-2克隆在pgbdt7載體上,構建bd(dna結合結構域)融合蛋白;同時,β亞基的胞內段序列克隆在pgadt7載體上,構建ad(轉錄激活結構域)融合蛋白。如果兩種蛋白具有相互作用,就可以形成有功能的轉錄因子(ad-bd),并激活下游報告基因的轉錄,導致酵母菌株可以在選擇培養基上(sd-3)生長。(c)mβ3ctp與mβ5ctp能夠與整合素β亞基的胞內段競爭結合efgp-β3-endonexin。huvec細胞表達的efgp-β3-endonexin與結合在介質上的gst融合的整合素β3亞基的胞內序列孵育,同時分別加入20μm的mβ3ctp與mβ5ctp。洗脫掉非特異性結合蛋白后,用westernblot實驗鑒定結合上去的efgp-β3-endonexin。
實施例八:β3-endonexin可調控huvec細胞血管管道樣結構的形成以及腫瘤的生長:
參見圖6,我們通過向huvec細胞轉染靶向β3-endonexin的sirna(001、002)來沉默內源性β3-endonexin的表達;同時用非靶向性sicontrol作為對照,結果顯示下調內源β3-endonexin表達后huvec形成血管樣結構的能力明顯變差(見圖6,a-c)。進而,我們用慢病毒表達系統在huvec細胞中過表達egfp-β3-endonexin,發現過表達egfp-β3-endonexin后huvec形成血管管道樣結構的能力明顯增強(見圖6,d-f)。最后,我們對小鼠皮下實體瘤分別注射含有可表達egfp-β3-endonexin和對照egfp的慢病毒,發現高表達egfp-β3-endonexin可顯著促進腫瘤的生長。這些實驗結果說明β3-endonexin很可能是一種新生血管形成和腫瘤生長的促進因子。結合前面mβctp的功能以及其與β3-endonexin的結合能力,我們推斷功能多肽mβctp的抗新生血管形成和抗腫瘤生長作用很可能是通過結合并阻斷β3-endonexin的功能來實現的。
圖-6:β3-endonexin可促進huvec細胞血管管道樣結構的形成和體內腫瘤生長。(a)huvec細胞轉染靶向β3-endonexin的sirna(001、002)來沉默內源性β3-endonexin的表達;同時用非靶向性sicontrol作為對照。轉染sirna后48h收集細胞,并通過qrt-pcr檢測huvec細胞中β3-endonexin的mrna表達水平。(b-c)轉染sirna后,收集huvec細胞進行血管管道樣結構形成實驗,并對形成管道樣結構的數目進行統計。(d)在huvec細胞中通過慢病毒系統感染表達外源egfp和egfp-β3-endonexin。48h后,收集感染后的huvec細胞,并通過westernblot實驗來檢測egfp表達水平。(e&f)表達egfp和egfp-β3-endonexin的huvec細胞形成血管管道樣結構,并統計管道數量。(g&h)實驗材料為裸鼠(balb/c),6周齡,雄性,隨機分成2組,每組5只,每只皮下注射小鼠前列腺癌細胞rm1(1.2x106/只)。從第5天起兩組分別注射分別表達egfp以及egfp-β3-endonexin的慢病毒(滴度=2x107iu/ml,一周注射2次,每次注射100μl/只)。15天后,取出腫瘤并測量。統計結果以均值±標準差(mean±sd)表示,實驗獨立樣本均值采用獨立樣本t檢驗,p﹤0.01(**)說明數據在統計學分析中有顯著差異。
參考文獻
1.posey,j.a.,etal.,apilottrialofvitaxin,ahumanizedanti-vitronectinreceptor(antialphavbeta3)antibodyinpatientswithmetastaticcancer.cancerbiotherradiopharm,2001.16(2):p.125-32.
2.mcneel,d.g.,etal.,phaseitrialofamonoclonalantibodyspecificforalphavbeta3integrin(medi-522)inpatientswithadvancedmalignancies,includinganassessmentofeffectontumorperfusion.clincancerres,2005.11(21):p.7851-60.
3.macdonald,t.j.,etal.,preferentialsusceptibilityofbraintumorstotheantiangiogeniceffectsofanalpha(v)integrinantagonist.neurosurgery,2001.48(1):p.151-157.
4.gilbert,m.r.,etal.,cilengitideinpatientswithrecurrentglioblastoma:theresultsofnabtc03-02,aphaseiitrialwithmeasuresoftreatmentdelivery.jneurooncol,2012.106(1):p.147-53.
5.smith,j.w.,cilengitidemerck.curropininvestigdrugs,2003.4(6):p.741-5.
6.hodivala-dilke,k.m.,etal.,á3-integrin-deficientmiceareamodelforglanzmannthrombastheniashowingplacentaldefectsandreducedsurvival.j.clin.invest.,1999.103(2):p.229-238.
7.alghisi,g.c.,l.ponsonnet,andc.ruegg,theintegrinantagonistcilengitideactivatesalphavbeta3,disruptsve-cadherinlocalizationatcelljunctionsandenhancespermeabilityinendothelialcells.plos.one.,2009.4(2):p.e4449.
8.reynolds,a.r.,etal.,stimulationoftumorgrowthandangiogenesisbylowconcentrationsofrgd-mimeticintegrininhibitors.nat.med.,2009.15(4):p.392-400.
9.stupp,r.,etal.,cilengitidecombinedwithstandardtreatmentforpatientswithnewlydiagnosedglioblastomaandmethylatedo6-methylgluanine-dnamethyltransferase(mgmt)genepromoter:keyresultsofthemulticenter,randomized,open-label,controlled,phaseiiicentricstudy.journalofclinicaloncology,2013.31:p.suppl;abstrlba2009.
10.bihari-varga,m.,etal.,interactionoflipoproteinlp(a)andlowdensitylipoproteinwithglycosaminoglycansfromhumanaorta.arteriosclerosis,1988.8:p.851-857.
11.tadokoro,s.,etal.,talinbindingtointegrinbetatails:afinalcommonstepinintegrinactivation.science,2003.302(5642):p.103-6.
12.shi,x.,etal.,themig-2/integrininteractionstrengthenscell-matrixadhesionandmodulatescellmotility.jbiolchem,2007.282(28):p.20455-66.
13.ma,y.q.,etal.,kindlin-2(mig-2):aco-activatorofbeta3integrins.jcellbiol,2008.181(3):p.439-46.
14.rognoni,e.,r.ruppert,andr.fassler,thekindlinfamily:functions,signalingpropertiesandimplicationsforhumandisease.jcellsci.,2016.129(1):p.17-27.
15.shattil,s.j.,etal.,beta3-endonexin,anovelpolypeptidethatinteractsspecificallywiththecytoplasmictailoftheintegrinbeta3subunit.jcellbiol.,1995.131(3):p.807-816.
16.eigenthaler,m.,etal.,aconservedsequencemotifintheintegrinbeta3cytoplasmicdomainisrequiredforitsspecificinteractionwithbeta3-endonexin.journalofbiologicalchemistry,1997.272(12):p.7693-7698.
17.ma,y.q.,etal.,kindlin-2(mig-2):aco-activatorofbeta3integrins.journalofcellbiology,2008.181(3):p.439-446.
18.kracun,d.,etal.,thebeta3-integrinbindingproteinbeta3-endonexinisanovelnegativeregulatorofhypoxia-induciblefactor-1.antioxid.redox.signal.,2014.20(13):p.1964-1976.
19.bialkowska,k.,etal.,theintegrincoactivatorkindlin-3isexpressedandfunctionalinanon-hematopoieticcell,theendothelialcell.jbiol.chem.,2010.285:p.18640-18649.
20.pluskota,e.,etal.,theintegrincoactivatorkindlin-2playsacriticalroleinangiogenesisinmiceandzebrafish.blood,2011.117(18):p.4978-4987.
21.besta,f.,etal.,roleofbeta(3)-endonexinintheregulationofnf-kappab-dependentexpressionofurokinase-typeplasminogenactivatorreceptor.journalofcellscience,2002.115(pt20):p.3879-3888.
22.besta,f.,etal.,roleofbeta(3)-endonexinintheregulationofnf-kappab-dependentexpressionofurokinase-typeplasminogenactivatorreceptor.jcellsci,2002.115(pt20):p.3879-88.
<110>上海大學
<120>整合素胞內多肽序列在抑制新生血管形成中的應用
<160>3
<210>1
<211>12
<212>多肽
<213>氨基酸序列
<400>1
atstftnityrg12
<210>2
<211>20
<212>多肽
<213>氨基酸序列
<400>2
pisthtvdftfnkfnksyng20
<210>3
<211>12
<212>多肽
<213>氨基酸序列
<400>3
ststfknvtykh12
- 還沒有人留言評論。精彩留言會獲得點贊!