一種同時檢測多種病原體的五重PCR檢測方法與流程
本發明涉及一種生物技術領域的PCR檢測方法,具體是一種能同時檢測金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體的五重PCR檢測方法。
背景技術:
現有的國家標準《實驗動物微生物學等級及監測》GB 14922.2-2011中對病原體的檢測方法——以傳統的分離培養、生化鑒定、血清型分析和特殊鑒定實驗為主。在臨床實踐中,金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體是實驗動物的常見重要病原體,且易混合感染。傳統的診斷技術如分離培養、免疫學試驗等費時費力,不適于臨床快速診斷,也不適于大規模的流行病學調查的現狀傳統方法存在過程繁瑣,費時,檢出率低和漏檢等缺陷。為了滿足大樣本的多種病原體的快速檢測,急需一種快速、簡便、準確率高的多重PCR檢測方法。
技術實現要素:
本發明的目的在于提供一種同時檢測多種病原體的五重PCR檢測方法,其步驟簡單,檢測快速,準確性高,易于標準化,克服了現有技術的不足。
本發明的構思是這樣的。隨著PCR的核酸檢定技術成功的在臨床醫學等領域的應用,建立多重PCR新技術檢測成為可能。多重PCR(multiplex Polymerase Chain Reaction)是在普通PCR的基礎上加以改進,一個PCR反應體系中加入多對特異性引物,針對多個DNA模板或同一模板的不同區域擴增出多個目的片段的PCR技術。其可在同一PCR反應體系中同時加入多種病原體的特異性引物,進行PCR擴增,可用于同時檢測多種病原體或不同型病原體。基于此,本發明本著一次性檢測就可以檢出樣品中五種病原體的目標,首先從已發表的文獻中篩選出具有金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體的保守性序列的基因,作為PCR檢測的靶點,分別合成擴增對應保守序列的特異性引物,將5對引物同時放在一個PCR反應體系中,通過各項優化,建立直接從樣本中一次性檢測五種病原體的五重PCR檢測方法。本發明還通過檢測糞便改進取材,進一步實現利用該五重PCR方法快速檢測實際樣品的目的。
具體的,本發明的一種同時檢測多種病原體的五重PCR檢測方法,包括以下步驟:
(1)篩選出具有金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體的保守性序列的基因,作為PCR檢測的靶點,分別合成擴增對應保守序列的特異性引物;
(2)將5對引物同時放在一個PCR反應體系中,擴增出目的基因片段;
(3)通過瓊脂糖凝膠電泳檢測鑒定PCR擴增產物;其中,擴增金黃色葡萄球菌上游引物的序列如表1a所示,下游引物的序列如表1b所示;擴增綠膿桿菌上游引物的序列如表1c所示,下游引物的序列如表1d所示;擴增肺支原體上游引物的序列如表1e所示,下游引物的序列如表1f所示;擴增多殺巴氏桿菌上游引物的序列如表1g所示,下游引物的序列如表1h所示;擴增支氣管敗血性波氏桿菌上游引物的序列如表1i所示,下游引物的序列如表1j所示。具體見表1。
表1:引物序列及PCR產物
本發明中,步驟(1),由于對引物的退火溫度,片段長度等要求,最終選定金黃色葡萄球菌的nuc基因、綠膿桿菌的LasI基因、多殺巴氏桿菌的KMT1基因、支氣管敗血性波氏桿菌的Fla基因和肺支原體的16S rRNA基因設計特異性引物。
本發明中,步驟(2),PCR反應體系為50μl,包括:Mix 25μl,引物7μl,金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體上下游引物各為1μl、1μl、0.5μl、0.5μl、0.5μl,DNA每種1μl DNA,其余無菌水補足;反應條件:94℃預變性5min;進入94℃30s,60℃30s,72℃30s的循環,共30個循環;72℃終延伸7min。
本發明中,步驟(3),PCR產物在2.5%瓊脂糖凝膠中,120V電泳30min。
本發明中,實際檢測樣品前先選擇人工摻病原體陽性標本驗證體系檢測能力,再取待檢測樣本糞便和氣管分泌物,提取被檢病原體的DNA,作為模板,進行五重PCR檢測,全過程僅需要4h;并且通過檢測糞便改進取材,進一步達到利用該五重PCR方法快速無創檢測無創實際樣品的目的。而常規的檢測方法需要培養基接種,一般需24h長出菌落,再生化接種,此過程時間較長,并且對檢測人員的技能要求高。本發明較常規方法縮短了檢測時間,能進一步達到快速檢測和檢測標準化的目的。
本發明取得如下有益效果:
(1)較常規的PCR檢測方法,本發明的五重PCR檢測方法具有快速、靈敏、簡便、準確的特點,同時降低了對檢測人員的要求、檢測平臺和檢測成本,提高了檢測效率。
(2)該方法體系通過檢測糞便改進取材,進一步達到利用該五重PCR方法快速無創檢測無創實際樣品的目的。
附圖說明
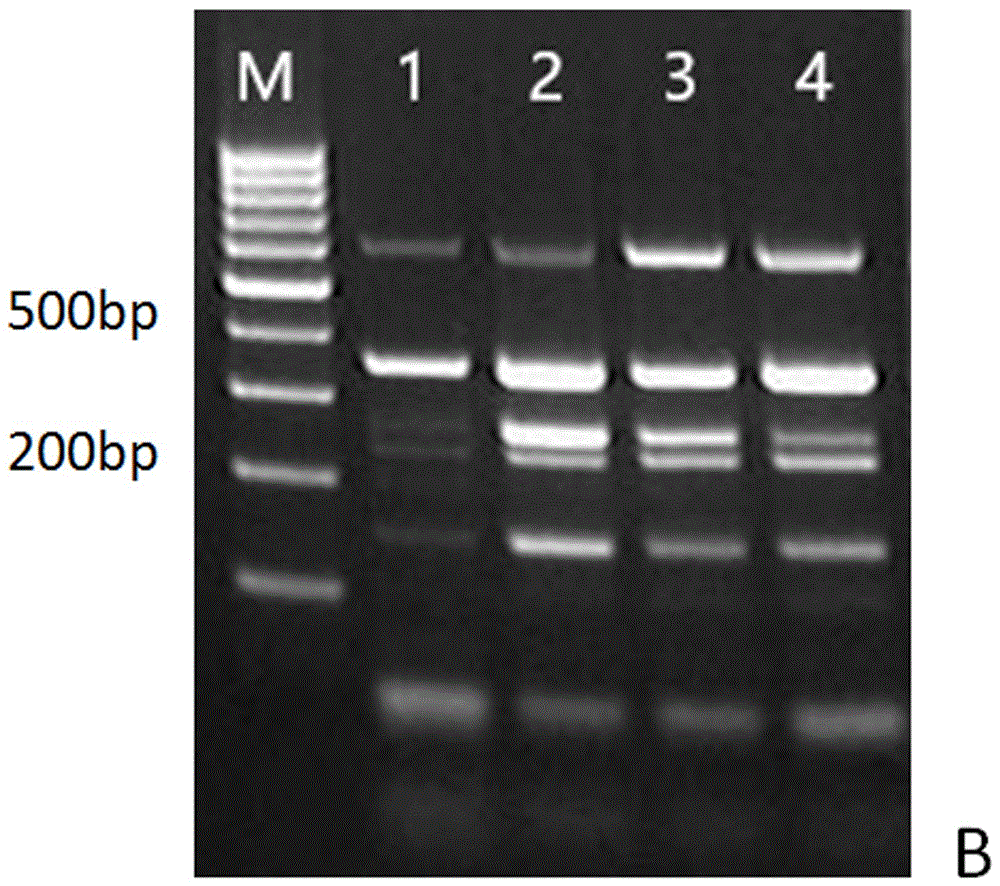
圖1是金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體的五重PCR體系引物濃度的優化結果;其中:M為100bp DNA Ladder;泳道1-4:多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體上下游引物各為1μl,0.5μl,0.25μl,0.125μl。
圖2是金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體的五重PCR體系退火溫度的優化結果;其中:M為100bp DNA Ladder;泳道1:56℃;泳道2:58℃;泳道3:60℃;泳道4:62℃。
圖3是金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體的五重PCR人工樣本的檢測結果;其中:M為100bp DNA Ladder;泳道1:五重PCR陽性對照;泳道2:五重PCR陰性對照;泳道3:糞便陰性對照;泳道4:金黃色葡萄球菌;泳道5:綠膿桿菌;泳道6:金黃色葡萄球菌和綠膿桿菌;泳道7:氣管分泌物陰性對照;泳道8:多殺巴氏桿菌;泳道9:支氣管敗血性波氏桿菌;泳道10:肺支原體;泳道11:多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體;泳道12:金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體。
圖4是金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體的五重PCR樣本的檢測結果;其中:M為100bp DNA Ladder;泳道1:五重PCR陽性對照;泳道2:五重PCR陰性對照;泳道3-17:樣本的糞便和氣管分泌物。
具體實施方式
本實施例在以本發明技術方案為前提下進行實施,給出了詳細的實施方式和過程,但本發明的保護范圍不限于下述的實施例。
實施例1 金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體的五重PCR體系退火溫度的優化
(1)樣品前處理
將標準的金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體分別在相應的培養基或培養液中培養,其中金黃色葡萄球菌、綠膿桿菌培養24h,多殺巴氏桿菌、支氣管敗血性波氏桿菌培養36h,肺支原體培養7d,收集菌液或菌落提取相應的DNA樣本。
(2)細菌DNA提取
本發明采用細菌基因組DNA提取試劑盒提取DNA,步驟如下:
①將上述5種病原體菌液或菌落溶于緩沖液GA,震蕩懸浮;
②加入20μl Proteinase K溶液,混勻,加入220μl緩沖液GB,震蕩15s,70℃10min,加入220μl無水乙醇,充分震蕩混勻;
③將溶液和沉淀都加入一個吸附柱中,12000rpm離心30s,棄廢液;
④向吸附柱加500μl緩沖液GD,12000rpm離心30s,棄廢液;
⑤向吸附柱加600μl緩沖液PW,12000rpm離心30s,棄廢液;重復一次;
⑥收集沉淀,30μl TE溶解。
(3)多重PCR反應體系建立
在PCR反應體系中,尤其是多重PCR反應體系中,引物濃度和退火溫度是關鍵的影響因素。本發明為了找到合適的五重PCR體系的引物濃度和退火溫度,進行如下實驗:
①引物濃度的優化:反應體系:金黃色葡萄球菌、綠膿桿菌上下游引物各為1μl,多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體上下游引物各為1μl、0.5μl、0.25μl、0.125μl,Mix 25μl,DNA每種1μl DNA,其余用無菌水補足至50μl;反應條件:94℃預變性5min;進入94℃30s,60℃30s,72℃30s的循環,共30個循環;72℃終延伸7min;PCR產物10μl在2.5%瓊脂糖凝膠中,120V電泳30min。結果如圖1顯示2泳道較好。
②退火溫度的優化:PCR反應體系為50μl,包括:Mix 25μl,引物7μl,金黃色葡萄球菌、綠膿桿菌上下游引物各為1μl,多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體上下游引物各為0.5μl,DNA每種1μl DNA,其余無菌水補足。反應條件僅將退火溫度分別設置為56℃,58℃,60℃,62℃,其余不變。結果如圖2顯示3泳道較好。
(4)結果
PCR反應體系為50μl,包括:Mix 25μl,引物7μl,金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體上下游引物各為1μl、1μl、0.5μl、0.5μl、0.5μl,DNA每種1μl DNA,其余無菌水補足。反應條件:94℃預變性5min;進入94℃30s,60℃30s,72℃30s的循環,共30個循環;72℃終延伸7min。
實施例2 金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體的五重PCR人工樣本的檢測
(1)樣品前處理
取待檢測動物的樣本糞便和氣管分泌物。
(2)細菌DNA提取
同實施例1
(3)多重PCR反應體系建立
PCR反應體系為50μl,Mix 25μl,引物7μl,金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體上下游引物各為1μl、1μl、0.5μl、0.5μl、0.5μl,DNA分別為陽性對照5μl,陰性對照0μl,樣本糞便和氣管分泌物各2μl,其余無菌水補足至50μl。反應條件:94℃預變性5min;進入94℃30s,60℃30s,72℃30s的循環,共30個循環;72℃終延伸7min。PCR產物10μl在2.5%瓊脂糖凝膠中,120V電泳30min。
(4)結果
金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體的五重PCR樣本的檢測結果如圖3所示:1陽性對照;2陰性對照;3、7糞便和氣管分泌物的陰性對照;4金黃色葡萄球菌;5綠膿桿菌;6金黃色葡萄球菌和綠膿桿菌;8多殺巴氏桿菌;9支氣管敗血性波氏桿菌;10肺支原體;11多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體;12金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體。由結果看出,該五重PCR檢測體系可以檢出金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體。
實施例3 金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體的五重PCR樣本的檢測
(1)樣品前處理
取待檢測動物的樣本糞便和氣管分泌物。
(2)細菌DNA提取
同實施例1
(3)多重PCR反應體系建立
PCR反應體系為50μl,Mix 25μl,引物7μl,金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體上下游引物各為1μl、1μl、0.5μl、0.5μl、0.5μl,DNA分別為陽性對照5μl,陰性對照0μl,樣本糞便和氣管分泌物各2μl,其余無菌水補足至50μl。反應條件:94℃預變性5min;進入94℃30s,60℃30s,72℃30s的循環,共30個循環;72℃終延伸7min。PCR產物10μl在2.5%瓊脂糖凝膠中,120V電泳30min。
(4)結果
金黃色葡萄球菌、綠膿桿菌、多殺巴氏桿菌、支氣管敗血性波氏桿菌和肺支原體的五重PCR樣本的檢測結果如圖4所示:1陽性對照;2陰性對照;3-17樣本的糞便和氣管分泌物。陽性對照和陰性對照良好,樣本的檢測為陰性,與傳統方法的檢測結果一致。
SEQUENCE LISTING
<110> 河北醫科大學
<120> 一種同時檢測多種病原體的五重PCR檢測方法
<130>
<160> 10
<170> PatentIn version 3.3
<210> 1
<211> 22
<212> DNA
<213> Staphylococcus aureus
<400> 1
cacctgaaac aaagcatcct aa 22
<210> 2
<211> 21
<212> DNA
<213> Staphylococcus aureus
<400> 2
tatacgctaa gccacgtcca t 21
<210> 3
<211> 21
<212> DNA
<213> Pseudomonas aeruginosa
<400> 3
atgatcgtac aaattggtcg g 21
<210> 4
<211> 18
<212> DNA
<213> Pseudomonas aeruginosa
<400> 4
gtcatgaaac cgccagtc 18
<210> 5
<211> 23
<212> DNA
<213> Bordetella bronchiseptica
<400> 5
aggctcccaa gagagaaagg ctt 23
<210> 6
<211> 16
<212> DNA
<213> Bordetella bronchiseptica
<400> 6
tggcgcctgc cctatc 16
<210> 7
<211> 20
<212> DNA
<213> Mycoplasma pneumoniae
<400> 7
agcgtttgct tcactttgaa 20
<210> 8
<211> 20
<212> DNA
<213> Mycoplasma pneumoniae
<400> 8
gggcatttcc ctccctagct 20
<210> 9
<211> 20
<212> DNA
<213> Pasteurella multocida
<400> 9
gtgagtgggc ttctcggtag 20
<210> 10
<211> 20
<212> DNA
<213> Pasteurella multocida
<400> 10
gctgtaaacg aactcgccac 20
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種封閉式病原體檢測卡盒的制作方法與工藝
- 檢測16種呼吸道病原體的基因芯片檢測用試劑盒及方法與流程
- 一種同時檢測多種病原體的五重PCR檢測方法與流程
- 逆轉腫瘤多藥耐藥的基因組合物h?R3/PAMAM G5/MDR1 siRNA及其應用的制作方法與工藝
- 用于對肉類、植物或植物部分進行病原體檢測和病害治理的方法與流程
- 一種用于檢測治療惡性腫瘤的一線藥物耐藥基因表達量的試劑盒的制造方法與工藝
- 用于檢測植物病原體的裝置和方法與流程
- 用于檢測多種病原體的熒光實時檢測方法及應用與流程
- 一種用于檢測手足口病相關病原體的LAMP引物組合物及其相關應用的制造方法與工藝
- 一種用于檢測巴氏桿菌氯霉素類藥物耐藥基因的分子標記及其應用的制造方法與工藝