特異靶向多肽自組裝納米載體、載藥納米顆粒及制備方法與流程
本發明屬于自組裝納米材料領域,尤其涉及一種特異靶向多肽自組裝納米載體和納米顆粒,以及它們的制備方法。
背景技術:
自組裝過程是自然界億萬年進化過程中普遍存在的一種現象。DNA合成、RNA轉錄和調控、以及蛋白質的合成與折疊等生化過程都是自組裝的過程。此外,大量復雜的、具有生物學功能的大分子體系都是通過分子自組裝形成的,就連更完整和更復雜的生命有機體也是自組裝形成的產物。自組裝過程的根本驅動力是分子間弱的相互作用力,主要是非共價鍵。這些非共價鍵如氫鍵、范德華力、靜電力、疏水作用、π-π堆積作用等的協同作用把原子、離子或分子連接在一起構建超分子結構。近年來,自組裝技術已經成為納米科技的重要手段,得到了快速發展。利用自組裝技術制備納米材料具粒徑可控,分散性好;純度高,廢物少;產物較穩定,不易發生團聚現象;操作儀器簡單等幾方面優勢。在醫藥研究領域中,利用自組裝技術可以制備識別并定向殺死腫瘤細胞的納米材料;還可用自組裝技術在細胞內放入裝配單體或組件使其在細胞內構成新的納米結構,從而發揮更大的生物醫藥功能。
隨著納米技術與納米科學的迅速發展,納米結構的成藥性越來越受到人們的關注與重視,尤其體現在納米結構的生物相容性和安全性。目前用來構建自組裝納米結構的材料主要包括有機無機雜化材料、高分子接枝共聚物、多肽、核酸分子等。人工合成的材料可以構建自組裝納米結構,但長期使用會積累潛在的毒性。由于多肽是生物體自身的材料,結構簡單、種類繁多、易于改性、具有相對的穩定性,并且與核酸相比,多肽具有結構多樣性的特點,是自組裝形成納米材料的理想構造單元。此外,不同的功能多肽分子可以進行模塊化功能集成,構建多功能天然藥物載體;與脂質體相比,具有較快的響應性;并且具有良好的環境響應特異性,因此相對于其他自組裝體系,多肽自組裝納米藥物體系具有更廣闊的應用前景。
隨著城市化、工業化、老齡化的全球加速,生態環境惡化,惡性腫瘤的發病率越來越高,成為人類健康的頭號殺手。惡性腫瘤一般具有復雜的微環境,其間大量的間質細胞及一些透明質酸和膠原蛋白等嚴重阻止了藥物運輸到腫瘤部位,從而使腫瘤具有低氧、微酸、某些蛋白特意表達等特殊理化性質,因此,基于其中特意高表達的受體或蛋白酶設計出高效靶向或響應微環境的’智能藥物’,有效降低化療藥物及其聯合用藥的毒副作用,成為一種主流思路。多肽納米藥物最為簡單方便的包藥策略就是利用兩親性多肽通過分子間非共價相互作用力對藥物進行包載輸運。既能有效延長功能肽分子在動物體內的半衰期,又能有效提高功能肽的抗腫瘤療效另一方面;針對腫瘤微環境的生物學特征,多肽納米藥物可以實現藥物的靶向輸運以及在腫瘤環境中的可控釋放,為多肽類藥物的開發及應用拓寬了前景。
技術實現要素:
本發明的第一個目的是提供一種特異靶向多肽自組裝納米載體的制備方法,采用的技術方案是:在特異性靶向于腫瘤細胞表皮生長因子受體的靶向肽的N端偶聯疏水性功能分子,得到兩親性多肽;使用有機溶劑溶解所述兩親性多肽,在超聲條件下,將溶有兩親性多肽的有機溶劑分散于水中,所述兩親性多肽經自組裝,即得所述納米載體。
其中,所述靶向肽的氨基酸序列如SEQ ID No.1所示。所述靶向肽可市購獲得,也可采用本領域常用的Fmoc固相合成法制備得到。
優選地,所述疏水性功能分子為C12-18的直鏈脂肪酸或膽固醇,優選為C12-18的直鏈脂肪酸。在靶向肽的N段偶聯疏水性功能基團可增強N端的疏水性,有利于后期的多肽自組裝。重要的是,與膽固醇等疏水性結構相比,直鏈脂肪酸更容易與多肽反應,且不容易脫離,穩定性更好。同時,C12-18的直鏈脂肪酸無其他側鏈基團,不會影響自組裝過程。
在具體的實施方式中,所述疏水性功能分子可采用十二烷酸、十四烷酸、十六烷酸、十八烷酸等。
優選地,制備兩親性多肽的方法為:將靶向肽溶于N,N-二甲基甲酰胺中,向其中加入所述疏水性功能分子和二異丙基乙胺,于室溫下反應,反應結束后,向反應體系中加入乙醚,分離出現的白色沉淀,即得。
其中,所述靶向肽與所述疏水性功能分子的摩爾比為1:(8-10)。
超聲條件是影響自組裝效果的一個關鍵因素,一般而言,超聲功率越大、頻率越高,自組裝效果越好,得到的納米載體粒徑越均一。優選地,本發明自組裝的超聲條件為:在超聲頻率30-50kHz,功率80-120W條件下,超聲8-15min。
優選地,溶解所述兩親性多肽的溶劑選自二甲基亞砜、二氯甲烷、甲醇中的一種,最優為二甲基亞砜。
本發明的第二個目的是提供采用上述任意一種制備方法得到的納米載體。
所述納米載體為球形結構,粒徑為20-30nm。該納米載體粒徑較小,有助于腫瘤細胞內吞,并具有體內穩定性,不容易被降解。該納米載體具有腫瘤部位特異靶向性,是一種生物安全、理想的藥物載體。多肽自組裝納米材料無毒、生物兼容性好;自組裝過程中不生成共價健,沒有逆反應,形成高度有序的納米結構,具有廣闊的應用前景。
本發明的第三個目的是提供一種特異靶向多肽自組裝納米載藥顆粒的制備方法,包括如下步驟:
(1)制備兩親性多肽:取特異性靶向于腫瘤細胞表皮生長因子受體的靶向肽,使其與疏水性功能分子反應,即得;
(2)制備納米載藥顆粒:將所述兩親性多肽溶解在含有疏水性藥物的有機溶劑中,得混合液;超聲條件下將所述混合液分散于水中,所述兩親性多肽在自組裝過程中包裹所述疏水性藥物,即得。
其中,所述靶向肽的氨基酸序列如SEQ ID No.1所示。所述靶向肽可市購獲得,也可采用本領域常用的Fmoc固相合成法制備得到。本發明以腫瘤細胞表達較多的表皮生長因子受體為靶點,納米載體可以特異結合表皮生長因子受體,通過受體介導的內吞使納米載體進入腫瘤細胞,相較于其他的靶點,如整合素、FAP-α等,表皮生長因子受體是大部分腫瘤細胞均陽性表達的受體,以此為靶點,可提供納米載體的普適性。
優選地,所述疏水性功能分子為C12-18的直鏈脂肪酸或膽固醇,優選為C12-18的直鏈脂肪酸。
在具體的實施方式中,所述疏水性功能分子可采用十二烷酸、十四烷酸、十六烷酸、十八烷酸等。最優選為十八烷酸。十八烷酸碳鏈長,疏水性強,自組裝過程中能夠作為疏水端位于納米載體內部,在包載藥物后,產物具有最佳的穩定性和較高的包載效率。
優選地,步驟(1)的具體操作為:將靶向肽溶于N,N-二甲基甲酰胺中,向其中加入所述疏水性功能分子和二異丙基乙胺,于室溫下反應,反應結束后,向反應體系中加入乙醚,分離出現的白色沉淀,即得。
其中,所述靶向肽與所述疏水性功能分子的摩爾比為1:(8-10)。
優選地,步驟(2)中,所述有機溶劑選自二甲基亞砜、二氯甲烷、甲醇中的一種。其中,以二氯甲烷或甲醇為溶劑時,自組裝過程中易揮發,且甲醇和二氯甲烷有較強的細胞毒性。因此,本發明最優選的溶劑為二甲基亞砜。以二甲基亞砜為溶劑時,兩親性多肽可順利自組裝包載藥物,藥物的包封率可達80%以上,且得到的自組裝納米顆粒粒徑均一,穩定性好,并具有良好的生物相容性。
優選地,步驟(2)中,所述有機溶劑與水的體積比為1:(100-200)。
優選地,所述疏水性藥物與所述兩親性多肽的摩爾比為1:(5-20)。
優選地,本發明自組裝的超聲條件為:在超聲頻率30-50kHz,功率80-120W條件下,超聲8-15min。
優選地,所述制備方法還包括自組裝結束后,靜置反應體系,采用透析法除去未包載的疏水性藥物的步驟。其中,所述透析法在水中進行。
本發明的兩親性多肽對疏水性藥物具有非常好的包封率。其中,所述兩親性多肽可包載單一的疏水性藥物,也可同時包載兩種及以上疏水性藥物,具體可依據實際應用而定。所述疏水性藥物可為抗腫瘤藥物,如用于胰腺癌的一線化療藥物吉西他濱和已經進入三期臨床的抗BRCA突變的奧拉帕尼等。
研究發現,當所述兩親性多肽的N端偶聯有C12-18的直鏈脂肪酸時,保證重量比為1:1的奧拉帕尼和吉西他濱效果突出,得到的載藥納米顆粒可用于胰腺導管腺癌的治療。
本發明的第四個目的是提供上述任意一種方法制備得到的特異靶向多肽自組裝載藥納米顆粒。
所述載藥納米顆粒為球形結構,粒徑均一,約為60-80nm。
本發明利用靶向腫瘤細胞的靶向肽和疏水性功能分子偶聯得到兩親性多肽,通過自組裝方式對抗腫瘤藥物進行包載以形成納米顆粒,該納米顆粒在靶向于腫瘤細胞后暴露出靶向肽,靶向于腫瘤細胞,并通過受體介導的內吞進入腫瘤細胞,釋放藥物,抑制DNA合成及修復,對腫瘤細胞進行雙重殺傷,抑制腫瘤生長。本發明的兩親性多肽具有高度有序的納米結構,為自組裝納米材料,自組裝過程中不產生共價鍵,沒有逆反應,用于腫瘤治療具有無毒,生物兼容性好的優勢。
在符合本領域常識的基礎上,上述各優選條件,可以相互組合,即得本發明各較佳實例。
本發明涉及到的原料和試劑均可市購獲得。
本發明取得了如下積極效果:與自由化療藥物比較,包載有疏水性藥物(如抗腫瘤藥物)的自組裝載藥納米顆粒對腫瘤部位具有更好的選擇性輸運效果,并具有較高的最大耐受劑量,且副作用小,有望作為一種新型納米藥物應用于臨床,具有良好的藥物開發潛力。
附圖說明
圖1是實施例1制備得到的納米載體在水溶液中的形貌圖像;
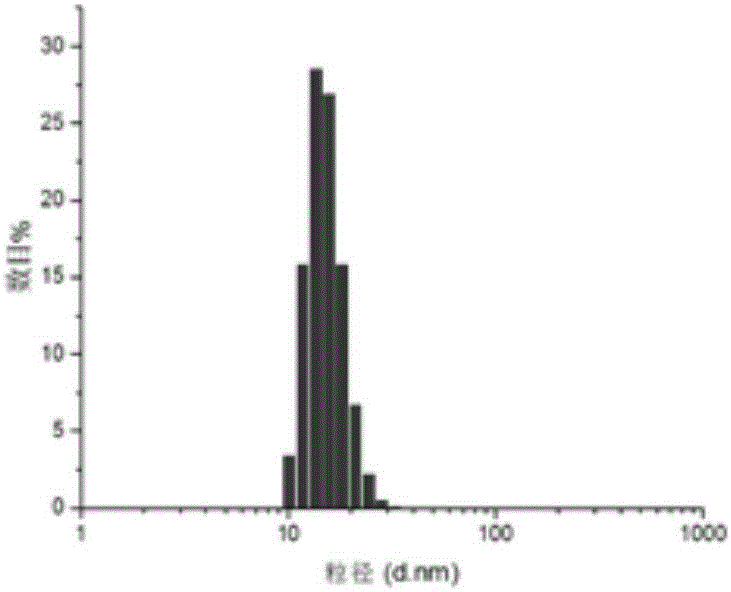
圖2是實施例1制備得到的納米載體的粒徑分布;
圖3是實施例2載藥后納米顆粒的形貌圖像;
圖4是實施例2中得到的納米顆粒載藥后的穩定性圖像;其中,左側為載藥后1h的形貌圖像,右側為載藥后48h的形貌圖像;
圖5是實施例2載藥納米顆粒的生物學實驗結果。
具體實施方式
以下實施例用于說明本發明,但不用來限制本發明的范圍。實施例中涉及的操作如無特殊說明,均為本領域常規技術操作。
其中,可被腫瘤部位表皮生長因子受體識別的靶向肽為本領域已知肽段,可市購獲得。或者,可采用本領域公知的Fmoc固相合成法制備得到。本發明提供一種具體的制備方法,本領域技術人員可以理解,該方法并不用于限定本發明,如下制備方法中涉及到的原料可市購獲得,例如購自吉爾生化(上海)有限公司、西格瑪奧德里奇公司。
(1)取1.01克二氯三苯甲基氯樹脂至多肽合成裝置,加入干燥的N,N-二甲基甲酰胺浸泡樹脂半小時,使之充分溶脹,最后排出溶劑N,N-二甲基甲酰胺。
(2)稱取0.2克Fmoc-Gly-OH用5毫升N,N-二甲基甲酰胺溶解,然后將該溶液轉入到上步含有處理過的樹脂的多肽合成裝置中,再加入2毫升催化劑二異丙基乙胺(DIEA),室溫下讓Fmoc-Gly-OH與樹脂相互作用約1.5小時,使其充分固定在樹脂上。用N,N-二甲基甲酰胺沖洗樹脂3次,加入甲醇攪拌30分鐘,封閉樹脂上未反應的活性位點,并再次用N,N-二甲基甲酰胺溶脹樹脂。然后用體積比為1:4的哌啶:N,N-二甲基甲酰胺溶液(5mL)進行保護基的脫除,反應3次,前兩次各持續3分鐘,第三次持續20分鐘。之后再用5mL的N,N-二甲基甲酰胺重復洗滌樹脂5次,每次持續1分鐘,直到N,N-二甲基甲酰胺洗液的pH顯中性。
(3)稱取0.92克Fmoc-Ile(tBu)-OH,0.72克2-(7-偶氮苯并三氮唑)-四甲基脲六氟磷酸酯,0.27克1-羥基苯并三唑,用10毫升N,N-二甲基甲酰胺溶解,然后將該溶液轉入到多肽合成裝置中,再加入2毫升催化劑二異丙基乙胺(DIEA),室溫下讓Fmoc-Gly(tBu)-OH與樹脂相互作用約2小時,使其充分連接到上一個氨基酸上,N,N-二甲基甲酰胺沖洗樹脂3次,取少許樹脂加入10%茚三酮的無水甲醇中加熱至沸騰,觀察樹脂顏色變化,若樹脂顏色無明顯變化,則說明第二個氨基酸已完全同上一個氨基酸偶聯,若樹脂變藍甚至發黑,則說明第二個氨基酸沒有與前一個氨基酸完全反應,需重復連接。
(4)重復以上步驟分別縮合(Fmoc-Val-OH,Fmoc-Asn-OH Fmoc-Gln(tBu)-OH,Fmoc-Pro-OH,Fmoc-Thr-OH,Fmoc-Tyr(tBu)-OH,Fmoc-Gly(tBu)-OH,Fmoc-Tyr(Boc)-OH,Fmoc-Trp-OH,Fmoc-His-OH,Fmoc-Tyr(tBu)-OH,Fmoc-Gly(tBu)-OH,Fmoc-Lys(Boc)-OH。用體積比為1:4的哌啶:N,N-二甲基甲酰胺溶液(5mL)進行保護基的脫除之后,加入0.21g無水乙酸/4mL吡啶的混合液,反應兩次、每次2小時。做完茚三酮測試,確保無水乙酸已經完全封閉了多肽的N末端,再用5mL的二氯甲烷重復洗滌樹脂5次,每次持續1分鐘。
(5)將多肽從樹脂上裂解下來,具體過程如下:首先配制裂解液:9.5mL三氟乙酸+0.85mL1,2-乙二硫醇+0.5mL茴香硫醚+0.5mL去離子水。將樹脂放入上述混合液中進行裂解反應3小時,之后過濾掉樹脂,在收集到的液體中加入乙醚,立即出現白色沉淀。然后,離心分離上述懸濁液,轉速為5000rpm、離心時間5分鐘,除去上清液,進行冷凍干燥,收集白色多肽粉末,即得靶向肽,命名為P-1。
實施例1
一種特異靶向多肽自組裝納米載體的制備方法,包括如下步驟:
(1)制備兩親性多肽分子:取50mg采用上述方法制備得到的靶向肽P-1,溶于5mL N,N-二甲基甲酰胺溶液中,向其中加入350mg十八烷酸、2毫升催化劑二異丙基乙胺(DIEA),室溫條件下反應12小時。停止反應后將液體滴加入無水乙醚中,立即出現白色沉淀。離心(轉速為5000rpm,離心時間5min)分離上述懸濁液除去上清液,對得到的產品進行冷凍干燥,收集白色粉末,即得兩親性多肽分子。
(2)制備納米載體:室溫下,將兩親性多肽分子溶解于20uL的二甲基亞砜溶液中,在超聲條件下將其分散于1mL水溶液中,超聲10min,取出穩定1h,即得。
實施例2
一種特異靶向多肽自組裝載藥納米顆粒的制備方法,包括如下步驟:
(1)制備兩親性多肽分子:取50mg采用上述方法制備得到的靶向肽P-1,溶于5mL N,N-二甲基甲酰胺溶液中,向其中加入350mg十八烷酸、2毫升催化劑二異丙基乙胺(DIEA),室溫條件下反應12小時。停止反應后將液體滴加入無水乙醚中,立即出現白色沉淀。離心(轉速為5000rpm,離心時間5min)分離上述懸濁液除去上清液,對得到的產品進行冷凍干燥,收集白色粉末,即得兩親性多肽分子,命名為P-2。
(2)制備載藥納米顆粒:室溫下,按藥物與兩親性多肽分子的摩爾比為1:(5-20)計,將1mg兩親性多肽分子和疏水性化療藥物溶解于20uL的二甲基亞砜溶液中,在超聲條件下將其分散于1mL水溶液中,超聲10min,取出穩定1h,在大體積去離子水中透析2h,以除去未包載的化療藥物,即得,命名此載藥納米顆粒為NPs。
實施例3
一種特異靶向多肽自組裝納米顆粒的制備方法,該實施例的制備方法同實施例2,區別僅在于將十八烷酸替換為十二烷酸。
實施例4
一種特異靶向多肽自組裝納米顆粒的制備方法,該實施例的制備方法同實施例2,區別僅在于將十八烷酸替換為十四烷酸,且靶向肽采用市售產品。
實驗例1形態觀察
使用電鏡觀察實施例1的納米載體,發現制備的納米載體為大小較均一、穩定的球形結構(參考附圖1),平均粒徑約為20-30nm(參考附圖2),表面電勢約為-10毫伏。
采用電鏡觀察實施例2載藥后的載藥納米顆粒,其粒徑變大,平均粒徑約為60-80nm(參考附圖3)。
實驗例2納米顆粒穩定性
對實施例2制備得到的載藥納米顆粒的藥物穩定性進行了測試,將其放置48h,然后用生物透射電鏡觀察其形貌,結果如圖4所示,從圖中可以看出:載藥前后納米顆粒的形貌幾乎沒有變化,證明合成的納米顆粒穩定性良好,可用于體內實驗。
實驗例3包封率測定
測定方法:
(1)繪制標準工作曲線:分別稱取43.6uM溶于2ml所需量的奧拉帕尼和吉西他濱,溶解于2ml二甲基亞砜中,等比稀釋10個濃度,每個濃度為1mL,利用紫外分光光度計測定二甲基亞砜中奧拉帕尼和吉西他濱在紫外吸收峰值處的吸光度;繪制標準工作曲線。
(2)將實施例1的1ml納米顆粒NPs水溶液凍干,之后溶解在1mL二甲基亞砜中,利用紫外分光光度計測定二甲基亞砜溶液中抗腫瘤藥物的吸光值;
(3)將步驟(2)測得的吸光值帶入標準工作曲線中,通過計算,得到奧拉帕尼和吉西他濱的包載質量;
(4)根據溶液中抗腫瘤藥物的濃度計算納米顆粒對奧拉帕尼和吉西他濱的包封率。其中,包封率=(化療藥物的包載質量/化療藥物原始加入量)×100%。
經計算,該納米顆粒對化療藥物的包封率可達80%。
實驗例4生物學實驗
實驗方法為:利用BRCA突變的細胞系canpan-1,將培養狀態良好的細胞接種于96孔板中,24h后分別給不同濃度的載藥納米顆粒(包載吉西他濱和奧拉帕尼),同時以不同濃度的吉西他濱和奧拉帕尼作為對照,在37℃孵育48h,吸走帶有藥物的培養基,加入10%CCK-8的無血清培養基,37℃孵育2-4h,利用酶標儀檢測其在450nm處的吸收,根據吸光度值作圖,計算IC50。
實驗結果:該實驗在細胞水平對治療效果進行了驗證(結果如圖5所示),和單藥相比,載藥納米顆粒明顯降低了藥物的IC50(致死細胞50%時的濃度),具有良好的靶向治療效果。
雖然,上文中已經用一般性說明、具體實施方式及試驗,對本發明作了詳盡的描述,但在本發明基礎上,可以對之作一些修改或改進,這對本領域技術人員而言是顯而易見的。因此,在不偏離本發明精神的基礎上所做的這些修改或改進,均屬于本發明要求保護的范圍。
序列表
<110> 國家納米科學中心
<120> 特異靶向多肽自組裝納米載體、載藥納米顆粒及制備方法
<130> KHP161117661.3
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 12
<212> PRT
<213> 人工序列
<400> 1
Tyr His Trp Tyr Gly Tyr Thr Pro Gln Asn Val Ile
1 5 10
- 還沒有人留言評論。精彩留言會獲得點贊!