OsSAPK9蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制作方法
本發明涉及一種OsSAPK9蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用。
背景技術:
由稻黃單胞水稻致病變種(Xanthomonas oryzae pv.oryzae,Xoo)引起的白葉枯病是全球稻作栽培中重要的細菌性病害之一,在我國華南和東南亞稻區危害嚴重。水稻白葉枯病一般可導致水稻減產10%左右,嚴重時可減產50%-60%。利用抗性基因,培育抗病品種是防治水稻白葉枯病最經濟有效的措施。采用表型鑒定、遺傳分析和基因定位等方法相結合,目前,國內外已發現報道40個水稻抗白葉枯病基因。然而,在已報道的水稻白葉枯病抗性基因中,由于來源于野生稻的抗病基因難以利用、部分抗病基因的抗性僅在水稻成株期以后表達以及大多抗性基因的抗譜較窄等原因,長期以來,僅Xa3、Xa4、Xa7、Xa21和Xa23等幾個基因在生產中得以應用。水稻白葉枯病菌具有復雜的多樣性和高度的變異性,攜帶單一主效基因的抗病品種大面積推廣種植后,潛在的毒性小種上升為優勢小種或由于病菌變異出現新的毒性小種,品種迅速抗性喪失,這是長期困擾育種家和植物病理學家的一個難題。因此,發掘和利用新基因,提高水稻對白葉枯病的抗性,對于水稻穩產具有重要的意義。
技術實現要素:
本發明的目的是提供一種OsSAPK9蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用。
本發明提供了一種培育轉基因水稻的方法,包括如下步驟:將編碼OsSAPK9蛋白的基因導入出發水稻,得到對白葉枯病的抗性提高的轉基因水稻。
所述OsSAPK9蛋白,獲自水稻,是如下(a)或(b):
(a)由序列表中序列2所示的氨基酸序列組成的蛋白質;
(b)將序列2的氨基酸序列經過一個或幾個氨基酸殘基的取代和/或缺失和/或添加且與植物白葉枯病抗性相關的由序列2衍生的蛋白質。
為了使(a)中的OsSAPK9蛋白便于純化和檢測,可在由序列表中序列2所示的氨基酸序列組成的蛋白質的氨基末端或羧基末端連接上如表1所示的標簽。
表1標簽的序列
上述(b)中的OsSAPK9可人工合成,也可先合成其編碼基因,再進行生物表達得到。上述(b)中的OsSAPK9蛋白的編碼基因可通過將序列表中序列1所示的DNA序列中缺失一個或幾個氨基酸殘基的密碼子,和/或進行一個或幾個堿基對的錯義突變,和/或在其5′端和/或3′端連上表1所示的標簽的編碼序列得到。
所述“編碼OsSAPK9蛋白的基因(簡稱OsSAPK9基因)”為如下(1)或(2)或(3):
(1)編碼區如序列表的序列1自5’末端第1-1086位核苷酸所示的DNA分子;
(2)在嚴格條件下與(1)限定的DNA序列雜交且編碼具有抗白葉枯病功能的蛋白質的DNA分子;
(3)與(1)或(2)限定的DNA序列具有90%以上同源性且編碼具有抗白葉枯病功能的蛋白質的DNA分子。
上述嚴格條件可為用0.1×SSPE(或0.1×SSC),0.1%SDS的溶液,在DNA或者RNA雜交實驗中65℃下雜交并洗膜。
所述方法中,所述OsSAPK9基因可以通過重組表達載體導入出發水稻。所述重組表達載體可通過Ti質粒、Ri質粒、植物病毒載體、直接DNA轉化、顯微注射、電導、農桿菌介導等常規生物學方法轉化到水稻細胞或組織中。
所述重組表達載體具體可為將載體pMDC43中插入了序列表的序列1所示的雙鏈DNA分子得到的重組質粒。
本發明還保護所述OsSAPK9蛋白的應用,為如下(c1)或(c2):
(c1)調控水稻對白葉枯病的抗性;
(c2)提高水稻對白葉枯病的抗性。
本發明還保護所述OsSAPK9基因的應用,為如下(c1)或(c2):
(c1)調控水稻對白葉枯病的抗性;
(c2)提高水稻對白葉枯病的抗性。
本發明還保護以上任一所述方法在水稻育種中的應用。
所述水稻育種的目的是選育對白葉枯病抗性高的水稻。
本發明還保護一種水稻育種方法,包括如下步驟:增加水稻中所述OsSAPK9蛋白的表達量和/或活性,從而促使水稻對白葉枯病的抗性提高。
本發明還保護一種培育轉基因水稻的方法,包括如下步驟:抑制目的水稻中所述OsSAPK9基因的表達,得到對白葉枯病的抗性降低的轉基因水稻。
所述“抑制目的水稻中所述OsSAPK9基因的表達”是通過導入RNAi載體實現的。
所述RNAi載體可通過Ti質粒、Ri質粒、植物病毒載體、直接DNA轉化、顯微注射、電導、農桿菌介導等常規生物學方法轉化到水稻細胞或組織中。
所述RNAi載體具體可為含有干擾片段的重組載體;所述干擾片段如序列表的序列3所示。
所述RNAi載體具體可為將載體pH7GWIWG2(II)中插入了序列表的序列3所示的雙鏈DNA分子得到的重組質粒。
所述序列3為OsSAPK9基因編碼區終止密碼子后第787位-第1339位核苷酸對應的區段。
本發明還保護一種特異DNA分子或所述特異DNA分子轉錄得到的RNA分子或所述特異DNA分子編碼的siRNA;所述DNA分子如序列表中序列3所示。
本發明還保護一種降低水稻對白葉枯病的抗性的方法,包括如下步驟:減少目的水稻中所述OsSAPK9蛋白的表達量和/或活性,得到對白葉枯病的抗性降低的水稻。
以上任一所述水稻具體可為水稻品系9804。
以上任一所述白葉枯病是由白葉枯病致病菌引起的。所述白葉枯病致病菌具體可為水稻黃單胞菌水稻致病變種(Xoo),更具體可為生理小種ZHE173。
本發明通過研究發現,水稻植株接種水稻白葉枯病菌(水稻黃單胞菌水稻致病變種)后OsSAPK9基因上調表達,表明該基因可能參與調控水稻對白葉枯病的抗性,進一步研究發現抑制OsSAPK9表達,水稻對白葉枯病的感病性提高;OsSAPK9過表達的水稻植株對白葉枯病的抗性顯著增強,表明該基因可以用于改良水稻對白葉枯病的抗性。本發明對于培育抗白葉枯病水稻新品種具有重要的意義,適合于推廣應用。
附圖說明
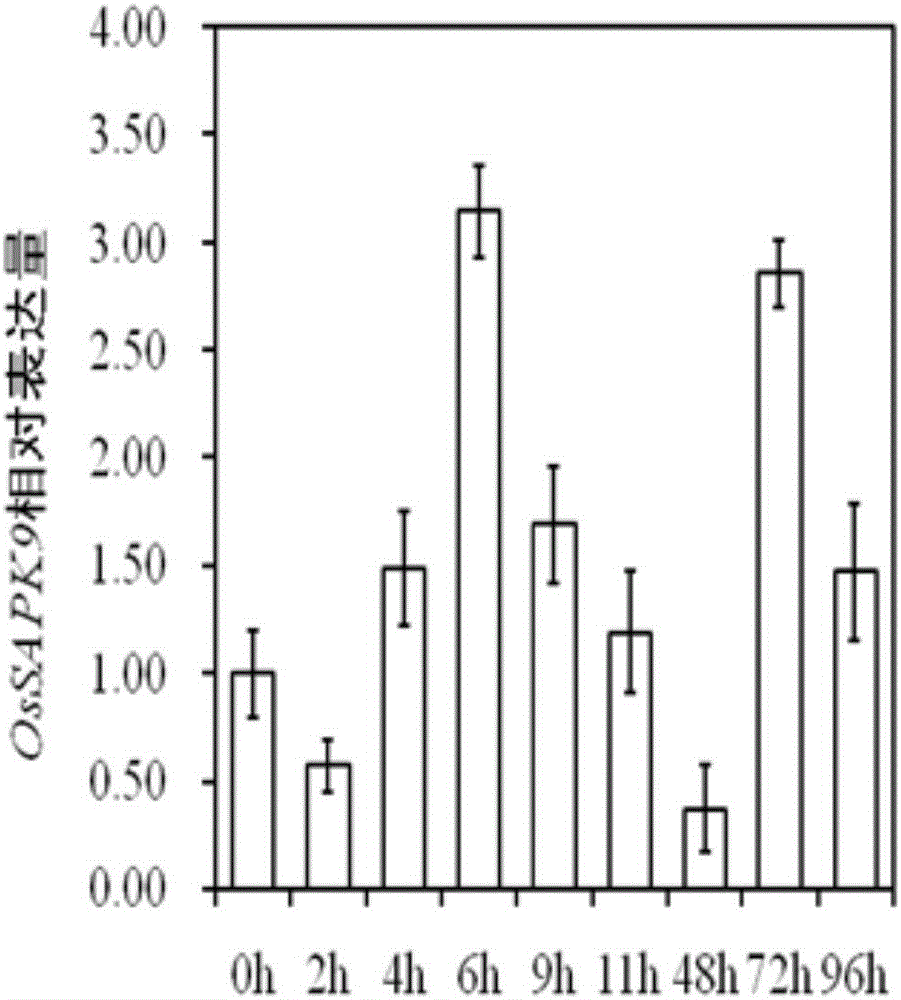
圖1為實施例1中水稻品系9804接種Xoo菌株ZHE173后OsSAPK9的表達情況。
圖2為實施例2中部分RNAi轉基因植株的PCR鑒定結果。
圖3為實施例2中野生型植株和RNAi轉基因植株中OsSAPK9的表達情況。
圖4為實施例2中野生型植株和RNAi轉基因植株的Southern雜交結果。
圖5為實施例2中野生型植株和RNAi轉基因植株葉片的病斑長度。
圖6為實施例3中部分轉基因植株的PCR鑒定結果。
圖7為實施例3中野生型植株和轉基因植株的Western blot結果。
圖8為實施例3中野生型植株和轉基因植株葉片的病斑長度。
具體實施方式
以下的實施例便于更好地理解本發明,但并不限定本發明。下述實施例中的實驗方法,如無特殊說明,均為常規方法。下述實施例中所用的試驗材料,如無特殊說明,均為自常規生化試劑商店購買得到的。以下實施例中的定量試驗,均設置三次重復實驗,結果取平均值。
OsSAPK9基因的編碼區序列如序列表的序列1所示,編碼序列表的序列2所示的蛋白質(OsSAPK9蛋白)。
水稻品系9804(簡稱9804水稻):參考文獻:謝學文,于晶,徐建龍,周永力,黎志康.玉米細菌性條斑病非寄主抗性基因Rxol轉化水稻的研究.生物工程學報,2007,23(4):607-611.;公眾可以從中國農業科學院作物科學研究所獲得。
Xoo菌株ZHE173:浙江省農業科學院植物保護研究所。參考文獻:李欣,于慧春,龐新躍,等.水稻白葉枯病菌內源過氧化氫的產生及定位[J].南京農業大學學報,2009,32(3):160-163.;公眾可以從中國農業科學院作物科學研究所獲得。
載體pDONR201:Invitrogen公司,貨號:11798-014。
載體pH7GWIWG2(II):參考文獻:徐品三,白建芳,劉紀文,等.Gateway技術快速構建百合雙價抗病毒RNAi表達載體[J].中國農學通報,2011,27(4):144-147.;公眾可以從中國農業科學院作物科學研究所獲得。
載體pMDC43:BioVector NTCC典型培養物保藏中心。
根癌農桿菌EHA105:BioVector NTCC典型培養物保藏中心。
誘導培養基:CaCl2·2H2O 440mg,KH2PO4 170mg,MgSO4·7H2O 370mg,NH4NO31650mg,KNO3 1900mg,KI 0.83mg,CoCl2·6H2O 0.025mg,H3BO3 6.2mg,Na2MoO4·2H2O 0.25mg,MnSO4·4H2O 22.3mg,CuSO4·5H2O 0.025mg,ZnSO4·7H2O 8.6mg,Na2-EDTA·2H2O 37.3mg,FeSO4·7H2O 27.8mg,VB1 0.1mg,VB6 0.5mg,煙酸0.5mg,肌醇100mg,甘氨酸2mg,2,4-D 2mg,水解酪蛋白2g,麥芽糖30g,瓊脂3g,去離子水加至1L。
侵染培養基:配制方法參見參考文獻:Hiei Y,Ohta S,Komari T,etal.Efficient transformation of rice(Oryza sativa,L.)mediated by Agrobacterium,and sequence analysis of the boundaries of the T-DNA[J].Plant Journal,1994,6(2):271-282.。將參考文獻中乙酰丁香酮的濃度替換為200μM。
共培養培養基:在誘導培養基中加入乙酰丁香酮和葡萄糖,使乙酰丁香酮在培養基中的終濃度為200μM,葡萄糖在培養基中的終濃度為10g/L。
抑菌培養基:在誘導培養基中頭孢霉素,使頭孢霉素在培養基中的終濃度為500mg/L。
篩選培養基:在誘導培養基中加入潮霉素和頭孢霉素,使潮霉素在培養基中的終濃度為65mg/L,頭孢霉素在培養基中的終濃度為500mg/L。
預再生培養基:CaCl2·2H2O 440mg,KH2PO4 170mg,MgSO4·7H2O 370mg,NH4NO31650mg,KNO3 1900mg,KI 0.83mg,CoCl2·6H2O 0.025mg,H3BO3 6.2mg,Na2MoO4·2H2O 0.25mg,MnSO4·4H2O 22.3mg,CuSO4·5H2O 0.025mg,ZnSO4·7H2O 8.6mg,Na2-EDTA·2H2O 37.3mg,FeSO4·7H2O 27.8mg,VB1 0.1mg,VB60.5mg,煙酸0.5mg,肌醇100mg,甘氨酸2mg,水解酪蛋白2g,麥芽糖30g,瓊脂3g,激動素2mg,萘乙酸1mg,去離子水加至1L;倒平板之前加入潮霉素并使其濃度為50mg/L。
再生培養基:CaCl2·2H2O 440mg,KH2PO4 170mg,MgS04·7H2O 370mg,NH4NO31650mg,KNO3 1900mg,KI 0.83mg,CoCl2·6H2O 0.025mg,H3BO3 6.2mg,Na2MoO4·2H2O 0.25mg,MnSO4·4H2O 22.3mg,CuSO4·5H2O 0.025mg,ZnSO4·7H2O 8.6mg,Na2-EDTA·2H2O 37.3mg,FeSO4·7H2O 27.8mg,VB1 0.1mg,VB6 0.5mg,煙酸0.5mg,肌醇100mg,甘氨酸2mg,水解酪蛋白2g,麥芽糖30g,瓊脂6g,激動素2mg,萘乙酸1mg,去離子水加至1L;倒平板之前加入潮霉素并使其濃度為50mg/L。
DNA Maker:Biomed,貨號:MD102。
實施例1、OsSAPK9基因表達分析
1、將9804水稻的種子播于盛有滅菌土壤的育秧盤中,在溫室中培養25天后移栽到網室中,單株種植。
2、在步驟1水稻植株的分蘗盛期,用Xoo菌株ZHE173,采用剪葉法對水稻植株進行人工接種,每株接種5張葉片。
3、完成步驟2人工接種的0、2、4、6、9、11、48、72、96h,剪取接種的葉片,迅速放入液氮中速凍,每樣品各取三個生物學重復。所有樣品液氮速凍后置-70℃保存。
4、取步驟3得到的樣品,提取樣品的總RNA,反轉錄為cDNA。
5、以步驟4得到的cDNA為模板,進行qRT-PCR反應,采用引物F和引物R檢測OsSAPK9基因的表達水平,采用引物Actin-F和引物Actin-R檢測內參基因(Actin基因)的表達水平。
F:5′-ATCAGTCTACAAGCCAGTCCAG-3′;
R:5′-TCCTCATCGCTCAAGTCCC-3′;
Actin-F:5′-GACTCTGGTGATGGTGTCAGC-3′;
Actin-R:5′-GGCTGGAAGAGGACCTCAGG-3′。
qRT-PCR反應體系為:10×buffer 2.5μL,dNTP 10mM(Mg2+,25mM)0.5μL,TaqDNA聚合酶0.5μL,模板cDNA 2μL(200-400ng),引物F 1μL,引物R 1μL,ddH2O 17.5μL。在反應體系中,引物F和引物R的濃度均為10μM。
qRT-PCR反應條件為:95℃5min;95℃30s,55℃30s,72℃30s,30個循環;72℃10min。
qRT-PCR分析結果顯示溶解曲線均為單峰,擴增產物特異性好,熒光曲線可以很好地反應擴增結果。對結果進行分析,結果如圖1所示。結果表明,在接種Xoo菌株ZHE173后,9804水稻葉片中OsSAPK9的表達量隨著接種時間的推移逐漸升高,接種6h后達到峰值,隨后又逐漸下降,在72h后,又達到另一峰值。
實施例2、OsSAPK9基因功能分析
一、OsSAPK9基因RNAi載體構建
1、提取9804水稻葉片的總RNA,反轉錄為cDNA。
2、以步驟1得到cDNA為模板,采用引物attB-F和引物attB-R進行PCR擴增,得到擴增產物。
attB-F:5′-GGGGACAAGTTTGTACAAAAAAGCAGGCTGCCAGGTTGACACACTGCGAA-3′;
attB-R:5′-GGGGACCACTTTGTACAAGAAAGCTGGGTAGTGCTTATCCTCAACTTCGC-3′。
3、通過BP反應,將步驟2得到的擴增產物導入載體pDONR201,得到含有序列表的序列3所示的雙鏈DNA分子的陽性入門克隆質粒pDONR201-OsSAPK9i(已經測序驗證)。
BP反應體系:擴增產物2.7μL(50-100ng),載體pDONR201 1.0μL(30-50ng),5×BP Reaction Buffer 1.0μL,BP Enzyme mix 0.3μL。
BP反應條件:25℃溫浴1h。
4、取步驟3得到的陽性入門克隆質粒pDONR201-OsSAPK9i,與載體pH7GWIWG2(II)進行LR反應,得到含有序列表的序列3所示的雙鏈DNA分子的RNAi表達載體pH7GWIWG2(II)-OsSAPK9i(已經測序驗證)。
LR反應體系:入門克隆質粒pDONR201-OsSAPK9i1μL(50-100ng),載體pH7GWIWG2(II)1μL(50-100ng),LR enzyme mix 0.5μL。
LR反應條件:25℃溫浴1h。
二、RNAi轉基因水稻的獲得
1、取9804水稻的成熟種子,機械脫殼,挑取飽滿光潔無菌斑的種子進行消毒。
2、將步驟1消毒后的種子接種到誘導培養基28℃、暗培養14天左右,選取外觀良好,生長力好的愈傷組織。
3、取步驟一構建的表達載體pH7GWIWG2(II)-OsSAPK9i,導入根癌農桿菌EHA105,得到重組菌EHA105/OsSAPK9i。
4、取步驟3得到的重組菌EHA105/OsSAPK9i,用侵染培養基重懸菌體,得到菌懸液。
5、將完成步驟2的愈傷組織浸泡于步驟4制備的菌懸液中,侵染20min。侵染后將菌懸液倒掉,取愈傷組織,用無菌濾紙吸干水分,然后置于共培養培養基上,培養28℃暗培養50-55h。
6、完成步驟5后,挑選表面沒有明顯農桿菌的愈傷組織移至抑菌培養基中,28℃暗培養3-4天。
7、完成步驟6后,將愈傷組織移至篩選培養基上28℃暗培養培養30天,每10天繼代一次。
8、完成步驟7后,取新鮮潮霉素抗性的愈傷組織,接于預再生培養基中,28℃暗培養7天,然后置于光照培養間(12h光照/12h黑暗)繼續培養7天后轉入再生培養基上,繼續光照培養,直至生長出再生植株,得到T0代植株。T0代植株自交,得到T1代植株。T1代植株自交,得到T2代植株。T2代植株自交,得到T3代植株。
三、RNAi轉基因水稻的鑒定
1、取步驟二獲得的各個株系的T2代植株,提取植株葉片的總RNA并反轉錄為cDNA。以cDNA為模板,采用引物Hyg-F和Hyg-R進行PCR鑒定。采用RNAi表達載體pH7GWIWG2(II)-OsSAPK9i作為陽性對照,采用9804水稻的cDNA作為陰性對照。
Hyg-F:5’-CTATTTCTTTGCCCTCGGAC-3’:
Hyg-R:5’-CCTGACCTATTGCATCTCCC-3’。
如果對于某一T0代植株,其抽樣檢測的T2代植株的PCR鑒定結果均為陽性,該T0代植株及其自交后代為一個純合的RNAi轉基因株系。
部分植株的PCR鑒定結果如圖2所示。圖2中,M為DNA Maker,+為陽性對照,-為陰性對照,泳道1-10依次對應10個不同株系的T2代植株。結果表明,10個株系的植株均能擴增出與質粒載體潮霉素基因一致的特異條帶,表明了帶如t/hyg標記基因的T-DNA已經插入并整合到受體基因組中,10個株系均為純合的RNAi轉基因株系。
2、選取步驟1RNAi轉基因株系中的2個RNAi轉基因株系(命名為Ri-21、Ri-27)的T2代植株,采用qRT-PCR分析各株系中OsSAPK9基因的表達量的變化,鑒定轉基因株系的RNAi效率。結果如圖3所示。結果顯示:RNAi轉基因株系Ri-21和Ri-27植株中OsSAPK9基因顯著下調表達。
3、為檢測外源基因OsSAPK9在水稻基因組中的整合情況,選取RNAi轉基因株系Ri-21和Ri-27的T2代植株,對其基因組DNA進行HindIII單酶切,以Hyg基因標記探針進行Southern雜交。結果如圖4所示,雜交結果顯示轉基因株系Ri-21是雙拷貝整合,Ri-27是三拷貝整合。
四、轉空載體株系的獲得
采用表達載體pH7GWIWG2(II)替代表達載體pH7GWIWG2(II)-OsSAPK9i按照步驟二的1-8進行操作,得到轉空載體株系。
五、RNAi轉基因株系的白葉枯病抗性鑒定
待測植株為:9804水稻(野生型)、RNAi轉基因株系Ri-21的T3代植株、RNAi轉基因株系Ri-27的T3代植株、轉空載體株系的T3代植株。
1、將待測植株的種子播于裝有淋過土壤殺菌劑的營養土壤的育秧盤中,在溫室中培養約25天后移栽至網室中進行種植,單株種植,每個株系種植20株。
2、在步驟1水稻植株的分蘗盛期,用Xoo菌株ZHE173,采用剪葉法對水稻植株進行人工接種,每株接種5張葉片(菌液濃度為1×109cfu/mL)。
3、完成步驟2后繼續培養14天,14天后測量各植株葉片的病斑長度,每個葉片沿葉脈有一個病斑,每個植株測量3張接種葉片的病斑長度,計算平均值。
結果如圖5所示。結果表明,野生型植株的病斑長度為15.8cm,RNAi轉基因株系Ri-21植株的病斑長度為18.7cm,顯著長于野生型的病斑長度;RNAi轉基因株系Ri-27植株的病斑長度為19.3cm,長于野生型的病斑長度。轉空載體水稻的病斑長度與野生型的病斑長度無顯著差異。結果表明抑制OsSAPK9基因表達,能夠提高水稻對白葉枯病的感病性。
實施例3、OsSAPK9基因在提高水稻白葉枯病中的應用
一、OsSAPK9基因過表達載體的構建
1、提取9804水稻葉片的總RNA,反轉錄為cDNA。
2、以步驟1得到cDNA為模板,采用引物attB-F1和引物attB-R1進行PCR擴增,得到擴增產物。
attB-F1:5′-GGGGACAAGTTTGTACAAAAAAGCAGGCTGCATGGAGAGGGCGGCGG-3′;
attB-R1:5′-GGGGACCACTTTGTACAAGAAAGCTGGGTGACATGGCATATACGATCTCTCCG-3′。
3、通過BP反應,將步驟2得到的擴增產物導入載體pDONR201,得到含有序列表序列1所示的雙鏈DNA分子的陽性入門克隆質粒pDONR201-OsSAPK9。
BP反應體系:擴增產物2.7μL(50-100ng),載體pDONR201 1.0μL(30-50ng),5×BP Reaction Buffer 1.0μL,BP Enzyme mix 0.3μL。
BP反應條件:25℃溫浴1h。
4、取步驟3得到的陽性入門克隆質粒pDONR201-OsSAPK9,與載體pMDC43進行LR反應,得到含有序列表序列1所示的雙鏈DNA分子的35S::GFP-OsSAPK9表達載體(已經測序驗證)。
LR反應體系:入門克隆質粒pDONR201-OsSAPK9 1μL(50-100ng),載體pMDC431μL(50-100ng),LR enzyme mix 0.5μL。
LR反應條件:25℃溫浴1h。
二、轉基因植株的獲得及鑒定
1、采用35S::GFP-OsSAPK9表達載體替代表達載體pH7GWIWG2(II)-OsSAPK9i按照實施例2步驟二的1-8進行操作,得到T2代植株。
2、取步驟1獲得的各個株系的T2代植株,提取植株葉片的總RNA并反轉錄為cDNA。以cDNA為模板,采用引物Hyg-F和Hyg-R進行PCR鑒定。采用35S::GFP-OsSAPK9表達載體作為陽性對照,采用9804水稻的cDNA作為陰性對照。
Hyg-F:5’-CTATTTCTTTGCCCTCGGAC-3’;
Hyg-R:5’-CCTGACCTATTGCATCTCCC-3’。
如果對于某一T0代植株,其抽樣檢測的T2代植株的PCR鑒定結果均為陽性,該T0代植株及其自交后代為一個純合的轉基因株系。
部分植株的PCR鑒定結果如圖6所示。圖6中,M為DNA Maker,+為陽性對照,-為陰性對照,泳道1-27依次對應27個不同株系的T2代植株。結果表明,除第20個泳道(OE20)和第22個泳道(OE22)中沒有擴增出明顯的陽性條帶,其余植株均能擴增出與質粒載體潮霉素基因一致的特異條帶,表明了第20和第22泳道對應的植株為假陽性植株,其余株系的植株中帶hpt/hyg標記基因的T-DNA均已經插入并整合到受體基因組中,均為純合的過表達轉基因株系。
3、待測植株為:OsSAPK9轉基因株系OE1的T2代植株、OE2的T2代植株、9804水稻、OE20假陽性植株。
取500mg待測植株的葉片,提取植物總蛋白,用標簽抗體GFP進行Western blot檢測。
檢測結果如圖7所示。結果表明:野生型9804水稻、陰性對照OE20假陽性植株中均未檢測到目的條帶,轉基因株系中均檢測到目的條帶,在總蛋白上樣量一致的前提下,轉基因株系OE2的植株中OsSAPK9的蛋白積累量顯著高于轉基因株系OE1植株中OsSAPK9的蛋白量。
三、轉空載水稻的獲得
采用表達載體pMDC43替代表達載體pH7GWIWG2(II)-OsSAPK9i按照實施例2步驟二的1-8進行操作,得到轉空載體株系。
四、對照轉基因株系的獲得
采用序列表的序列4所示DNA分子代替步驟一、二中的序列表的序列1所示DNA分子,得到轉基因株系I(所述序列4編碼序列5所示的蛋白質,序列5所示的蛋白質為OsSAPK9蛋白同家族中同源性最高的蛋白)。
采用序列表的序列6所示DNA分子代替步驟一、二中的序列表的序列1所示DNA分子,得到轉基因株系II(所述序列6編碼序列7所示的蛋白質,序列7所示的蛋白質為OsSAPK9蛋白同源性最高的蛋白)。
五、白葉枯病抗性檢測
待測植株為:野生型9804水稻、步驟二得到的OsSAPK9轉基因株系OE1的T3代植株、OE2的T3代植株、步驟三得到的轉空載體株系的T3代植株、步驟四得到的轉基因株系I的T3代植株、轉基因株系II的T3代植株。
1、將待測植株的種子播于裝有淋過土壤殺菌劑的營養土壤的育秧盤中,在溫室中培養約25天后移栽至網室中進行種植,單株種植,每個株系種植20株。
2、在步驟1水稻植株的分蘗盛期,用Xoo菌株ZHE173,采用剪葉法對水稻植株進行人工接種,每株接種5張葉片(菌液濃度為1×109cfu/mL)。
3、完成步驟2后繼續培養14天,14天后測量各植株葉片的病斑長度,每個葉片沿葉脈有一個病斑,每個植株測量3張接種葉片的病斑長度,計算平均值。
檢測結果如圖8所示。野生型9804水稻的病斑長度為15.7cm,轉空載體水稻的病斑長度與野生型9804水稻的病斑長度無顯著差異。OsSAPK9轉基因株系OE1的植株的病斑長度為11.3cm,顯著短于野生型9804水稻的病斑長度;OsSAPK9轉基因株系OE2的植株的病斑長度分別為8.7cm,顯著短于野生型9804水稻的病斑長度。轉基因株系I植株的病斑長度與野生型9804水稻的病斑長度無顯著差異,轉基因株系II植株的病斑長度與野生型9804水稻的病斑長度無顯著差異。上述結果表明OsSAPK9基因過表達可以提高水稻對白葉枯病的抗性。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 蝎神經毒素AaIT及其編碼基因與應用的制造方法與工藝
- 腈水解酶突變體及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白AsTMK1及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 一種花狹口蛙的基因及其編碼的多肽和該多肽的用途的制造方法與工藝
- 一種澤陸蛙基因及其編碼的多肽和該多肽的用途的制造方法與工藝
- 降低種子重量的白樺AP2基因及其編碼蛋白的制造方法與工藝
- 可編碼ArtRD蛋白基因及其蛋白和應用的制造方法與工藝
- 蝎神經毒素AaIT及其編碼基因與應用的制造方法與工藝
- 腈水解酶突變體及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白AsTMK1及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 腈水解酶突變體及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白AsTMK1及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 一種花狹口蛙的基因及其編碼的多肽和該多肽的用途的制造方法與工藝
- 一種澤陸蛙基因及其編碼的多肽和該多肽的用途的制造方法與工藝
- 一種水稻MIT1基因、其編碼蛋白及應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 一種水稻MIT1基因、其編碼蛋白及應用的制造方法與工藝
- 蛋白StTrxF、編碼基因及其在提高植物淀粉含量中的應用的制造方法與工藝
- 蛋白質及其編碼基因在調控植物抗黃萎病性中的應用的制造方法與工藝
- 甘薯耐逆相關蛋白IbFBA2、編碼基因、重組載體與應用的制造方法與工藝
- 植物抗旱相關蛋白ZmNAC111及其編碼基因與應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 一種水稻MIT1基因、其編碼蛋白及應用的制造方法與工藝
- 蛋白StTrxF、編碼基因及其在提高植物淀粉含量中的應用的制造方法與工藝
- 植物抗旱相關蛋白ZmNAC111及其編碼基因與應用的制造方法與工藝
- 核盤菌凝集素SSL?6蛋白及其編碼基因與應用的制造方法與工藝
- 植物抗病毒相關蛋白GmSN1及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 一種水稻MIT1基因、其編碼蛋白及應用的制造方法與工藝
- 蛋白StTrxF、編碼基因及其在提高植物淀粉含量中的應用的制造方法與工藝
- 蛋白質及其編碼基因在調控植物抗黃萎病性中的應用的制造方法與工藝
- 植物抗旱相關蛋白ZmNAC111及其編碼基因與應用的制造方法與工藝
- 核盤菌凝集素SSL?6蛋白及其編碼基因與應用的制造方法與工藝