獲得絨毛膜間充質干細胞的方法及試劑盒與流程
本發明涉及生物工程領域。具體地,本發明涉及獲得絨毛膜間充質干細胞的方法及試劑盒。
背景技術:
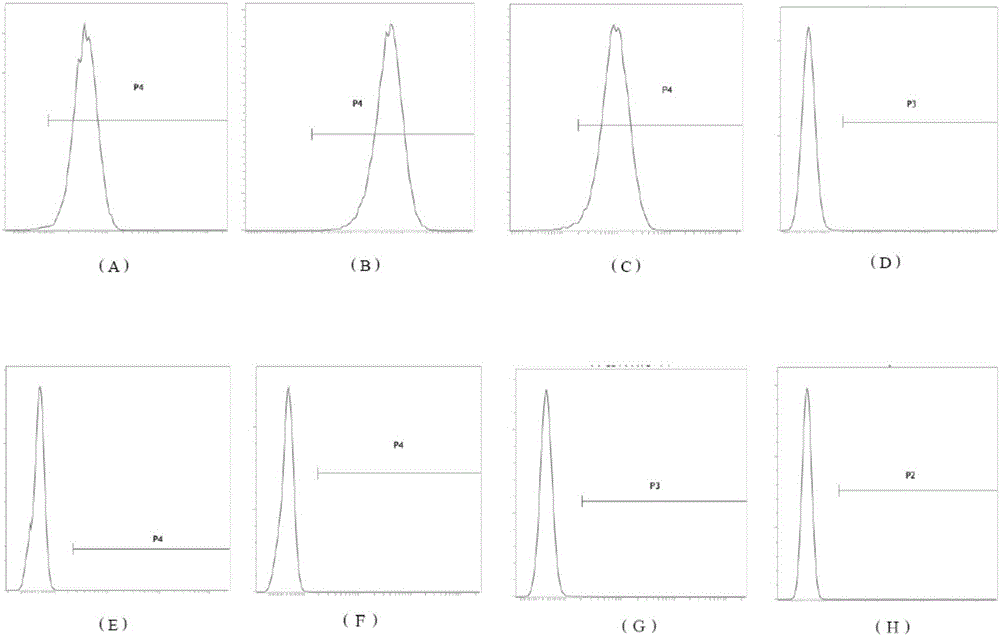
:絨毛膜間充質干細胞與絨毛的分布密切相關,多分布于絨毛內皮下以及絨毛附近間質內。絨毛膜間充質干細胞因取材方便、操作無侵入性、多向分化潛能大、增殖能力強、免疫原性低、病原污染風險低等優點而成為再生醫學的重要細胞來源和最具臨床應用前景的功能干細胞。然而,目前獲得絨毛膜間充質干細胞的方法仍有待改進。技術實現要素:本發明旨在至少在一定程度上解決現有技術中存在的技術問題至少之一。需要說明的是,本發明是基于發明人的下列發現而完成的:目前常用的絨毛膜間充質干細胞分離方法是將絨毛膜剪碎后直接用組織塊法培養,或者采用酶消化法,但是酶消化方法復雜,需多次酶消化,很容易造成細胞的損傷,難以獲得大量且純度較高的絨毛膜間充質干細胞。發明人發現,酶消化處理過程中,酶的種類、用量、消化時間等因素顯著影響酶消化處理效果,尤其是酶的種類,進而影響絨毛膜間充質干細胞的得率及活性。發明人經深入研究發現,單一酶的消化效果不佳,難以獲得大量且純度較高的絨毛膜間充質干細胞,而混合酶能夠有效地對絨毛膜進行消化,從而獲得大量、純度較高且活性較高的絨毛膜間充質干細胞。進一步地,發明人驚奇地發現,胰酶、膠原酶Ⅳ以及膠原酶Ⅱ的混合酶的消化效果最佳。為此,在本發明的一個方面,本發明提出了一種獲得絨毛膜間充質干細胞的方法。根據本發明的實施例,所述方法包括:利用混合酶制劑將絨毛膜進行消化處理,得到消化產物;以及從所述消化產物中分離所述絨毛膜間充質干細胞,其中,所述混合酶制劑包括:胰酶;膠原酶Ⅳ;以及膠原酶Ⅱ。利用消化處理方法,能夠將絨毛膜組織中細胞之間的蛋白質降解,從而分離出單個細胞。發明人發現,單一酶很難將絨毛膜消化完全,所得到的絨毛膜間充質干細胞量較少,由此需要進行多次消化。但是,多次消化容易造成細胞的損傷,難以獲得大量且活性較高的絨毛膜間充質干細胞。進而,發明人發現,采用混合酶制劑進行消化的效果較好,且無需多次消化,以減少對細胞的損傷。發明人意外地發現,采用包括胰酶、膠原酶Ⅳ以及膠原酶Ⅱ的混合酶制劑進行消化,能夠獲得大量、純度較高且活性較高的絨毛膜間充質干細胞。然而,利用其他種類酶的效果不佳。根據本發明的實施例,所述獲得絨毛膜間充質干細胞的方法還可以具有下列附加技術特征:根據本發明的實施例,所述混合酶制劑包括:0.05質量%~0.25質量%的胰酶;1~2μg/mL的膠原酶Ⅳ;以及0.1質量%的膠原酶Ⅱ。發明人意外地發現,胰酶、膠原酶Ⅳ以及膠原酶Ⅱ的濃度顯著影響消化效率,進而影響絨毛膜間充質干細胞的得率、純度及活性。在上述最優混合濃度下,絨毛膜間充質干細胞的得率、純度及活性較高。根據本發明的具體實施例,混合酶制劑中胰酶濃度可以為0.08質量%、0.10質量%、0.13質量%、0.18質量%或0.21質量%。當胰酶、膠原酶Ⅳ以及膠原酶Ⅱ的濃度過高,將對絨毛膜間充質干細胞造成損傷,使其活性下降,若胰酶、膠原酶Ⅳ以及膠原酶Ⅱ濃度過低,無法充分消化,從而使得到的絨毛膜間充質干細胞的得率及純度較低。由此,根據本發明實施例的獲得絨毛膜間充質干細胞的方法能夠獲得大量、純度較高且活性較好的絨毛膜間充質干細胞。根據本發明的實施例,所述混合酶制劑與絨毛膜的用量比為0.5~2:1,優選1:1。發明人發現,混合酶制劑的添加量顯著影響消化處理效果,進而影響絨毛膜間充質干細胞的產率及活性。發明人意外地發現,當混合酶制劑與絨毛膜的用量比為0.5~2:1,優選1:1時,能夠獲得大量、純度較高且活性較高的絨毛膜間充質干細胞。若添加量過多,容易造成細胞損傷,活性下降。在實際情況下,本領域技術人員可以根據需要選擇消化處理條件,例如反應溫度、時間,對此本申請不作嚴格限定,只要能夠得到絨毛膜間充質干細胞即可。根據本發明的一些實施例,所述消化處理是在35~37℃的溫度、100~200rpm的轉速下震蕩30~60min。根據本發明的優選實施例,所述消化處理是在37℃的溫度、150rpm的轉速下震蕩30min。發明人意外地發現,在此條件下能夠獲得大量、純度較高且活性較高的絨毛膜間充質干細胞。消化處理溫度顯著影響酶活性,溫度過高或過低都將造成酶活力過低,導致消化效率降低,所得到的細胞量較少。消化處理時間過長,會造成細胞損傷,使其活性降低,時間過短,酶消化不充分,所得到的細胞量較少。若震蕩時間過長,將破壞細胞的結構,造成損傷。根據本發明的具體實施例,消化處理后,通過向消化反應體系中加入胎牛血清(FBS),以終止消化反應。需要說明的是,對于從消化產物中分離絨毛膜間充質干細胞的方法不作嚴格限定,只要能夠獲得絨毛膜間充質干細胞即可。根據本發明的實施例,為了得到純度較高的絨毛膜間充質干細胞,所述分離包括:將所述消化產物進行過濾,收集濾液;將所述濾液進行離心,收集細胞;以及將所述細胞進行清洗,以便獲得所述絨毛膜間充質干細胞。由此,能夠有效地除去附著于細胞上的消化液,且避免對細胞造成損傷,從而獲得純度較高且活性較強的絨毛膜間充質干細胞。根據本發明的實施例,所述方法包括:利用混合酶制劑將裁剪成尺寸為4cm×4cm的所述絨毛膜進行消化處理,得到消化產物;將所述消化產物進行稀釋,并利用100目篩網將所得到的稀釋液進行過濾,收集濾液;以及將所述濾液在1200rpm的轉速下離心6min,棄上清,得到所述絨毛膜間充質干細胞。發明人發現,將絨毛膜裁剪至尺寸為4cm×4cm,使得進行消化反應的細胞面積較大,促使消化反應充分發生。接著,將消化產物稀釋,以便于后續過濾。然后將稀釋液過篩,以除去大塊組織。此外,將濾液在1200rpm下離心6min,既能夠沉淀細胞,便于收集,同時較小地破壞細胞的結構及活性。從而,能夠獲得大量、純度較高且活性較高的絨毛膜間充質干細胞。根據本發明的實施例,所述方法進一步包括擴增處理,所述擴增處理包括:將所述絨毛膜間充質干細胞重懸于培養基中,得到混合液;將所述混合液接種于所述培養基中,37℃,5%CO2下培養至出現克隆,長至傳代。發明人發現,分離獲得的絨毛膜間充質干細胞為單個細胞,將其進行擴增以得到大量的絨毛膜間充質干細胞。在上述最優擴增處理條件下,擴增的同時還可以使其活性進一步提高。在本發明的另一方面,本發明提出了一種試劑盒。根據本發明的實施例,所述試劑盒包括:胰酶;膠原酶Ⅳ;以及膠原酶Ⅱ。根據本發明的具體實施例,所述試劑盒用于獲得絨毛膜間充質干細胞。利用消化處理方法,能夠將絨毛膜組織中細胞之間的蛋白質降解,從而分離出單個細胞。發明人發現,單一酶很難將絨毛膜消化完全,所得到的絨毛膜間充質干細胞量較少,由此需要進行多次消化。但是,多次消化容易造成細胞的損傷,難以獲得大量且活性較高的絨毛膜間充質干細胞。進而,發明人發現,采用混合酶制劑進行消化的效果較好,且無需多次消化,以減少對細胞的損傷。發明人意外地發現,采用包括胰酶、膠原酶Ⅳ以及膠原酶Ⅱ的混合酶制劑進行消化,能夠獲得大量、純度較高且活性較高的絨毛膜間充質干細胞。根據本發明的實施例,所述試劑盒包括:0.05質量%~0.25質量%的胰酶;1~2μg/mL的膠原酶Ⅳ;以及0.1質量%的膠原酶Ⅱ。發明人意外地發現,胰酶、膠原酶Ⅳ以及膠原酶Ⅱ的濃度顯著影響消化效率,進而影響絨毛膜間充質干細胞的得率、純度及活性。在上述最優濃度下,絨毛膜間充質干細胞的得率、純度及活性較高。根據本發明的具體實施例,胰酶濃度可以為0.08質量%、0.10質量%、0.13質量%、0.18質量%或0.21質量%。當胰酶、膠原酶Ⅳ以及膠原酶Ⅱ的濃度過高,將對絨毛膜間充質干細胞造成損傷,使其活性下降,若胰酶、膠原酶Ⅳ以及膠原酶Ⅱ濃度過低,無法充分消化,從而使得到的絨毛膜間充質干細胞的得率及純度較低。由此,根據本發明實施例的試劑盒能夠獲得大量、純度較高且活性較好的絨毛膜間充質干細胞。本發明的附加方面和優點將在下面的描述中部分給出,部分將從下面的描述中變得明顯,或通過本發明的實踐了解到。附圖說明本發明的上述和/或附加的方面和優點從結合下面附圖對實施例的描述中將變得明顯和容易理解,其中:圖1顯示了根據本發明一個實施例的顯微鏡照片,其中,(A)為放大40倍,(B)為放大100倍;圖2顯示了根據本發明一個實施例的細胞表型鑒定分析圖,其中,(A)為間質干細胞標志CDl05;(B)為間質干細胞標志CD90;(C)為間質干細胞標志CD73;(D)為造血細胞標志CD19;(E)為造血細胞標志CD34;(F)為造血細胞標志CD45;(G)為造血細胞標志CD14;(H)為人白細胞抗原HLA-DR;圖3顯示了根據本發明一個實施例的放大倍數為400倍的顯微鏡照片,其中(A)為成脂細胞,染色劑為油紅O;(B)為早期成骨細胞,染色劑為茜素紅;(C)為晚期成骨細胞,染色劑為VonKossa;(D)為成軟骨細胞的HE染色;(E)為成軟骨細胞,染色劑為阿爾辛蘭;(F)為成軟骨細胞,染色劑為甲苯胺藍;以及圖4顯示了根據本發明一個實施例的細胞活力分析圖。具體實施方式下面將結合實施例對本發明的方案進行解釋。本領域技術人員將會理解,下面的實施例僅用于說明本發明,而不應視為限定本發明的范圍。實施例中未注明具體技術或條件的,按照本領域內的文獻所描述的技術或條件或者按照產品說明書進行。所用試劑或儀器未注明生產廠商者,均為可以通過市購獲得的常規產品。下面將結合實施例對本發明的方案進行解釋。本領域技術人員將會理解,下面的實施例僅用于說明本發明,而不應視為限定本發明的范圍。實施例中未注明具體技術或條件的,按照本領域內的文獻所描述的技術或條件或者按照產品說明書進行。所用試劑或儀器未注明生產廠商者,均為可以通過市購獲得的常規產品。實施例在該實施例中,按照下列方法獲得絨毛膜間充質干細胞:(1)將平滑絨毛膜剪至4cm×4cm大小,生理鹽水洗三次,盡量將血洗凈;(2)再將洗凈的5g組織塊轉移到10cm平皿中,每平皿加入5ml的混合酶制劑,其中含0.25%胰酶,2μg/mL膠原酶Ⅳ和0.1質量%的膠原酶Ⅱ,37℃的溫度、150rpm的轉速下震蕩30min。加入胎牛血清終止胰酶消化,并向所得到的消化產物中加入生理鹽水,稀釋5倍,得到稀釋液;(3)將稀釋液通過100目篩網過濾,收集濾液,1200rpm離心6min,生理鹽水洗兩次,棄上清,得到絨毛膜間充質干細胞;(4)用2ml原代培養基重懸絨毛膜間充質干細胞并接種,37℃,5%CO2下培養直至克隆出現,長至傳代,期間每隔48h換液一次,以得到擴增的絨毛膜間充質干細胞。對比例按照實施例的方法獲得絨毛膜間充質干細胞,區別在于,步驟(2)中,僅用0.1質量%的膠原酶Ⅱ進行消化。對實施例擴增后的絨毛膜間充質干細胞進行檢測1.細胞形態:將絨毛膜間充質干細胞在顯微鏡下觀察,結果如圖1所示。可以看出,細胞貼壁,呈梭形,片狀生長。2.細胞表型鑒定:取傳至3代的絨毛膜間充質干細胞,消化后成單細胞懸液,按4×105個每管進行分裝。1×PBS洗一次,300g離心5min,棄上清。100μl1×PBS重懸細胞,每管分別加入攜帶熒光標記的一抗CD90-FITC、CD73-PE、CD105-PE、CD34-PE、CD19-PE、CD45-PE、CD14-FITC及HLA-DR-PE(購自美國BDPharmingen公司,按說明書給量),設一管為直標抗體PE-isotype空白對照,一管為直標抗體FITC-isotype空白對照,4℃搖床,避光反應40min。1×PBS清洗3次,每次300g離心5min,1%多聚甲醛固定,4℃放置,流式細胞儀檢測,結果如圖2和表1所示,可以看出,細胞表型均一,細胞表達間質細胞標記CD73、CD90、CD105,不表達造血細胞標記CD34、CD14、CD45、CD19,且不表達人白細胞抗原HLA-DR,完全符合“國際細胞治療協會”關于間充質干細胞表面標志物規定的標準。表1流式細胞儀檢測細胞表型檢測值正常參考值CD90100%>95%CD7398.33%>95%CD10599.21%>95%CD340.10%<2%CD450%<2%CD140.33%<2%CD190.09%<2%HLA-DR0.%<2%3.三系分化:3.1脂肪誘導分化:3.1.1取傳至3代的絨毛膜間充質干細胞以1.0×105/孔接種于24孔培養板中,待細胞密度達到100%時,棄上清(用移液槍輕輕吸走)加入提前配置好的成脂分化誘導A液(成脂誘導啟動培養基),3天后再換成誘導B液(成脂誘導維持培養基)。24h后再換成A液,如此循環3-5個周期,完成后用B液換掉舊的B液,每三天跟換一次,再放置七天,得到誘導細胞。3.1.2油紅O染色鑒定脂滴形成誘導細胞去掉培養基,PBS洗一次,加入4%多聚甲醛固定30min,蒸餾水洗3次,原液(0.5%油紅O)6ml,加蒸餾水4ml,靜置5~10min,濾紙過濾;染色20min,蒸餾水洗3次,鏡下觀察照相,如圖3所示。可以看出,誘導后出現明顯的脂滴,油紅O染色呈陽性,說明細胞具有較強的向脂肪細胞分化的能力。3.2成骨誘導分化3.2.1取傳至3代的絨毛膜間充質干細胞以5×104/孔接種于24孔培養板中,正常培養24h后棄上清(用移液槍輕輕吸走)加入提前配置好的成骨誘導培養基,每3天換液。3.2.2成骨誘導檢測方法茜素紅染色:誘導14d絨毛膜間充質干細胞,得到早期成骨細胞,吸棄誘導培養液,PBS沖洗,4%多聚甲醛室溫固定30min,雙蒸水沖洗,使用茜素紅工作液37℃孵育30min,雙蒸水沖洗。Vonkossa染色:誘導21d絨毛膜間充質干細胞,得到晚期成骨細胞,參照細胞VonKossas鈣染色試劑盒進行染色。分別將染色后的早期成骨和晚期成骨在顯微鏡下觀察,如圖3所示。可以看出,早期成骨細胞的茜素紅染色呈陽性,說明細胞具有較強的向成骨細胞分化的能力。晚期成骨細胞Vonkossa染色為陽性,說明誘導分化的細胞已形成骨細胞的鈣化結節,證明細胞具有較強的向成骨細胞分化的能力。3.3軟骨誘導分化3.3.1取傳至3代的絨毛膜間充質干細胞以5×105/管接種于15ml離心管中,正常培養24h后棄上清(用移液槍輕輕吸走)加入提前配置好的成軟骨誘導培養基,臨用前加TGF-β3,每3天換一次液。3.3.2軟骨誘導檢測方法形成的微團在上述體系內培養4周,每隔3天換液,誘導完畢后,進行石蠟包埋和切片。切片分別經1%甲苯胺藍、阿爾辛蘭染色、HE染色鑒定軟骨特異性蛋白聚糖。如圖3所示。可以看出,HE染色、甲苯胺藍染色、阿爾辛蘭染色呈陽性,說明細胞具有很強的向軟骨細胞分化的能力。活力測定比較實施例和對比例的步驟(3)所得到的絨毛膜間充質干細胞的活力,具體步驟如下:分別將實施例和對比例的步驟(3)所得到的絨毛膜間充質干細胞用生理鹽水洗2遍,加入不含動物成分的TrypLEExpress消化約30s,鏡下可見短梭形貼壁細胞變圓并懸浮起來后,加入生理鹽水吹打細胞并將細胞轉移至離心管,1200rpm離心5min,棄掉上清液,用2ml的生理鹽水重懸,通過細胞活力分析儀檢測細胞的活力。實施例步驟(3)所得到的絨毛膜間充質干細胞為91.6%。說明利用本發明的方法獲得絨毛膜間充質干細胞過程中,消化處理條件溫和,對絨毛膜間充質干細胞損傷較小,使得到的絨毛膜間充質干細胞活性較強。對比例所得到的絨毛膜間充質干細胞的活力僅為74.4%(如圖4所示),且實施例步驟(3)的絨毛膜間充質干細胞的得率為對比例的3倍。說明本發明的方法所得到的絨毛膜間充質干細胞的得率及活性均較高。在本說明書的描述中,參考術語“一個實施例”、“一些實施例”、“示例”、“具體示例”、或“一些示例”等的描述意指結合該實施例或示例描述的具體特征、結構、材料或者特點包含于本發明的至少一個實施例或示例中。在本說明書中,對上述術語的示意性表述不必須針對的是相同的實施例或示例。而且,描述的具體特征、結構、材料或者特點可以在任一個或多個實施例或示例中以合適的方式結合。此外,在不相互矛盾的情況下,本領域的技術人員可以將本說明書中描述的不同實施例或示例以及不同實施例或示例的特征進行結合和組合。盡管上面已經示出和描述了本發明的實施例,可以理解的是,上述實施例是示例性的,不能理解為對本發明的限制,本領域的普通技術人員在本發明的范圍內可以對上述實施例進行變化、修改、替換和變型。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1